2. 山东省医学科学院放射医学研究所
2. Institute of Radiation Medicine, SDMS
巨噬细胞(Macrophages)是机体重要的固有免疫细胞,具有吞噬病菌和递呈抗原的作用,能够直接杀伤肿瘤细胞,也能激活细胞免疫进而清除肿瘤细胞。根据活化状态及功能将巨噬细胞分为两种极化群体:经典活化的M1型巨噬细胞和选择性活化的M2型巨噬细胞。M1型巨噬细胞参与炎性反应,能够吞噬细菌、释放炎症介质、递呈抗原、启动免疫应答;M2型巨噬细胞抗原递呈能力较差,具有促进血管生成和组织重构的作用,被认为是抑炎性巨噬细胞。M2型巨噬细胞又可以分为三个亚群[1]:由IL-4或IL-13诱导的M2a亚群;免疫复合物/TLR诱导的M2b亚群以及IL-10和糖皮质激素诱导的M2c亚群。目前的研究中常用的M2型巨噬细胞的标志分子主要有YM-1和Arg-1。最近的研究发现:实体肿瘤中存在大量的巨噬细胞,约占总炎性细胞的30%~50%[2],这些进入肿瘤组织的巨噬细胞被称为肿瘤相关巨噬细胞(Tumor-associated macrophages, TAMs),TAMs通过调节肿瘤生长、血管和淋巴管生成、肿瘤基质重塑和免疫抑制方面在肿瘤复发和转移中发挥重要作用,肿瘤组织中TAMs的大量浸润与肿瘤的不良预后显著相关[3]。
放射治疗作为治疗肿瘤的重要手段之一,60%~70%的肿瘤患者在病程的不同时期接受放射治疗,尽管放射治疗设备和方法不断改进,但是仍有部分肿瘤经过一段时间放射治疗后复发或转移,其中涉及的机制尚未完全阐明。近年来研究发现:放射治疗后肿瘤组织周围聚集了较多的巨噬细胞,这些肿瘤相关巨噬细胞不但不能发挥正常的抗肿瘤作用,反而分泌细胞因子促进肿瘤血管和淋巴管生成,促进肿瘤生长、侵袭和转移[4]。
目前的研究证实:放射治疗后大量的TAMs前体细胞募集到肿瘤组织分化成TAMs,但是电离辐射后募集到肿瘤微环境中分化成的TAMs与肿瘤组织本身已经存在的TAMs功能存在差别[5],提示辐射对巨噬细胞功能的影响,但是目前辐射诱导的TAMs与肿瘤局部原本存在的TAMs的功能差别尚未完全阐明[6]。本研究以小鼠巨噬细胞RAW264.7为研究对象,通过探讨并比较IL-4诱导后给予电离辐射和IL-4诱导前给予电离辐射对小鼠巨噬细胞RAW264.7细胞M2型极化的影响,以模拟放射治疗时肿瘤局部已经存在的M2型巨噬细胞和放射治疗后肿瘤局部分化而成的M2型巨噬细胞,以期寻找两者的表型及功能差别为肿瘤的放射治疗提供理论基础。
1 材料与方法 1.1 材料小鼠单核巨噬细胞RAW264.7(江苏凯基生物技术股份有限公司)、鼠源重组白细胞介素4(rIL-4,novoprotein)、抗鼠CD206单克隆荧光抗体(eBioscience)、抗鼠CD209单克隆荧光抗体(eBioscience)、Anti-Liver Arginase抗体(abcam)、Anti-Ym-1+Ym-2抗体(abcam);流式细胞仪(BD)、Western电泳仪(美国BIO-RAD)。
1.2 实验方法 1.2.1 细胞培养及处理细胞用DMEM高糖培养基(含10%热灭活胎牛血清、100 U/mL青霉素,100 U/mL链霉素)于37℃、5%CO2培养箱中培养。
1.2.2 X射线照射方式采用美国Varian 21EX医用6 MV直线加速器,细胞培养板放置在1.5cm等效蜡板上,源皮距100 cm,照射野10 cm×10 cm,剂量率400 cGy/min,照射剂量梯度为0 Gy、2 Gy、5 Gy、10 Gy。
1.2.3 处理方式第一组X射线照射细胞24 h后给予10 ng/mL IL-4刺激12 h后流式细胞仪检测CD206、CD209,Western blot检测Arg-1和YM-1;第二组10 ng/mL IL-4刺激细胞3h后X射线照射9 h后流式细胞仪检测CD206、CD209,Western blot检测Arg-1和YM-1。
1.2.4 流式细胞术检测分别采用PE标记抗CD206,FITC标记抗CD209单抗处理细胞,流式细胞术检测细胞表面CD206和CD209的表达,重复3次,Cellquest软件分析结果。
1.2.5 Western blot检测Western blot检测Arg-1和YM-1蛋白表达,重复3次。提取总蛋白,SDS-PAGE电泳,转PVDF膜,使用G:BOX chemiXR5成像,Gel-Pro32软件进行灰度分析。
1.3 统计学处理SPSS 17.0统计软件分析,计量资料采用x±s表示。不同受照剂量各指标的比较首先进行方差齐性检验,方差齐后采用单因素方差分析,有统计学意义后采用Bonfferoni法进行两两比较。相同受照剂量两种受照方式的指标比较采用两独立样本t检验,检验水准α=0.05,P<0.05认为是有统计学差异。
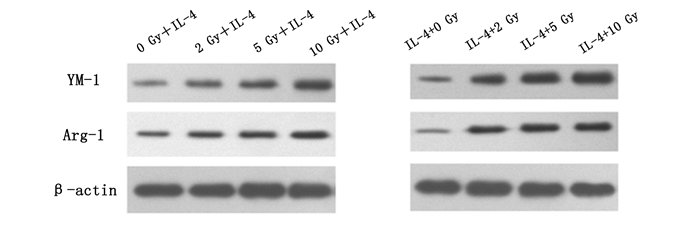
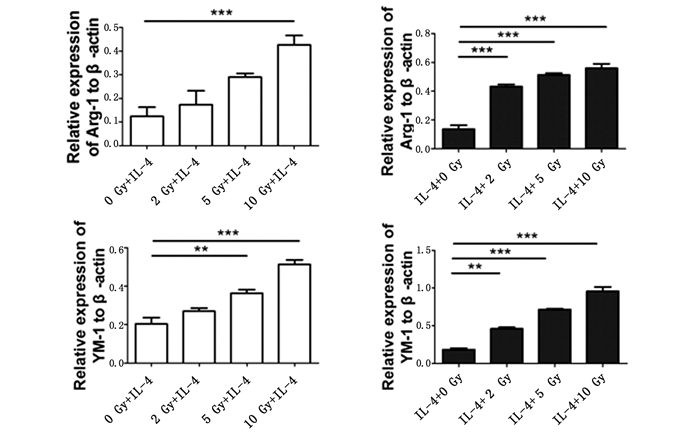
2 结果 2.1 辐射上调IL-4诱导的巨噬细胞YM-1和Arg-1表达如图 1和图 2所示,先照射后IL-4诱导细胞时(RT+IL-4),5 Gy和10 Gy照射剂量下YM-1表达高于未照射对照组(P<0.01;P<0.001),10 Gy照射剂量下Arg-1表达高于未照射对照组(P<0.001);IL-4诱导细胞后照射时(IL-4+RT),2 Gy、5 Gy和10 Gy照射剂量条件下YM-1和Arg-1均高于未照射对照组(P<0.01;P<0.001;P<0.001)。
|
图 1 免疫印迹分析照射对IL-4诱导的RAW264.7细胞YM-1和Arg-1的表达影响 |
|
图 2 照射对IL-4诱导的RAW264.7细胞YM-1和Arg-1的表达的柱状图分析 注:**表示P<0.01,***表示P<0.001。 |
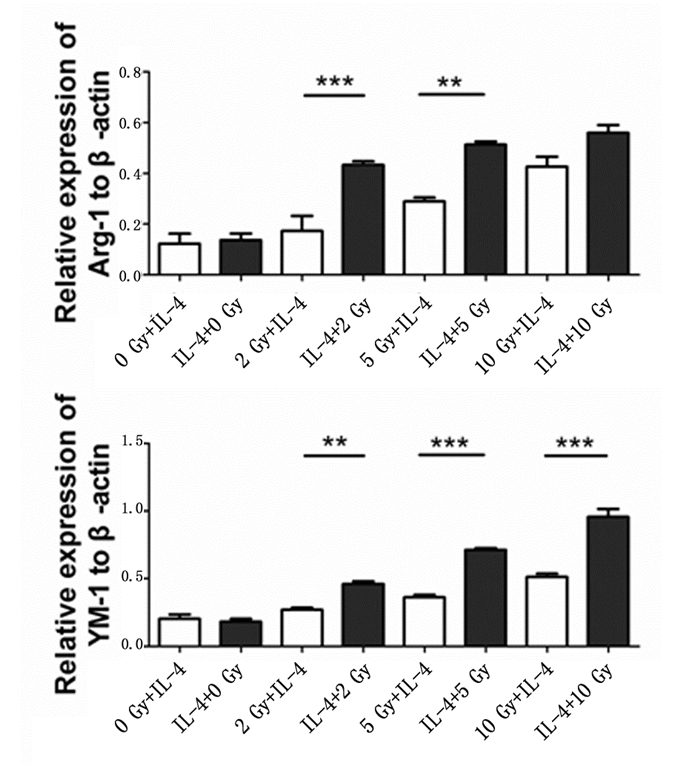
比较不同处理方式,相同照射剂量下对IL-4诱导的巨噬细胞Arg-1和YM-1表达的影响,如图 3所示,2Gy和5Gy照射剂量条件下,IL-4+RT组Arg-1表达高于RT+IL-4组(P<0.001;P<0.01);2 Gy、5 Gy和10 Gy照射剂量条件下,IL-4+RT组YM-1表达高于RT+IL-4组(P<0.01;P<0.001;P<0.001)。
|
图 3 不同照射方式对IL-4诱导的小鼠RAW264.7细胞YM-1和Arg-1表达的柱状图分析 注:**表示P<0.01,***表示P<0.001。 |
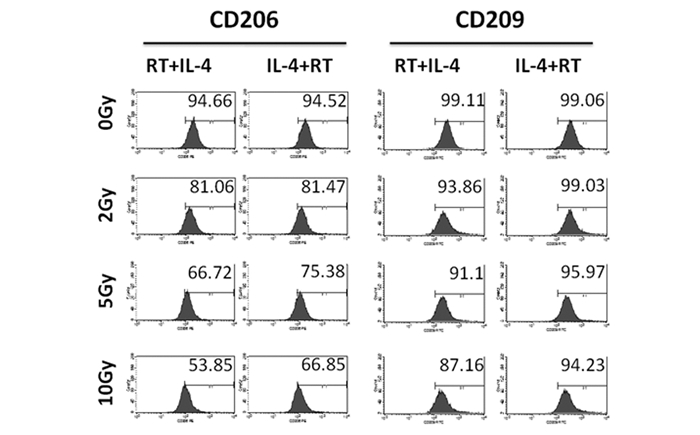
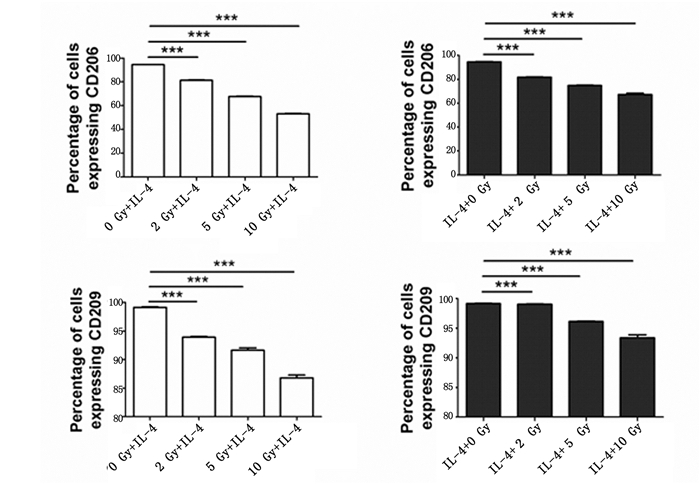
如表 1和图 4所示,两种处理方式下,不同照射剂量条件下,CD206和CD209的表达均显著下调(3次实验的x±s)。如图 5所示,先照射后加IL-4刺激组(RT+IL-4组),不同受照剂量下CD206(P < 0.001; P < 0.01; P < 0.001)和CD209(P < 0.001; P < 0.01; P < 0.001)表达显著下调,先加IL-4刺激后再进行照射组(IL-4+RT组),不同受照剂量下CD206(P < 0.001; P < 0.01; P < 0.001)和CD209(P < 0.001; P < 0.01; P < 0.001)表达均显著降低,并具有剂量依赖性。
|
|
表 1 不同受照剂量/方式对IL-4诱导的小鼠RAW264.7细胞CD206和CD209的表达(x±s) |
|
图 4 流式细胞术分析照射对IL-4诱导的小鼠RAW264.7细胞CD206和CD209的表达 注:三次实验结果取其中一次流式结果。 |
|
图 5 照射对IL-4诱导的小鼠RAW264.7细胞CD206和CD209表达的柱状图分析 注:**表示P<0.01,***表示P<0.001。 |
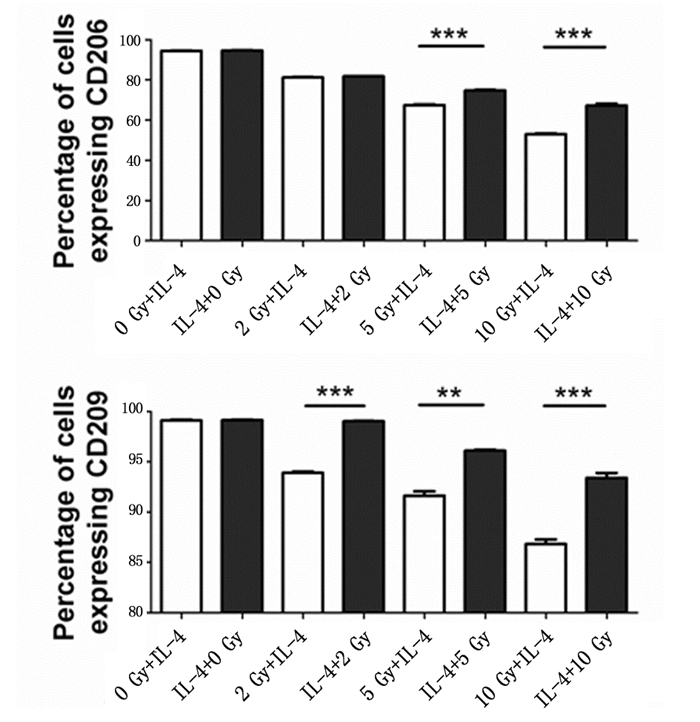
我们比较相同受照剂量下,不同的照射方式巨噬细胞CD206和CD209的表达,结果如图 6所示:5 Gy和10 Gy照射剂量下,IL-4+RT组CD206的表达高于RT+IL-4组(P < 0.001; P < 0.001);2 Gy、5 Gy和10 Gy照射条件下,IL-4+RT组CD209的表达高于RT+IL-4组(P < 0.001; P < 0.01; P < 0.001)。
|
图 6 不同照射方式对IL-4诱导的RAW264.7细胞CD206和CD209表达的柱状图分析 注:**表示P<0.01,***表示P<0.001。 |
TAMs并不是一成不变的,而是处于动态变化的一群细胞,M1/M2型巨噬细胞比例平衡与其所处的细胞因子环境、肿瘤内部乏氧程度、肿瘤的分型、分期及治疗等因素密切相关[6]。研究证实:细胞所在的微环境会影响M1/M2型巨噬细胞比例平衡,在LPS、TNF-α和IFN-γ等因子的作用下,巨噬细胞向M1型极化,在IL-4、IL-13、IL-10和TGF-β等因子作用下,巨噬细胞向M2型极化,Arg-1和YM-1是M2型巨噬细胞标志分子。M1型参与炎症的发生,M2型参与肿瘤的发生,有研究发现,随着肿瘤的发展,肿瘤组织中的TAMs最终表现为以M2型为主[7-8]。
本课题首次研究不同照射剂量以及不同放射方式对IL-4诱导巨噬细胞向M2型极化过程的影响,有研究指出IL-4刺激RAW264.7 12h后,Arg-I在mRNA水平显著升高[9],我们的研究发现射线作用于IL-4诱导的巨噬细胞后,Arg-1和YM-1表达均比未照射显著上升,提示电离辐射促进IL-4诱导的巨噬细胞向M2型极化。有研究指出:在体外实验中,未分化巨噬细胞受到中等剂量(1~10 Gy)的电离辐射照射后向M1型极化,能促使LPS/IFN-γ诱导的M1型极化的巨噬细胞M1型标志物增高,但是中等剂量的电离辐射并未显著改变M-CSF和IL-10诱导的M2型极化的巨噬细标志物表达水平[10]。我们的研究证实中等剂量(1~10 Gy)照射上调IL-4诱导的M2型巨噬细胞标志分子YM-1和Arg-1的表达。此外,我们的研究发现:照射前加IL-4诱导巨噬细胞比加IL-4诱导巨噬细胞后照射,YM-1和Arg-1的表达显著升高,提示我们肿瘤局部已经存在M2型巨噬细胞与照射治疗后肿瘤局部新生的M2巨噬细胞不同,前者YM-1和Arg-1的表达更强。
不同剂量和不同方式照射后,IL-4诱导的巨噬细胞CD206、CD209均下降,提示照射后细胞功能整体受抑制的状态,这与周传丰和金顺子等人的研究结果相似,周传丰等用大剂量γ射线照射DC细胞导致免疫抑制[11],金顺子等人的研究发现,J774A.1细胞在接受2、4、6 Gy照射后,CD80和CD86表达均受抑制[12],小鼠受到6.0 Gy照射时,腹腔巨噬细胞无从诱导免疫反应,CD80和CD86表达均未增高,提示巨噬细胞照射后功能受抑制[13]。此外,虽然不同的照射方式均下调CD206和CD209表达,但我们的研究发现:照射前加IL-4诱导巨噬细胞比加IL-4诱导巨噬细胞后照射,CD206和CD209的表达较高,提示我们肿瘤局部已经存在M2型巨噬细胞与照射治疗后肿瘤局部新生的M2巨噬细胞不同。综上所述,目前电离辐射对巨噬细胞极化影响及内在机制仍需进一步研究。
| [1] |
Hao NB, Lu MH, Fan YH, et al. Macrophages in tumor microenvironments and the progression of tumors[J]. Clin Dev Immunol, 2012, 948098. |
| [2] |
章必成, 王俊, 陈正堂. 肿瘤相关巨噬细胞的研究进展[J]. 临床肿瘤学杂志, 2007, 12(3): 228-231. DOI:10.3969/j.issn.1009-0460.2007.03.022 |
| [3] |
Sica A. Role of tumor-associated macrophage in cancer-related inflammation[J]. Exp Oncol, 2010, 32(3): 153-158. |
| [4] |
Nozawa H, Chiu C, Hanahan D. Infiltrating neutrophils mediate the initial angiogenic switch in a mouse model of multistage carcinogenesis[J]. Proc Natl Acad Sci U S A, 2006, 103(33): 12493-12498. DOI:10.1073/pnas.0601807103 |
| [5] |
Tsai CS, Chen FH, Wang CC, et al. Macrophages from irradiated tumors express higher levels of iNOS, arginase-I and COX-2, and promote tumor growth[J]. Int J Radiat Oncol Biol Phys, 2007, 68(2): 499-507. DOI:10.1016/j.ijrobp.2007.01.041 |
| [6] |
Russell Jeffery S, Martin Brown J. The irradiated tumor microenvironment:role of tumor-associated macrophages in vascular recovery[J]. fronitiers in PHYSIOLOGY, 2013, 157(4): 1-9. |
| [7] |
Dmitry I, Gabrilovich, Suzanne Ostrand-Rosenberg, et al. Coordinated regulation of myeloid cells by tumours[J]. Nat Rev Immunol, 2012, 12(4): 253-268. DOI:10.1038/nri3175 |
| [8] |
Ruffell B, Affara NI, Coussens LM. Differential macrophage programming in the tumor microenvironment[J]. Trends Immunol, 2012, 33(3): 119-126. DOI:10.1016/j.it.2011.12.001 |
| [9] |
陈涛, 梁潇, 贺明, 等. RAW264.7细胞M1/M2亚型的诱导和鉴定[J]. 中国分子心脏病学杂志, 2011, 11(2): 117-120. |
| [10] |
Geraldine Genard, Stephane Lucas, Carine Michiels. Reprogramming of tumur-associated macrophages with anticancer therapies:radiotheraphy versus chemo-and immunotherapies[J]. Cancer Immunity and Immunotheraphy, 2017, 8(14). |
| [11] |
周传丰, 杨彦勇, 刘聪, 等. 大剂量γ射线对树突状细胞表型及功能的影响[J]. 第二军医大学学报, 2011, 32(4): 364-367. |
| [12] |
金顺子, 何淑杰, 刘树铮. 不同剂量X射线照射对小鼠巨噬细胞表达CD80和CD86的影响[J]. 辐射研究与辐射工艺学报, 2001, 19(2): 153-157. DOI:10.3969/j.issn.1000-3436.2001.02.013 |
| [13] |
金顺子, 刘树铮. X射线对小鼠腹腔巨噬细胞表达B7-1和B7-2的影响[J]. 白求恩医科大学学报, 2001, 27(2): 111-113. DOI:10.3969/j.issn.1671-587X.2001.02.001 |




