肺癌是最常见的恶性肿瘤,其发病率和死亡率均居癌症之首[1-4]。因其早期无明显及特异性的症状和体征,首程诊治的早期患者仅占11.2%[1],除健康查体可以发现比较早期的肺癌患者之外,一旦有症状,一般为中晚期,因而常常失去根治的机会,预后相对较差,Jemal等报道肺癌5年生存率 < 15%[4]。本文分析自2009年1月1日至2009年12月31日在本院接受首次诊治的539例Ⅳ期肺癌患者,探讨其临床特点及生存相关因素。
1 资料与方法 1.1 对象 1.1.1 入组标准① 肺部原发病灶均经组织病理学和/或细胞学诊断明确;②临床检查全面,颅脑MRI或CT检查;胸部、腹部CT增强扫描;全身放射性核素骨显像,有异常放射性浓聚灶加行MRI、CT或X线片检查;或行全身PET-CT检查;明确肿瘤病变范围及临床分期;临床分期标准依据美国肿瘤研究联合委员会制定的第7版肿瘤分期指南临床分期[5];③在我院接受首程诊治,在外院未接受治疗;④排除复查病例。
1.1.2 一般临床资料自2009年1月1日-2009年12月31日共收治首程诊治资料完整的Ⅳ期肺癌患者共539例,排除无病理或细胞学诊断、资料不完整的患者。539例患者就诊时间:最短3天,最长24个月,平均时间2.36个月,中位时间2.0个月。539例患者的一般资料如表 1。
|
|
表 1 539例患者的临床资料 |
主要治疗方法有化学治疗(简称化疗)、放射治疗(简称放疗)、手术治疗、靶向治疗及联合治疗等;其中放化疗275例,占51.0%;其次是单纯化疗117例,占21.7%;未治疗者70例,占13.0%。539例Ⅳ期肺癌患者治疗方法如表 2。
|
|
表 2 539例Ⅳ期肺癌患者治疗方法 |
随访截止至2012年12月31日,539例Ⅳ期肺癌患者失访79例,随访率85.3%,随访时间1~38个月,平均随访时间16.1个月,中位随访时间16个月。生存患者继续随访中。
1.1.5 统计学方法采用SPSS 17.0软件进行统计分析,两样本均数的检验采用t检验,余用χ2检验;单因素和多因素生存分析采用Kaplan-Meier检验和Log rank检验,检验水准α=0.05。
2 结果 2.1 生存情况截至2012年12月31日,随访率为85.3%(460/539),539例Ⅳ期肺癌患者1年、2年、3年生存率分别为64.2%(346例)、19.7%(106例)、1.5%(8例)。
2.2 不同单器官转移生存比较393例Ⅳ期肺癌患者单器官转移中,胸膜、脑、骨、肺、肝、肾上腺转移分别为112例(28.5%)、100例(25.4%)、78例(19.8%)、60例(15.3%)、29例(7.4%)、14例(3.6%)。在单器官转移中,骨转移者生存时间相对较长,肝转移者生存时间较短。不同单器官转移生存时间比较如图 1。
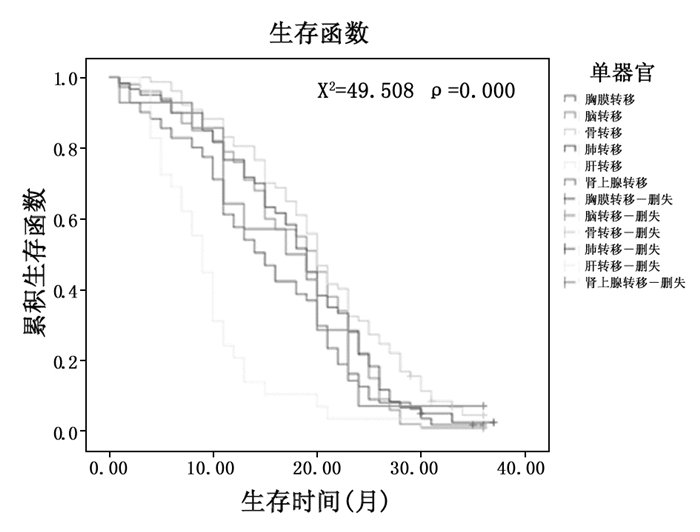
|
图 1 不同单器官转移生存时间比较 |
539例Ⅳ期肺癌患者中单器官、多器官转移分别为393例(72.9%)、146例(27.1%)。单器官转移、2个器官转移及3个以上器官转移,中位生存时间分别为18.0个月、15个月及8个月,生存时间有显著性差异。单器官转移与多器官生存比较如图 2。
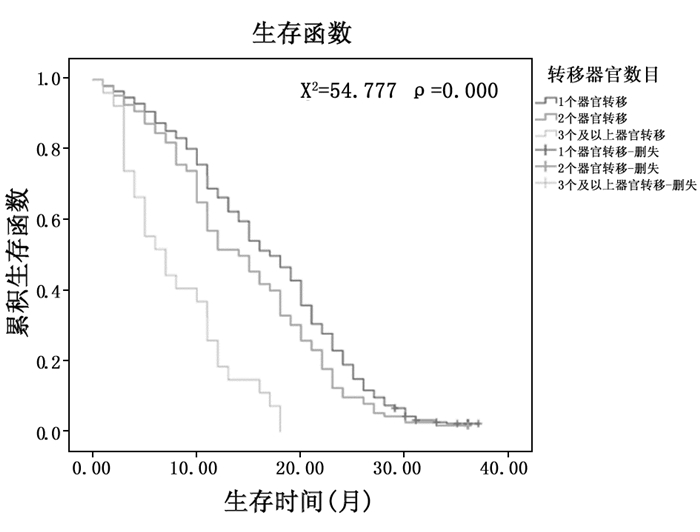
|
图 2 单器官转移与多器官生存比较 |
治疗方法明显影响患者的生存,单纯的化疗、放疗、手术、靶向治疗及其综合治疗的治疗方法不同,患者生存时间有显著性差异。放化疗联合靶向治疗效果较好,而不治疗、单纯化疗的患者预后较差。治疗方法对生存的影响如图 3。
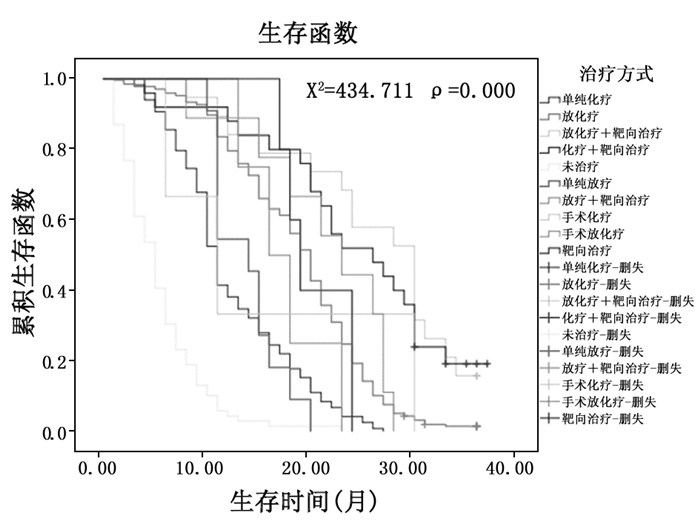
|
图 3 治疗方法与生存的关系 |
对于晚期肺癌患者,给以积极的放化疗、靶向治疗等生存时间明显延长,中位生存时间未治疗为5个月,综合治疗为18个月,两者比较有显著性差异。治疗与未治疗的生存时间比较如图 4。

|
图 4 治疗与未治疗生存比较 |
多因素Cox回归分析表明,年龄、不同转移器官、转移器官数目、治疗方式与生存时间相关。与生存相关的多因素相关性分析如表 3。
|
|
表 3 与生存相关的多因素Cox回归分析表 |
肺癌的发病率在发达国家呈下降的趋势,但在发展中国家呈逐年上升的趋势;肺癌不再单单是老年病,而是呈年轻化的趋势;本研究中,539例Ⅳ期肺癌患者中,年龄范围为19~88岁,中位年龄59岁,小于60岁患者为282例,占52.3%,大于等于60岁的患者为257例,占47.7%,年轻患者多于老年患者,因此,肺癌的年轻化可能是肺癌的另一特点。肺癌的发生,不仅与吸烟、环境污染等有关,还与压力过大、不良的生活习惯及缺乏锻炼有关[6-8]。建议放慢生活节奏,学会自我减压,养成良好的生活习惯,每天或每周抽出相应的时间锻炼身体, 运动可以降低肺癌的发病风险[10]。年龄在40岁以上者,每年至少健康查体一次,有高危因素者,行低剂量率CT检查[11-13],做到早发现、早诊断和早治疗, 以提高肺癌的生存率,降低死亡率。
早期肺癌无明显症状,晚期患者很少无症状,本研究539例Ⅳ期肺癌患者中,无症状者13例,占2.4%;绝大多数有肺内和/或肺外症状,主要症状为肺内症状:咳嗽、咳痰、胸痛、胸闷、憋喘共311例(57.7%);痰中带血19例(3.5%);肺外症状主要为头痛、骨痛等共139例(25.8%)。539例患者中,就诊时间最短3天,最长24个月,平均时间2.36个月,中位时间2.0个月;患者就诊时间较晚,可能是预后不良的另一原因[1]。
晚期肺癌患者预后较差,Ⅳ期肺癌患者5年生存率约1%。本研究发现Ⅳ期肺癌患者1年、2年、3年生存率分别为64.2%(346例)、19.7%(106例)、1.5%(8例);至少一半以上的患者生存超过1年, 但总的预后较差,3年生存率较低1.5%。对于肺癌患者同时性转移预后明显低于异时性转移。
肺癌的转移部位,最常见的是胸膜,其次是脑,本研究在393例Ⅳ期肺癌患者单器官转移中,胸膜、脑、骨、肺、肝、肾上腺转移分别为112例(28.5%)、100例(25.4%)、78例(19.8%)、60例(15.3%)、29例(7.4%)、14例(3.6%)。在单器官转移中,骨转移生存时间相对较长,其次是脑,肝转移生存时间较短。其原因是骨、脑转移治疗较及时,骨与脑转移不治疗者预后较差,积极治疗可改善预后,延长生存时间[14-16]。
放疗是其主要治疗方法,化疗对骨、脑转移疗效相对较差。大部分骨转移患者都伴有疼痛,患者难以忍受,因此就诊率及治疗率相对较高,且骨转移放疗效果较好;脑转移患者多伴有神经系统症状,因此就诊较及时,放疗对单发和多发脑转移均有确切疗效,与文献报道一致[17-18];肝转移和胸膜转移预后较差,肝转移往往是多发转移,无论化疗、介入治疗,疗效均较差,与文献报道一致[19-20];对于单发肝转移可考虑放疗,但多发肝转移往往无法采取放疗。胸膜转移患者多数伴有恶性胸腔积液,部分患者控制较好,但广泛胸膜转移伴大量胸腔积液患者,胸水控制较差的患者,患者很快消耗,导致恶液质,难以进行其他的治疗,因此预后较差。无胸腔积液的胸膜转移患者,预后相对较好。文献报道,肺癌胸膜累及可以手术,手术可以提高生存率,延长生存时间[21]。因此转移器官不同,是影响生存的因素之一。
肺癌转移器官数目不同,生存时间有差异。单器官转移与多器官转移生存比较:在539例Ⅳ期肺癌患者中,单器官、多器官转移分别为393例(72.9%)、146例(27.1%)。单器官转移、2个器官转移及3个以上器官转移患者,中位生存时间分别为18.0个月、15个月及8个月,生存时间有显著性差异。转移器官数目也是影响生存的因素之一。
Ⅳ期肺癌患者的治疗原则是综合治疗,主要治疗方法包括化疗、放疗、靶向治疗及手术等,任何单一的治疗方法疗效均不理想。但因为传统观念的影响,部分首诊为Ⅳ期肺癌的患者放弃治疗,本研究539例患者中未治疗者70例,占13.0%;超过1/10的患者选择放弃治疗。未治疗患者中位生存时间为5.0个月,而治疗者中位生存时间为18.0个月,两者比较有显著性差异;文献报道,未接受化疗的患者中位生存期为3.3个月,只接受一线化疗的患者中位生存期为8.2个月,而接受一线化疗和二线化疗的患者中位生存期则达到16.2个月[22]。因此即便是晚期的肺癌患者,经过积极的治疗,仍然能够延长生存时间。在治疗选择上,治疗方法的不同也影响患者的生存,单纯的化疗、放疗、手术、靶向治疗及其综合治疗的治疗方法不同,患者生存时间有显著性差异。马筑等研究报道,Ⅳ期非小细胞肺癌,转移器官数目≤3个,化疗同期3DRT的中位生存期达13.0个月,原发肿瘤体积和放疗剂量是影响OS的因素[23];国外研究报道Ⅳ期非小细胞肺癌的预后与治疗前KPS相关[24-25]。放化疗联合靶向治疗效果较好,而单纯化疗的患者预后较差,靶向治疗可以提高患者的生存期[26-27]。同步放化疗在晚期肺癌中占有重要地位,文献报道根治性放疗联合化疗明显提高晚期肺癌患者的生存率及生存期[28-29]。因此,治疗方式是影响生存的因素之一。
本研究多因素Cox回归分析表明,Ⅳ期肺癌患者的生存与患者的年龄、不同的转移器官、转移器官的数目及治疗方式相关;其中年龄、治疗方式与生存呈正相关。
总之,Ⅳ期肺癌患者临床症状多样,无特异性,就诊时间较晚,预后较差;但治疗与未治疗有显著性差异,因此建议晚期患者仍应积极治疗,以提高生存时间;另外,患者的年龄、远处转移器官、转移器官数目及治疗方式是影响患者生存的主要因素。
| [1] |
Shao Q, Li J, Li F, et al. Clinical investigation into the initial diagnosis and treatment of 1, 168 lung cancer patients[J]. Oncol Lett, 2015, 9: 563-568. DOI:10.3892/ol.2014.2777 |
| [2] |
Scheff RJ, Schneider BJ. Non-small-cell lung cancer:treatment of late stage disease:chemotherapeutics and new frontiers[J]. Semin Intervent Radiol, 2013, 30: 191-198. DOI:10.1055/s-00000068 |
| [3] |
Humphrey LL, Deffebach M, Pappas M, et al. Screening for lung cancer with low-dose computed tomography:a systematic review to update the US Preventive services task force recommendation[J]. Ann Intern Med, 2013, 159: 411-420. DOI:10.7326/0003-4819-159-6-201309170-00690 |
| [4] |
Jemal A, Siegel R, Xu J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60: 277-300. DOI:10.3322/caac.20073 |
| [5] |
Goldstraw P, Crowley J, Chansky K, et al. The IASLC Lung Cancer Staging Project:proposals for the revision of the TNM stage groupings in the forthcoming (seventh) edition of the TNM Classification of malignant tumours[J]. J Thorac Oncol, 2007, 2(8): 706-714. DOI:10.1097/JTO.0b013e31812f3c1a |
| [6] |
Maher Karam-Hage, Paul M, Cinciripini, Ellen R. Gritz. Tobacco Use and Cessation for Cancer Survivors:An Overview for Clinicians[J]. CA Cancer J Clin, 2014, 64(4): 272-290. DOI:10.3322/caac.v64.4 |
| [7] |
Jong-Myon Bae, Moo-Song Lee, Myung-Hee Shin, et al. Cigarette Smoking and Risk of Lung Cancer in Korean Men:The Seoul Male Cancer Cohort Study[J]. J Korean Med Sci, 2007, 22(3): 508-512. DOI:10.3346/jkms.2007.22.3.508 |
| [8] |
Isaac K, Sundar, Michael Z, Nevid, Alan E. Friedman, et al. Cigarette smoke induces distinct chromatin histone modifications in lung cells:implication in pathogenesis of COPD and lung cancer[J]. J Proteome Res, 2014, 13(2): 982-996. DOI:10.1021/pr400998n |
| [9] |
Thomas W, Hesterberg, Christopher M, Long, William B. Bunn, et al. Health effects research and regulation of diesel exhaust:an historical overview focused on lung cancer risk[J]. Inhal Toxicol, 2012, 24(s1): 1-45. |
| [10] |
Brian L, Sprague, Trentham-Dietz Amy, Barbara E.K., Klein, et al. Physical activity, white blood cell count, and lung cancer risk in a prospective cohort study[J]. Cancer Epidemiol Biomarkers Prev, 2008, 17(10): 2714-2722. DOI:10.1158/1055-9965.EPI-08-0042 |
| [11] |
Eberth JM. Lung Cancer Screening With Low-Dose CT in the United States[J]. J Am Coll Radiol, 2015, 12(12): 1395-1402. DOI:10.1016/j.jacr.2015.09.016 |
| [12] |
Sharma D, Newman TG, Aronow WS. Lung cancer screening:history, current perspectives, and future directions[J]. Arch Med Sci, 2015, 11(5): 1033-1043. |
| [13] |
Deffebach ME, Humphrey L. Lung Cancer Screening[J]. Surg Clin North Am, 2015, 95(5): 967-978. DOI:10.1016/j.suc.2015.05.006 |
| [14] |
Maria Caffo, Valeria Barresi, Gerardo Caruso, et al. Innovative Therapeutic Strategies in the Treatment of Brain Metastases[J]. Int J Mol Sci, 2013, 14(1): 2135-2174. DOI:10.3390/ijms14012135 |
| [15] |
Antoni D, No? l G, Mornex F. The role of whole brain radiation therapy for brain metastases[J]. Bull Cancer. 2013, 100: 15-22.
|
| [16] |
Hideshi Sugiura, Kenji Yamada, et al. Predictors of Survival in Patients With Bone Metastasis of Lung Cancer[J]. Clin Orthop Relat Res, 2008, 466(3): 729-736. DOI:10.1007/s11999-007-0051-0 |
| [17] |
Tsao MN, Rades D, Wirth A, et al. Radiotherapeutic and surgical management for newly diagnosed brain metastasis(es):An American Society for Radiation Oncology evidence-based guideline[J]. Practical Radiation Oncology, 2012, 2(3): 210-225. DOI:10.1016/j.prro.2011.12.004 |
| [18] |
Tamari K, Suzuki O, Hashimoto N, et al. Treatment outcomes using CyberKnife for brain metastases from lung cancer[J]. Journal of Radiation Research, 2015, 56(1): 151-158. DOI:10.1093/jrr/rru092 |
| [19] |
Castañón E, Rolfo C, Viñal D, López I, Fusco JP, Santisteban M, Martin P, Zubiri L, Echeveste JI, Gil-Bazo I. Impact of epidermal growth factor receptor (EGFR) activating mutations and their targeted treatment in the prognosis of stage Ⅳ non-small cell lung cancer (NSCLC) patients harboring liver metastasis[J]. J Transl Med, 2015, 7;13: 257. |
| [20] |
Wu KL, Tsai MJ, Yang CJ, et al. Liver metastasis predicts poorer prognosis in stage Ⅳ lung adenocarcinoma patients receiving first-line gefitinib[J]. Lung Cancer, 2015, 88(2): 187-194. |
| [21] |
Iida T, Shiba M, Yoshino I, et al. Surgical Intervention for Non-Small-Cell Lung Cancer Patients with Pleural Carcinomatosis:Results From the Japanese Lung Cancer Registry in 2004; Japanese Joint Committee of Lung Cancer Registry[J]. J Thorac Oncol, 2015, 10(7): 1076-1082. DOI:10.1097/JTO.0000000000000554 |
| [22] |
Barton MK. Patients of all ages with advanced non-small cell lung cancer are not receiving chemotherapy[J]. CA:A Cancer Journal for Clinicians, 2015, 65(5): 337-338. DOI:10.3322/caac.v65.5 |
| [23] |
马筑, 卢冰, 李涛, 等. Ⅳ期NSCLC化疗同期3DRT的前瞻性多中心Ⅱ期临床研究-PPRA-RTOG003[J]. 中华放射肿瘤学杂志, 2015, 24(4): 359-364. |
| [24] |
Lopez-Guerra JL, Gomez D, Zhuang Y, et al. Prognostic impact of radiation therapy to the primary tumor in patients with non-small cell lung cancer and oligometastasis at diagnosis[J]. Int J Radiat Oncol Biol Phys, 2012, 84(1): 61-67. DOI:10.1016/j.ijrobp.2012.02.054 |
| [25] |
Parikh RB, Cronin AM, Kozono DE, et al. Definitive primary therapy in patients presenting with oligometastatic non-small cell lung cancer[J]. Int J Radiat Oncol Biol Phys, 2014, 89(4): 880-887. DOI:10.1016/j.ijrobp.2014.04.007 |
| [26] |
Li XN, Qiu D, Pan X, Hou XX. Mutation of the epidermal growth factor receptor gene and its impact on the efficacy of gefitinib in advanced non-small cell lung cance[J]. Int J Clin Exp Med, 2015, 15;8(4): 5397-5405. |
| [27] |
李开春, 陈佳艳. 老年晚期肺癌患者药物治疗的选择[J]. 中华肿瘤杂志, 2015, 37(10): 721-724. DOI:10.3760/cma.j.issn.0253-3766.2015.10.001 |
| [28] |
McCloskey P1, Balduyck B, Van Schil PE, Faivre-Finn C, O'Brien M. Radical treatment of non-small cell lung cancer during the last 5 years[J]. Eur J Cancer, 2013, 49(7): 1555-64. DOI:10.1016/j.ejca.2012.12.023 |
| [29] |
吕家华, 李涛, 刘丽, 等. Ⅳ期寡转移NSCLC化疗同期放化疗后巩固化疗前瞻性Ⅱ期临床研究[J]. 中华放射肿瘤学杂志, 2015, 24(6): 611-614. DOI:10.3760/cma.j.issn.1004-4221.2015.06.002 |




