肺癌是全世界发病率和死亡率最高的恶性肿瘤之一,严重威胁人类身体健康和生命安全[1-2]。放疗作为一种重要的治疗手段,对大部分肿瘤,包括肺癌,可以起到较好的治疗效果。然而,随着放疗在临床的广泛使用,研究发现放疗虽然可以杀死肿瘤细胞,但即使使用根治剂量的射线进行放射治疗,仍有60%的患者体内有残存肿瘤细胞,并进一步导致放疗结束后肿瘤细胞的局部复发和/或远处迁移[3-4]。据报道,放疗后肺癌患者5年存活率低于15%[5],而肿瘤的复发和迁移是放疗失败的主要原因。
近年来一系列研究报道表明,辐射可引起受照细胞内微小RNA(microRNA, miRNA)表达谱的变化[7-8]。辐射诱导的miRNA可通过所作用的靶基因调节肿瘤转移相关基因的表达或参与肿瘤侵袭和迁移相关信号通路而影响放射肿瘤的侵袭和迁移[9-10],但这方面的实验研究还较少。
课题组前期以肺腺癌A549细胞为模型,利用4 Gy X射线照射A549细胞,采用miRNA流体芯片筛选X射线诱导的miRNA变化,获得了A549细胞放射前后的miRNA的表达变化谱。本研究在此基础上,进一步对前期芯片筛选出来的辐射前后变化差异较大的miR-424-5p进行了RT-PCR验证,并对其在辐射诱导A549细胞侵袭和迁移中的作用进行了研究,该研究可为未来进一步研究其分子作用机制奠定基础。
1 材料和方法 1.1 细胞A549细胞购自协和医学院细胞库;HEK293T由军事医学科学院曹诚教授惠赠。
1.2 主要试剂胰蛋白酶(Sigma公司,美国);DMEM培养基(Gbico公司,美国);胎牛血清(Hyclone公司,美国);Matrigel胶(BD公司,美国);INTERFERin(polyplus公司,法国);RNA提取试剂盒(Qiagen,德国);miR-424-5p提取、反转录、PCR试剂盒(Invitrogen公司,美国);miR-424-5p模拟物(mimic)/抑制物(inhibitor)/阴性对照(negative control, NC)(Invitrogen公司,美国);氨苄青霉素(Ameresco公司,美国);Transwell小室(Millipore公司,美国);24孔遮光白板(corning公司,美国)。
1.2 主要仪器细胞培养箱(SANYO公司,日本);高速冷冻离心机(天美公司,中国);普通离心机(北京白洋医用离心机有限公司,中国);荧光倒置显微镜(Olympus公司,日本);荧光定量PCR仪(杭州博日科技公司,中国);超微量分光光度计(Thermofisher公司,美国);Precise直线加速器(Elekta公司,瑞典)。
1.3 实验方法 1.3.1 细胞培养及转染细胞培养于含10%小牛血清DMEM培养基中,培养条件为37℃、5% CO2、100%相对饱和湿度,常规培养、传代。收集对数生长期的细胞接种于6孔板。将100 nM终浓度的miRNA mimics/inhibitors/control序列加入到100 μl opti-MEM培养基中,震荡混匀后加入8 μl INTERFERin转染试剂,室温静置10 min后加入到待转染细胞培养基中,摇匀。6 h后更换为10%FBS的DMEM培养基继续培养。
1.3.2 X射线照射以Precise直线加速器产生的X射线单次照射A549细胞,源皮距为100 cm,照射野10cm ×l0cm,能量为6 MV,剂量率为222.45cGy/min,细胞吸收剂量为0 Gy(阴性对照)或4 Gy。
1.3.3 RNA提取、反转录和Real time PCR方法收集的细胞用Trizol试剂裂解细胞,RNA提取试剂盒提取总RNA及miRNA,严格按照试剂盒说明书进行具体操作。紫外分光光度仪进行定量。采用Real time PCR法分析miRNA-424-5p的表达,首先用TaqMan microRNA特异性引物和TaqManmiRNA反转录试剂盒进行反转录产生cDNA,然后各组取2 μl反转录产物进行Real time PCR,用U6做内参。具体操作参照说明书。各组之间miRNA表达变化用2-△△Ct方法表示,实验独立重复3次,每个样品取3个复孔。
1.3.4 细胞侵袭和迁移实验调整无血清DMEM培养液悬浮的细胞密度为1×105/ml,取100 μl接种于Transwell小室上室,向Transwell小室下室加入600 μl含20%血清培养基。20 h后,用棉签小心移去上室里(上表面)残留的细胞。对迁移到并附着在上室下表面的细胞用500 μl甲醇固定15 min,500 μl0.1%结晶紫染色30 min。PBS及自来水冲洗,在显微镜下计数,实验独立重复3次。细胞侵袭实验的Matrigel由相应无血清培养基稀释5倍,然后取80 μl加入到Transwell小室上室进行包被,37 ℃放置5 h使用,其余步骤同上述迁移实验。
1.3.5 统计方法应用SPSS 19.0 for windows统计软件进行数据处理。各实验至少独立重复3次,计量资料以x±s表示,组间两两比较采用t检验。P < 0.05,差异具有统计学意义。
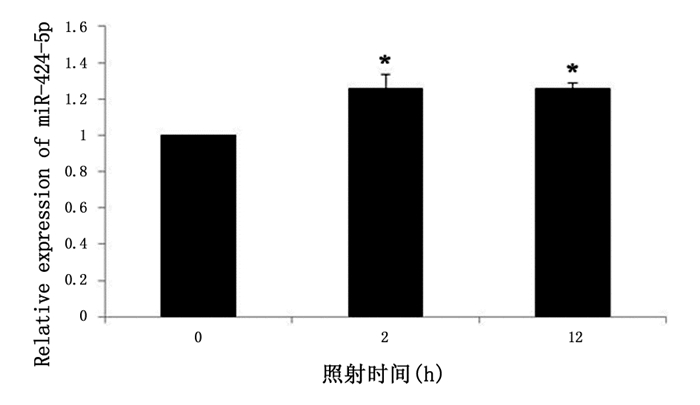
2 结果 2.1 电离辐射对A549细胞miR-424-5p表达的影响为了进一步验证前期miRNA芯片筛选出来的miR-424-5p是否存在假阳性,我们利用茎环RT-PCR分别检测了4 Gy X射线照射前后A549细胞中miR-424-5p的表达变化。结果如图 1所示,4 Gy X射线照射后2 h,A549细胞中miR-424-5p的表达是未照射组的1.257倍,12 h是1.278倍,差异具有统计学意义,结果提示4 Gy X射线诱导了A549细胞中miR-424-5p的生成。
|
图 1 4 Gy X射线照射后A549细胞中miR-424-5p的相对表达情况 注:*:P < 0.05,与照射后0 h比较。 |
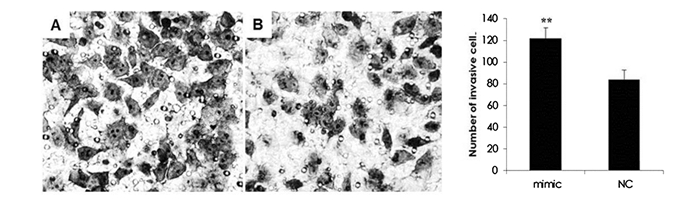
体外细胞侵袭-Transwell法模拟体内侵袭过程,测定肿瘤细胞侵袭人工基底膜的能力,可以间接反映肿瘤细胞体内侵袭能力。有研究报道,miR-424-5p卷入了肿瘤细胞的侵袭和迁移[11-12],因此,为研究miR-424-5p在A549细胞侵袭中的作用,我们在A549细胞中过表达miR-424-5p,24 h后进行Transwell侵袭实验检测细胞的侵袭能力。结果如图 2所示,过表达miR-424-5p后侵袭的A549细胞数(122±9.6)明显多于NC组(84±8.7),提示miR-424-5p能明显促进A549细胞的侵袭。
|
图 2 过表达miR-424-5p促进了A549细胞的侵袭 注:A:过表达miR-424-5p mimic; B: miR-424 mimic NC; **:P < 0.01,与NC组比较。 |
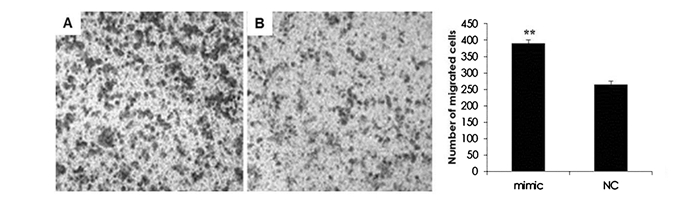
我们利用Transwell迁移实验检测了miR-424-5p对A549细胞迁移的影响。在A549细胞中过表达miR-424-5p,检测细胞穿过Transwell小室能力。结果如图 3所示,过表达miR-424-5p后迁移的A549细胞数(390 ± 10.1)明显多于NC组(265 ± 9.6),提示miR-424-5p能明显促进A549细胞的迁移。
|
图 3 过表达miR-424-5p促进了A549细胞的迁移 注:A:过表达miR-424-5p mimic; B: miR-424 mimic NC; **:P < 0.01,与NC组比较。 |
课题组前期研究证明,X射线能诱导A549细胞的侵袭,本研究证明X射线能诱导miR-424-5p的产生,并且miR-424-5p能促进A549细胞的侵袭,因此,我们推测miR-424-5p可能在X射线诱导的A549细胞侵袭中发挥了一定的作用。为了验证这个假设,我们通过在A549细胞中外源性导入miR-424-5p inhibitor阻断照射诱导的miR-424-5p表达升高,观察照射诱导的A549细胞侵袭是否也能被抑制。为此,我们把4 Gy X射线照射的A549细胞分成两组,一组导入miR-424-5p inhibitor,一组导入NC,Transwell实验检测A549的侵袭能力。实验结果显示(见图 4),外源导入miR-424-5p inhibitor后进行4 Gy X射线照射组侵袭的A549细胞数(61±5.1)明显少于单纯照射组(94±8.8),提示miR-424-5p inhibitor能明显降低4Gy X射线诱导的A549细胞侵袭,提示miR-424-5p在4Gy X射线诱导的A549细胞迁移中发挥了一定功能。

|
图 4 miR-424-5p inhibitor抑制了4 Gy X射线照射后A549细胞侵袭 注:A: miR-424-5p mimic+4Gy X-rays; B: miR-424 mimic NC+4Gy X-rays; **:P < 0.01,与NC +4Gy X-rays组比较。 |
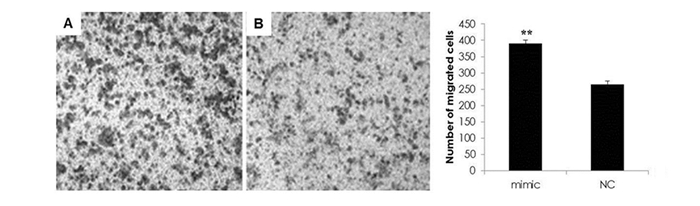
接下来本研究进一步验证了miR-424-5p对受照A549细胞迁移的影响。通过在A549细胞中外源性导入miR-424-5p inhibitor阻断照射诱导的miR-424-5p表达升高,观察照射诱导的A549细胞迁移情况。结果显示(见图 5),外源导入miR-424-5p inhibitor后进行4 Gy X射线照射组迁移的A549细胞数(191±11.6)明显少于单纯照射组(294±15.1),如我们预测一样,miR-424-5p inhibitor明显降低了4Gy X射线诱导的A549细胞迁移。
|
图 5 miR-424-5p inhibitor抑制了4Gy X射线照射后A549细胞迁移 注:A:miR-424-5p mimic+4Gy X-rays; B: miR-424 mimic NC+4Gy X-rays; **:P < 0.01,与NC +4Gy X-rays组比较。 |
本研究在前期芯片筛选的基础上,对芯片阳性结果的miR-424-5p进行茎环荧光实时定量PCR测定,探针法检测miR-424-5p的表达。检测结果发现,4Gy X射线辐照A549细胞后,2h出现miR-424-5p表达升高,12 h达到顶峰,提示X射线诱导了miR-424-5p的产生。事实上,已有研究报道,一定剂量的射线照射能诱导miR-424-5p其他家族成员的表达[13]。但细胞受照后miR-424-5p的变化仍未见报道,本研究第一次报道电离辐射A549细胞中miR-424-5p的表达变化。
研究显示,miR-424-5p是一种与细胞侵袭和转移相关的miRNA,在多种肿瘤中异常表达,并与多种肿瘤的发生发展密切相关[14-15]。既然X射线能诱导A549细胞中miR-424-5p的表达,并且miR-424-5p参与了多种肿瘤的侵袭和迁移,那么,miR-424-5p有可能参与X射线诱导的A549细胞侵袭和迁移过程。本研究又通过Transwell侵袭与迁移实验证明了miR-424-5p能促进4Gy X射线诱导的A549细胞侵袭和迁移。这与Kwak的研究结果相一致。Kwak等[16-17]采用5Gy γ射线照射胶质瘤U-251和LN428细胞,24h后诱导了miR-494/miR-30e的表达,并通过Transwell和划痕实验发现后者参与了放射诱导的胶质瘤细胞侵袭和迁移。由此,我们认为,miR-424-5p能促进4 Gy X射线诱导的A549细胞侵袭和迁移。然而,其具体的作用分子机制如何?其直接作用的靶基因有哪些?其通过哪一个靶基因相关的信号通路影响放射诱导的肺腺癌A549细胞的侵袭和迁移?这些问题有待进一步研究。
| [1] |
Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA:a cancer journal for clinicians, 2013, 63(1): 11-30. DOI:10.3322/caac.v63.1 |
| [2] |
Walker J, Hansen C H, Martin P, et al. Prevalence, associations, and adequacy of treatment of major depression in patients with cancer:a cross-sectional analysis of routinely collected clinical data[J]. The lancet Psychiatry, 2014, 1(5): 343-350. DOI:10.1016/S2215-0366(14)70313-X |
| [3] |
Kaplan H s, Murphy E d. The effect of local roentgen irradiation on the biological behavior of a transplantable mouse carcinoma; increased frequency of pulmonary metastasis[J]. Journal of the National Cancer Institute, 1949, 9(5-6): 407-413. |
| [4] |
Li T, Zeng Z c, Wang L, et al. Radiation enhances long-term metastasis potential of residual hepatocellular carcinoma in nude mice through TMPRSS4-induced epithelial-mesenchymal transition[J]. Cancer gene therapy, 2011, 18(9): 617-626. DOI:10.1038/cgt.2011.29 |
| [5] |
Deng P, Hu C, Zhou L, et al. Clinical characteristics and prognostic significance of 92 cases of patients with primary mixed-histology lung cancer[J]. Molecular and clinical oncology, 2013, 1(5): 863-868. DOI:10.3892/mco.2013.137 |
| [6] |
Mao A, Liu Y, Wang Y, et al. miR-449a enhances radiosensitivity through modulating pRb/E2F1 in prostate cancer cells[J]. Tumour Biol, 2015, 37(4): 4831-4840. |
| [7] |
He J, Hua J, Ding N, et al. Modulation of microRNAs by ionizing radiation in human gastric cancer[J]. Oncology reports, 2014, 32(2): 787-793. DOI:10.3892/or.2014.3246 |
| [8] |
Bae S, Kim K, Cha H J, et al. Altered microRNA expression profiles are involved in resistance to low-dose ionizing radiation in the absence of BMI1 in human dermal fibroblasts[J]. International journal of oncology, 2014, 45(4): 1618-1628. |
| [9] |
Kwak S Y, Kim B Y, Aha H J, et al. Ionizing radiation-inducible miR-30e promotes glioma cell invasion through EGFR stabilization by directly targeting CBL-B[J]. The FEBS journal, 2015, 282(8): 1512-1525. |
| [10] |
Kwak S Y, Yang J S, Kim B Y, et al. Ionizing radiation-inducible miR-494 promotes glioma cell invasion through EGFR stabilization by targeting p190B rhoGAP[J]. Biochimica et biophysica acta, 2014, 1843(3): 508-516. |
| [11] |
Li Q, Qiu X M, Li Q H, et al. MicroRNA-424 may function as a tumor suppressor in endometrial carcinoma cells by targeting E2F7[J]. Oncology reports, 2015, 33(5): 2354-2360. DOI:10.3892/or.2015.3812 |
| [12] |
Wu K, Hu G, He X, et al. MicroRNA-424-5p suppresses the expression of SOCS6 in pancreatic cancer[J]. Pathology oncology research:POR, 2013, 19(4): 739-748. DOI:10.1007/s12253-013-9637-x |
| [13] |
Mei Z, Su T, Ye J, et al. The miR-15 family enhances the radiosensitivity of breast cancer cells by targeting G2 checkpoints[J]. Radiation research, 2015, 183(2): 196-207. DOI:10.1667/RR13784.1 |
| [14] |
Yu L, Ding G F, He C, et al. MicroRNA-424 is down-regulated in hepatocellular carcinoma and suppresses cell migration and invasion through c-Myb[J]. PloS one, 2014, 9(3): e91661. DOI:10.1371/journal.pone.0091661 |
| [15] |
Ruiz-Llorente L, Ardila-Gonzalez S, Fanjul L F, et al. microRNAs 424 and 503 are mediators of the anti-proliferative and anti-invasive action of the thyroid hormone receptor beta[J]. Oncotarget, 2014, 5(10): 2918-2933. |
| [16] |
Kwak S Y, Yang J S, Kim B Y, et al. Ionizing radiation-inducible miR-494 promotes glioma cell invasion through EGFR stabilization by targeting p190B RhoGAP[J]. Biochimica et biophysica acta, 2014, 1843(3): 508-516. DOI:10.1016/j.bbamcr.2013.11.021 |
| [17] |
Kwak S Y, Kim B Y, Ahn H J, et al. Ionizing radiation-inducible miR-30e promotes glioma cell invasion through EGFR stabilization by directly targeting CBL-B[J]. Febs Journal, 2015, 282(8): 1512-1525. DOI:10.1111/febs.13238 |


