百草枯(Paraquat, PQ)是目前农业应用广泛的除草剂, 自然降解迅速, 属低毒类农药, 但其对人体或动物的肺部等器官有极强毒性的毒性。农药使用及储存过程中常发生误服、自杀的案例, 是农药中毒常见的一种。百草枯可经口、皮肤、黏膜、呼吸道吸收进入人体导致多脏器功能受损, 肺为PQ中毒的主要靶器官其对肺组织有较强的亲和力, 百草枯进入人体后, 肺组织中的浓度是其他组织的许多患者早期死于急性肺损伤所致的急性呼吸窘迫综合征(ARDS), 晚期多死10~90倍, 因此极易引起急性肺损伤。于肺间质纤维化所致的呼吸衰竭。中、重度中毒如能度过急性期, 之后则出现不可逆的进行性加重的肺纤维化, 后期多死于肺功能衰竭。目前, 尚无治疗百草枯中毒致肺间质纤维化的特效药物, 传统的糖皮质激素和细胞毒药物疗效不能令人满意。因此, 肺纤维化已成为临床治疗的难点。引起肺间质纤维化, 预后极差, 影响患者的生活质量。目前肺间质纤维化主要是使用糖皮质激素类药物和细胞毒性药物, 但效果并不理想。有研究[1]发现, 阿托伐他汀不仅具有降脂的作用, 同时还可以抗炎、抗氧化、抗血小板凝集以及改善内皮功能。肺纤维化的发病是一种由细胞外基质过度沉积导致的, MMP是分解细胞外基质的主要酶类[2], 因此使用阿托伐他汀调控MMP-9/TIMP-1系统可能有效阻止肺纤维化进展。
本文通过观察阿托伐他汀干预由PQ诱导的肺纤维化模型大鼠对MMP-9和TIMP-1的表达的影响, 进一步探讨阿托伐他汀对MMPs/TIMPS的调控的作用, 为临床应用阿托伐他汀治疗百草枯中毒提供理论依据。
1 材料与方法 1.1 材料 1.1.1 阿托伐他汀分子量1209.42, 10 mg/片, 批号J20090228, 由辉瑞制药有限公司提供。百草枯(商品名:克无踪, 20%水剂)由山东科信生物化学有限公司生产馈赠。
1.1.2 动物SPF级雄性Wister大鼠45只, 每只大鼠体重约200 ± 20 g, 由山东大学实验动物中心提供, 实验动物生产许可证号为SCXK (鲁)2005-0015。
1.1.3 试剂Millipore Anti-TIMP-1及Millipore Anti-MMP-9购自北京博奥森工程公司。
1.1.4 仪器低温高速离心机、光学显微镜、恒温水浴箱。
1.2 方法 1.2.1 动物分组Wister大鼠随机分为3组, 正常对照组(A组)、百草枯组(B组)(模型组)、阿托伐他汀干预组(C组)(治疗组), 每组15只。
1.2.2 动物造模方法B组和C组均给与百草枯(商品名:克无踪, 20%水剂)50 mg/kg灌胃染毒, 建立大鼠肺纤维化模型。正常对照组给予等量生理盐水灌胃, 实验期间, 大鼠自由饮水和进食。
1.2.3 给药方法C组给予生理盐水混悬阿伐他汀20 mg/kg灌胃给药, 给药体积为200 μL; A组和B组均给与200 μL生理盐水灌胃。
1.2.4 取材方法于中毒后第7、14、28天分别随机处理各实验组中5只大鼠。腹腔注射10%水合氯醛(3 ml/kg)麻醉后剖腹, 分离右肺, 矢状面切开, 取两块肺组织(1 cm × 1 cm × 0.3 cm), 用棉花纱布包裹, 4%多聚甲醛固定, 96 h后行石蜡包埋切片。
1.2.5 RT-PCR检测肺组织MMP-9、TIMP-1mRNA的表达 1.2.5.1 组织总RNA及总蛋白提取将肺组织在液氮中磨碎, 加入2 ml TRIzol, 用匀浆仪进行匀浆处理。匀浆样品在室温放置5 min, 使核酸蛋白复合物完全分离。加入0.4 ml氯仿, 剧烈振荡15 s, 室温放置3 min。4℃ 10000转/min离心15 min。样品分为三层:底层为黄色有机相, 上层为无色水相和一个中间层。RNA主要在水相中, 水相体积约为所用TRIzol试剂的60%。把水相转移到新管中, 保留有机相。向水相中加入1 ml异丙醇, 室温放置10 min。4℃ 10000转/min离心10 min, 移去上清。加2 ml 75%乙醇。4℃ 7500转/min离心5 min, 弃上清。室温放置干燥, 加入100 μl无RNase的水, 用枪头吸打, 55℃放置10 min使RNA溶解。-80℃保存备用。向有机相中加0.6 ml无水乙醇混匀, 室温放置3 min, 4℃ 2000转/min离心5min。取上清, 加入3 ml异丙醇, 室温放置10 min, 4℃ 12000转/min离心10 min弃上清。用4 ml含0.3 M盐酸胍的95%乙醇洗涤蛋白质沉淀。4℃ 7500转/min离心5 min, 弃上清, 重复两次。用3 ml无水乙醇同样方法再洗一次。真空抽干蛋白质沉淀10 min, 用1% SDS溶解蛋白质, 反复吸打, 50℃温浴使其完全溶解, 不溶物4℃ 10000转/min离心10 min除去。蛋白于-80℃保存备用。
1.2.5.2 RT-PCR反应引物设计
MMP-9引物序列为:
上游:5'-AAA TGTGGGTGTACACA GGC-3',
下游:5-TTCACCCGGTTGTGGAAACT-3',
TIMP-1引物序列为:
上游:5'-ACCACCATGGAGAAGGCTGG-3',
下游:5'-CTCAGTGTAGCCCAGGATGC-3',
内参照采用GAPDH, 引物序列为:
上游:5'-CTTCTGA GTGGCA GTGA TGG-3',
下游:5'-TGGCACA GTAAA GGCTGA GA-3',
RT-PCR反应程序:参照Quantscript RT Kit (cDNA第一链合成试剂盒)说明书进行。
反应条件:MMP-9反应条件:94℃变性30s, 72℃退火1 min, 68℃延伸1 min; 8个循环。TIMP-1反应条件:94℃变性60 s, 56℃退火1 min, 68℃延伸1 min, 72℃延伸1 min; 28个循环.反应完成后, 取出10 μ l PCR扩增产物与上液缓冲液混匀, 加样至2%琼脂糖凝胶, 120V电泳约0.5h。紫外照相。
1.2.6 Western-blot检测肺组织MMP-9、TIMP-1蛋白的表达蛋白定量试剂盒定量提取样品总蛋白浓度, 按试剂盒说明书操作。用上样液将样品稀释至1 mg/ml, 煮沸5 min。制备10 ml 15%聚丙烯酰胺凝胶, 缓缓加入两块玻璃板中, 5 ml每块胶, 上层压1 ml蒸馏水。待分离胶凝后, 配置4 ml 5%浓缩胶, 2 ml每块胶, 插10泳道梳子。待胶凝固后固定到电泳槽中, 加电泳液, 10 ul/道上样。电泳条件为80V 15 min, 120 V 90 min。电泳结束后转膜, 条件为100 mA冰浴4 h。将硝酸纤维素膜置于5%脱脂奶粉中37℃封闭1 h。两块膜分别加PBS稀释的抗MMP-9、TIMP-1抗体, 37℃孵育1 h。PBS洗膜三次, 3 min每次, 加PBS稀释好酶标羊抗小鼠IgG二抗, 37℃孵育1 h。PBSPBS洗膜三次, 3 min每次, 加DAB显色液避光显色3 min, 观察结果。
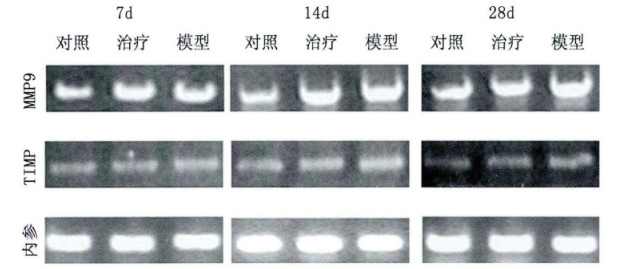
2 实验结果 2.1 RT-PCR检测肺组织MMP-9、TIMP-1mRNA的表达由图 1可以发现, 7 d-28 d各组动物肺组织匀浆中均有MMP-9、TIMP-1mRNA的表达。百草枯模型组MMP-9 mRNA表达量最大, 阿托伐他汀治疗组表达量高于正常对照组, 与百草枯模型组相比MMP-9 mRNA表达量有所下降, 组中内参GAPDH的表达量基本相当(图 1)。TIMP-1 PCR结果显示各组均有表达, 正常对照组中TIMP-1 mRNA表达量稍低, 其余两组无显著差别, 组中内参GAPDH的表达量基本相当(图 1)。
|
图 1 肺组织MMP-9、TIMP-1mRNA RT-PCR产物电泳图 |
综合上述结果, 可以得到以下结论:
MMP-9 mRNA表达结果:正常对照组最低, 百草枯模型组最高, 阿托伐他汀治疗组高于对照组, 但低于模型组。表明阿托伐他汀具有降低大鼠肺组织中MMP-9 mRNA的表达的作用。
TIMP-1 mRNA表达结果:正常对照组稍低, 其余各组差别不大, 且7天、14天与28天相比也没有明显变化。阿托伐他汀对大鼠肺组织中TIMP-1 mR-NA的表达无显著影响。
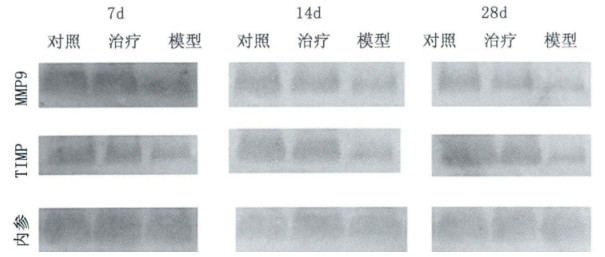
2.2 Western-blot检测肺组织MMP-9、TIMP-1蛋白的表达由图 2可以发现, 百草枯中毒大鼠肺组织内MMP-9及TIMP-1的表达明显高于对照组及治疗组, 治疗组两个细胞因子表达高于对照组, 但显著低于模型组。表明阿伐他丁具有降低百草枯所致肺组织MMP-9及TIMP-1上调作用。
|
图 2 Western-blot检测肺组织MMP-9、TIMP-1蛋白结果 |
表达结果表明阿托伐他汀可以抑制百草枯中毒大鼠肺内MMP-9/TIMP-1的表达, 拮抗百草枯所致的肺纤维化。
3 讨论百草枯是目前使用广泛的除草剂, 肺纤维化是百草枯中毒病例死亡和致残的主要原因, 百草枯的中毒机制仍不完全明确, 临床治疗没有特效解毒剂, 中毒死亡率高, 存活患者也有很大几率遗留肺纤维化, 影响患者的生活质量[3]。近年来有研究发现, 百草枯是一种杂环类有机物, 易被人体主动吸收, 并在肺内堆积, 导致肺部损伤引发肺间质纤维化[4], 如何干预百草枯中毒肺间质纤维化进展是降低患者死亡率及致残率的关键, 是临床研究的热重点。
肺纤维化的形成比较复杂, 目前认为基质金属酶(Matrix Metalloproteinasas, MMPs)及其抑制剂(TIMPS)的平衡水平, 决定细胞外基质(extracelluarmatrix, ECM)的变化趋势, 控制肺纤维化的形成及发展[5]。在肺纤维化模型大鼠中, 肺间质成纤维化细胞对MMP-2、MMP-9的表达能力极高[6], 破坏肺泡上皮细胞膜的完整性, 诱导纤维母细胞进入肺泡引发肺纤维化。因此有学者选择调节MMPs/TIMPS的平衡治疗肺纤维化。而有实验[7]证明, 阿托伐他汀具有降低MMP-9和TMP-1的作用, 在肺纤维并未形成时, 即可从转录水平降低MMP-9的表达, 可能与阿托伐他汀能够减轻基底膜损伤、抑制肺泡炎性渗出的作用有关。在肺纤维化形成开始后, 阿托伐他汀不但对MMP-9的降低作用更加明显, 同时也开始抑制TMP-1的表达。通过降低MMP-9和TMP-1的表达, 调节MMPs/TIMPS的平衡, 延缓肺纤维化的疾病进程, 可用于治疗百草枯中毒。
本实验通过观察阿托伐他汀干预由PQ诱导的肺纤维化模型大鼠对MMP-9和TIMP-1的表达的影响, 探讨阿托伐他汀对PQ中毒导致肺损伤的干预效果。主要检测方法为Western-blot与RT-PCR。对动物肺组织匀浆的MMP-9、TIMP-1mRNA的表达检测发现, MMP-9 mRNA表达水平百草枯组最高, 阿托伐他汀治疗组表达量明显低于百草枯组, 说明阿托伐他汀具有降低大鼠肺组织中MMP-9 mRNA的表达的作用, 但是阿托伐他汀TIMP-1 mRNA表达无显著影响。检测模型大鼠肺组织内MMP-9及TIMP-1的表达水平时, 发现治疗组中两个细胞因子的表达均高于模型组, 但显著低于模型组, 表明阿伐他丁具有抑制百草枯所致肺组织MMP-9及TIMP-1表达的作用, 为百草枯中毒肺间质纤维化治疗提供新的途径。
| [1] |
Haslinger - Loffler B. Multiple effects of HMG - CoA reductase inhibitors(statins) besides their lipid - lowering function[J]. Kidney Int, 2008, 74: 553-555. DOI:10.1038/ki.2008.323 |
| [2] |
Izidoro - Toledo TC, Guimaraes DA, Belo VA, et al. Effects of statins on matrix metalloproteinases abd their endogenous inhibitors in human endothelial cells[J]. Naunyn Schmiedebergs Arch Pharmacol, 2011, 383: 547-554. DOI:10.1007/s00210-011-0623-0 |
| [3] |
赵燕燕, 刘会芳, 许鸣华, 等. 百草枯中毒的急救与影响预后的因素分析[J]. 中国急救医学, 2007, 27(8): 733-735. DOI:10.3969/j.issn.1002-1949.2007.08.020 |
| [4] |
Li Z, Yang J, Yu G, et al. Water - soluble pillar arene: synthesis, pH - controlled complexation with paraquat, and application in constructing supramolecular vesicles[J]. Org Lett, 2014, 16(7): 2066-2069. DOI:10.1021/ol500686r |
| [5] |
Santana AN, Kairalla RA, Carvalho CR, et al. Potential role of statin use in idiopathic pulmonary fibrosis[J]. Am J RespirCritCareMed, 2008, 177: 1048-1048. |
| [6] |
Ramos C, Montano M, Garcia Alvarez J, et al. Fibroblast from idiopathic pulmonary fibrosis and normal lungs differ in growth rate apoptosis and tissue inhibitor of metalloproteinases expression[J]. Am J Respir Cell Mol Biol, 2001, 24(5): 591-598. DOI:10.1165/ajrcmb.24.5.4333 |
| [7] |
刘斌, 张玉华, 魏路清, 等. 阿托伐他汀对肺纤维化大鼠MMP - 9和TIMP - 1表达的影响[J]. 基础医学与临床, 2011, 31(1): 91-92. |


