2. 第三军医大学军事毒理学研究所
2. Institute of Toxicology, College of Preventive Medicine, Third Military Medical University
近年来对电离辐射诱发体细胞次黄嘌呤鸟嘌呤磷酸核糖转移酶(hypoxanthine guanine phosphoribosyl transferase,Hprt)基因位点突变的研究国内外已有大量的报道[1-3]。Hprt基因定位于X性染色体长臂远端q26、27区域,功能上是半合子,突变即可表现出来。Hprt基因对电离辐射和化学诱变剂非常敏感,且这种突变是不可逆的,因此,Hprt基因突变频率检测在电离辐射损伤的早期剂量评估和远后效应观察中起着重要作用[4]。茶多酚(tea polyphenols,TP)是从绿茶中提取的主要活性成分,具有抗炎、抗氧化、抗辐射、提高机体免疫力等多种生物学作用[5-7],文献对茶多酚抗辐射作用主要集中在抗氧化和清除自由基方面,对其抗基因突变方面的研究较少,Xu Y等[8]报道表没食子儿茶素可降低UVA诱导的人皮肤成纤维细胞Hprt基因突变率,文献未见TP对小鼠外周血淋巴细胞Hprt基因突变影响的报道,本文采用多核细胞法,研究TP对60Co γ射线致细胞Hprt基因突变的影响,以探讨TP作为辐射防护剂对辐射遗传毒性的干预。
1 材料和方法 1.1 材料 1.1.1 茶多酚系浙江大学茶学系王岳飞教授惠赠。
1.1.2 实验动物健康雄性KM小白鼠48只,体质量25 ~ 30 g,由第三军医大学实验动物中心提供。实验动物生产许可证号: SCXK-(军) 20120011,使用许可证号: SYXK-(军) 2007035。
1.1.3 主要试剂植物凝集素(PHA)、6-巯基鸟嘌呤(6-TG)、细胞松弛素B (Cyt-B),美国Sigma公司; RPMI 1640培养基,Hyclone公司; 胎牛血清,浙江天杭生物科技公司。
1.2 方法 1.2.1 动物分组与给药将小鼠随机分为正常对照组(不照射,不给药)、照射组(1、2、4、8 Gy照射后不给药),TP保护组(高、中、低剂量分别于8 Gy照射后给TP725、145、29 mg/kg),分别相当于1/2、1/10、1/50LD50 [9],每组6只,照射后当日给药,正常对照组和模型组小鼠给予生理盐水灌胃,0.1 ml/10 g,TP组及TP保护组分别给予相应剂量TP,每日一次,共14天。
1.2.2 辐射源60Co γ源,由第三军医大学辐照中心提供。
1.2.3 照射方式和剂量除正常对照组外,其余各组小鼠置于专用辐照盒内制动以保证照射的均匀性,给予60Co γ射线一次性照射,分组照射0、1、2、4、8 Gy。
1.2.4 细胞培养参照文献[4]并加以改进。动物于辐照后14天用8%乌来糖麻醉,固定于专用解剖台上,75%乙醇消毒后将小鼠转移至超净台中,先用一套剪刀和镊子剪开小鼠皮肤,换一套干净的剪刀和镊子剪开胸腔,心脏穿刺取血0.3 ml,抗凝,分别装入含0.1 mmol/L 6-TG和不含0.1 mmol/L 6-TG的培养液(内含RPMI 1640,15%小牛血清,1 g/l PHA,肝素钠10 U/L)中,37℃恒温培养30 h加入终浓度为6 μg/ml的Cyt-B,继续培养至72 h制片,Giemsa染色15 min,镜检。
1.2.5 细胞识别的标准及计数每个剂量点分别计数5000个双核或多核淋巴细胞数。每个样本计数1000个存活淋巴细胞,统计多核淋巴细胞数。
1.2.6 统计学处理分别计数1 000个转化淋巴细胞中多核淋巴细胞数,用含6-TG多核淋巴细胞数除以不含6-TG的多核淋巴细胞数,得出Hprt基因位点突变频率。应用SPSS 17.0统计软件,实验组与对照组间比较采用χ2检验。
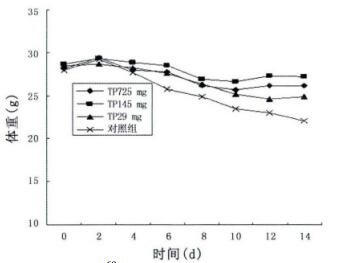
2 结果 2.1 TP对60Co γ照射后小鼠体重的影响60Co γ照射后各组小鼠食欲明显降低,毛不洁,活动减少,体重逐渐下降。TP保护组至照射后第8天体重有缓慢上升趋势,照射后14天未发生死亡,而生理盐水对照组小鼠体重则持续降低,于照射后第7天死亡1只。如图 1所示。
|
图 1 TP对60Co γ照射后小鼠体重的影响 |
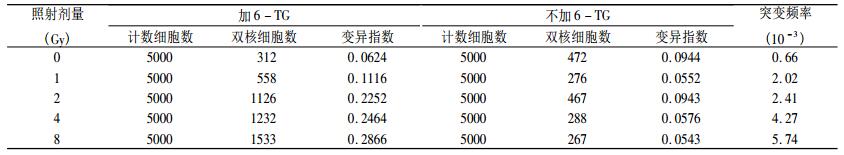
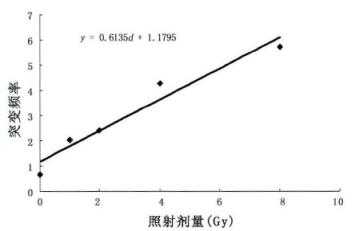
0 ~ 8 Gy 60Co γ射线照射可诱发小鼠淋巴细胞Hprt基因发生突变,且随照射剂量增加突变频率随之增加,突变频率Y(10-3)与照射剂量D(Gy)间可拟合为Y = 1.1795 + 0.6135D,相关系数r = 0.973(图 2)。
|
图 2 60Co γ射线照射诱发小鼠外周血淋巴细胞Hprt基因突变频率的剂量效应曲线 |
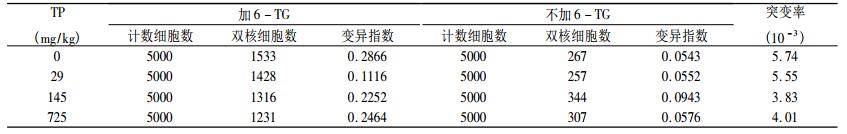
8 Gy 60Co γ射线照射后TP 29 mg/kg、145 mg/kg、725 mg/kg灌胃14 d,小鼠外周血淋巴细胞HPRT基因的突变频率如表 2所示,随着TP浓度的增大,存活细胞中的多核细胞数及Hprt基因突变频率呈下降趋势,说明TP对60Co γ射线所致小鼠外周血淋巴细胞Hprt基因突变具有保护效应,725 mg/kg组较145 mg/kg组突变频率升高,可能与TP超过一定的使用限量后不仅不会清除自由基,反而在体系自由基的存在下发生促氧化作用有关[10]。
|
|
表 1 60Co γ射线照射诱发小鼠外周血淋巴细胞Hprt基因突变频率 |
|
|
表 2 TP对8 Gy 60Co γ射线照射后小鼠外周血淋巴细胞Hprt基因突变的保护效应 |
Hprt基因是研究基因突变的重要位点。人类体细胞Hprt基因位于X性染色体长臂远端Xq26区域上。Hprt基因表达产物Hprt是一种细胞膜酶,存在于人体所有组织中,参与细胞嘌呤核苷酸的补救合成[11-12]。多核细胞(CB)法检测体细胞Hprt基因位点突变简单、快速、灵敏,检出率比5-Brdurd法可高出11 ~ 17倍[13],有研究显示,电离辐射诱发的Hprt基因突变与基因重排有关[3]。中子辐射可导致CHO细胞Hprt基因发生碱基替换,并以颠换为主[14]。茶多酚可通过减少辐射诱发的细胞凋亡及减轻DNA损伤而发挥抗辐射、抗衰老、抗癌、提高机体免疫力等作用,但如果受照射的细胞不发生凋亡及DNA损伤而发生基因突变,产生遗传性损伤,TP又能否加以保护和修复?本研究结果显示: 0 ~ 8 Gy60Co γ射线照射可诱发小鼠淋巴细胞Hprt基因发生突变,且随照射剂量增加突变频率增加; 照射后TP灌胃725、145、29 mg/kg可对小鼠外周血淋巴细胞Hprt基因突变产生保护效应,TP对细胞Hprt基因突变的保护作用在145 mg/kg剂量组更加明显,表明茶多酚对60Co γ射线所致的遗传损伤具有较好的抑制作用。关于茶多酚抑制Hprt基因突变的机理还不明确,推测与其清除活性氧和自由基,增强机体解毒酶活性,减轻DNA损伤等有关。由于工作量巨大,本次实验仅完成TP针对8 Gy高剂量照射的保护效应,TP能否对小剂量照射诱发的Hprt基因突变产生保护效应以及TP影响Hprt基因突变的分子机制、突变热点分布、体内外突变差异以及突变与修复的关系等问题还有待于进一步深入研究。
| [1] |
Dobrovolsky VN, Shaddock JG, Mittelstaedt RA, Miura D, Heflich RH. Detection of in vivo mutation in the Hprt and Pig-a genes of rat lymphocytes[J]. Methods Mol Biol, 2013, 1044: 79-95. DOI:10.1007/978-1-62703-529-3 |
| [2] |
Maeda M, Kobayashi K, Matsumoto H, Usami N, Tomita M. X-ray-induced bystander responses reduce spontaneous mutations in V79 cells[J]. J Radiat Res, 2013, 54(6): 1043-1049. DOI:10.1093/jrr/rrt068 |
| [3] |
Rothkamm K, Gunasekara K, Warda SA, Krempler A, M Lbrich. Radiation-induced HPRT mutations resulting from misrejoined DNA double-strand breaks[J]. Radiat Res, 2008, 169(6): 639-648. DOI:10.1667/RR1185.1 |
| [4] |
庞轶兵, 丁桂荣, 郭国祯, 任东青, 宫越顺二. 2450MHz微波辐照对小鼠外周血淋巴细胞HPRT基因突变的影响[J]. 第四军医大学学报, 2003, 24(2): 147-149. DOI:10.3321/j.issn:1000-2790.2003.02.015 |
| [5] |
李奇慧, 唐木涛, 赵勇, 等. 茶多酚对60 Co γ射线诱导L5178Y细胞凋亡及氧化应激的保护作用[J]. 第三军医大学学报, 2014, 36(16): 1699-1702. |
| [6] |
王硕, 黄晓波, 许清泉, 等. 茶多酚在草酸和一水草酸钙诱导HK-2细胞损伤中的保护作用[J]. 北京大学学报(医学版), 2013, 45(4): 567-574. DOI:10.3969/j.issn.1671-167X.2013.04.014 |
| [7] |
O'Callaghan Yvonne C, Drummond Elaine, O'Gorman Denise M, et al. Antioxidant and pro-apoptotic effects of marine-derived, multi-mineral aquamin supplemented with a pine bark extract, Enzogenol, and a green tea extract, Sunphenon[J]. Journal of medicinal food, 2013, 16(10): 920-6. DOI:10.1089/jmf.2012.0258 |
| [8] |
Xu Y, Zhu J, Zhou B, et al. Epigallocatechin-3-gallate decreases UVA-induced HPRT mutations in human skin fibroblasts accompanied by increased rates of senescence and apoptosis[J]. Exp Ther Med, 2012, 3(4): 625-630. DOI:10.3892/etm.2012.466 |
| [9] |
王岳飞, 梁善珠, 张士康, 陈红波, 等. 茶多酚抗辐射制剂安全毒理学研究[J]. 茶叶科学, 2011, 31(5): 405-410. DOI:10.3969/j.issn.1000-369X.2011.05.005 |
| [10] |
朴宰日.茶多酚的辐射防护机理及对肿瘤放射治疗的效应[D].杭州, 浙江大学, 2003. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y512023
|
| [11] |
王海燕, 张连珍. 辐射诱发细胞Hprt基因位点突变频率的研究[J]. 辐射防护, 1999, 19(6): 466-469. |
| [12] |
赵经涌, 崔凤梅, 劳勤华, 等. 多核细胞法和Brdurd法检测辐射诱发体细胞Hprt基因突变的比较研究[J]. 工业卫生与职业病, 2003, 29(2): 72-74. DOI:10.3969/j.issn.1000-7164.2003.02.006 |
| [13] |
何晶, 李强. Hprt基因突变分析方法及其在辐射生物学中的应用[J]. 原子核物理评论, 2008, 25(3): 295-299. |
| [14] |
Kinashi Y, Suzuki M, Masunaga S, Ono K. Bystander effect-induced mutagenicity in HPRT locus of CHO cells following BNCT neutron irradiation: characteristics of point mutations by sequence analysis[J]. Appl Radiat Isot, 2009, 67(7-8 Suppl): S325-327. |