多发性小血管炎(microscopic polyangitis, MPA)属于自身免疫性疾病, 是一种坏死性血管炎, 一般无或仅少量免疫复合物沉积、无肉芽肿形成, 与抗中性粒细胞胞浆抗体(antineutrophi cytoplasmic antibody, ANCA)密切相关。一般最常以肺部表现为首发症状, 然后累及全身任何组织和器官, 临床表现有的以单一系统表现, 有的以多系统受累表现, 由于肺部症状及影像学表现无明显特异性, 初诊误诊率较高。本文分析6例MPA的胸部CT表现, 目的提高对本病的认识, 尽早诊断尽早治疗。
1 资料与方法 1.1 一般资料回顾性分析2010-2015年中国中医科学院广安门医院南区和北京中医药大学东直门医院经临床诊断的多发性小血管炎6例, 男4例, 女2例, 年龄48~83岁, 平均年龄60.5岁。患者从发病至确诊时间最短3个月, 最长1年半。
1.2 临床表现和实验室检查6例均有反复发热、乏力、咳嗽、咳痰、气促、呼吸困难4例, 干咳2例, 痰中带血1例, 喘憋活动后加重2例, 时有夜间盗汗5例, 反复腹泻, 脐周阵发性腹痛1例, 乏力、四肢困倦、双下肢水肿2例, 左中下肺可闻及细湿罗音1例, 颈部右侧一肿大淋巴结1例。既往病史眼底出血2例, 鼻出血1例。肾功能损害2例均出现血清肌酐、尿素氮升高。6例核周型ANCA(p-ANCA)均为阳性, 胞质型ANCA (c-ANCA)均为阴性。血C反应蛋白升高4例, 1例正常, 1例未检测。血红蛋白下降3例, 白细胞计数升高3例, 血小板升高3例, 血沉升高6例。2例蛋白尿阳性(+), 血尿阳性(++)。影像学检查:均有多次胸部X射线照片, 6例均有CT扫描。1例死于呼吸衰竭, 1例死于肾功能衰竭。
1.3 仪器与方法采用双源CT或螺旋CT, 6例患者均行高分辨率CT(HRCT), 扫描范围胸廓入口至膈下1 cm。扫描参数为135 kV、0.75 s/周、200 mA、1.0 mm层厚。
1.4 临床诊断1例初诊为"间质性肺炎", 1例初诊为"肺结核", 1例初诊为"急性间质性肺炎伴呼吸衰竭", 1例初诊"间质性肺病伴支气管扩张合并感染", 2例初诊"急性肾小球肾炎"。临床表现出现多器官受累, 分别给予抗炎治疗、强心利尿、血液透析等对症治疗无效, 或预防性抗结核治疗无效, 结合p-ANCA阳性、c-ANCA阴性诊断为MPA。4例给予激素和免疫抑制剂治疗后症状均得到缓解。
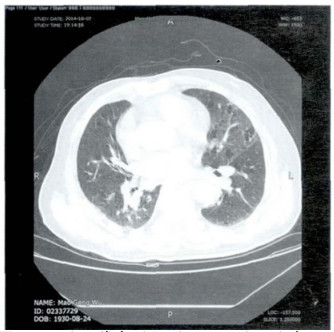
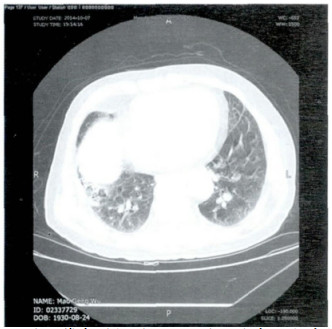
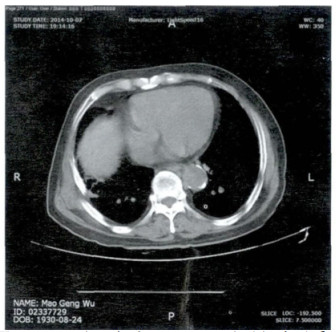
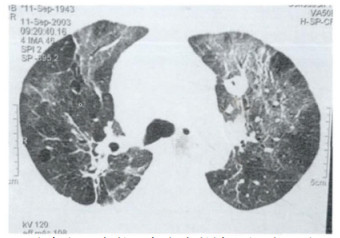
2 结果2例两肺血管束增粗、扭曲, 以肺门为中心向外分布、以双肺下叶为主, 胸膜下弥漫性分布网格影及磨玻璃影, 肺气肿表现、局部肺大泡(图 1~2)。双侧胸腔少量积液, 双侧胸膜轻度增厚(图 3)。4例两肺肺间质性改变, 弥漫性网格状改变, 伴多发斑片影及磨玻璃影样, 部分支气管扩张样改变, 局部可见代偿性气肿(图 4)。
|
图 1 两肺血管束增粗、扭曲, 以肺门为中心向外分布、以双肺下叶为主, 胸膜下弥漫性分布网格影及磨玻璃影, 肺气肿表现、局部肺大泡。 |
|
图 2 两肺血管束增粗、扭曲, 以肺门为中心向外分布、以双肺下叶为主, 胸膜下弥漫性分布网格影及磨玻璃影。 |
|
图 3 双侧胸腔少量积液, 双侧胸膜轻度增厚。 |
|
图 4 两肺多发斑片影及磨玻璃影样改变, 类似肺间质性病变, 少许支气管扩张样改变, 局部可见代偿性气肿。 |
报道MPA是原发性系统性小血管炎中的一种, 发病率仅次于韦格氏肉芽肿, 为自身免疫性疾病主要侵犯小血管, 无或仅少量免疫复合物沉积的坏死性血管炎, 可侵犯肺、肾和皮肤, 至今病因不明[1-3]。几乎可以累及所有器官, 以肺、肾最常见。报道肺是MPA最易受累的脏器之一, 受累比例50%[4-5]。李俊等[6]分析的一组病例肺和肾受累均高达96.6%。肺、肾血管网丰富容易受累。本组4例均有肺受累, 以咳嗽、咳痰、气促、呼吸困难主要表现, 1例痰中带血症状。2例肾脏受累, 诊断肾小球肾炎。
3.2 胸部CT表现分为以下3种类型① 轴心间质性肺炎型:轴心间质性(沿支气管血管周围间质)表现沿肺门向外血管束增粗、扭曲变形, 周围伴有磨玻璃影和(或)实变影, 病灶内可见支气管受牵拉充气扩张表现, 本组3例均有此表现, 本组大片状磨玻璃影这可能与弥漫性肺泡出血有关。②中央"蝶翼"状水肿型:以肺门为中心分布大片状实变影, 单发或多发斑片状影, 本组3例有此表现。③弥漫性间质性肺炎型:呈现双肺多发斑片状、条索影、网格状影, 病变主要分布于双肺下叶, 以胸膜下病变为主:局部可见代偿性肺气肿, 易误诊为间质性肺病(interstitial lung disease, ILD); 晚期表现支气管扩张、肺气肿、蜂窝肺、类似慢性阻塞性肺部疾病改变。Ando[7]等认为ILD是磨玻璃影和实变影进一步发展的结果。本组6例均有此表现, 其中3例同时伴有轴心间质性肺炎表现。
综上所述, MPA肺损害的影像学主要表现间质性改变, 轴心间质和(或)周围间质均可, 呈现血管束增粗、扭曲变形及网格影, 伴磨玻璃影、斑片影及实变影, 继发支气管充气扩张。在MPA的胸部影像诊断中, CT表现虽然无特异性, 但它可以提示间质性改变, 可分以轴心间质性为主间质性改变和周围间质性为主影像学表现, 可以了解病灶形态、部位及范围。影像表现其病理基础为肺泡出血、间质性慢性炎症、血管炎或纤维化。结合临床上有多器官受累表现, 在排除间质性肺炎、结核、特发性纤维化及结缔组织疾病时, 尽早p -ANCA检测阳性, 应考虑肺血管炎的可能, ANCA检测已被公认为早期诊断MPA既敏感又特异的血清学诊断工具[8], 在肺小血管炎中尤为重要, 可以提高诊断率。
3.3 鉴别诊断与间质性肺炎鉴别:MPA在CT上表现为多发性或单发性斑片状影, 一般基于肺间质性改变基础上, 呈现轴心间质和(或)周围间质改变, 临床上常有呼吸道症状、血白细胞增高, 极易误诊间质性肺炎。经抗炎治疗无效, 临床表现反复加重及多系统受累, 尽早进行ANCA检测, 可以尽早做出正确诊断。本组病例中2例误诊为间质性肺炎。
与肺结核鉴别:结核好发部位病灶多位于两肺尖后段、下叶背段。MPA病灶分布无规律, 分布比较广泛基于肺间质分布, 病灶大小不等; 是否有糖尿病病史, 是否是糖尿病合并肺结核, 有助于肺结核诊断。结核病灶一般为多形态病灶同时存在, 即片状、斑点状、条状影、小结节影, 结节灶周围常有卫星病灶, 常出现空洞和钙化, 抗结核治疗有效, 而MPA多为间质性改变为主, 呈轴心间质增厚和(或)弥漫性周围间质增厚表现, 伴片状、小结节状影或少许条索影, 未有空洞及钙化的报道。本组病例中1例误诊为肺结核,
与间质性肺病鉴别:MPA在CT上表现为弥漫性间质性肺病表现时, 需要与肺间质性纤维化鉴别, 如特发性肺纤维化和结缔组织病引起的肺纤维化。仅仅依靠肺部CT表现鉴别有一定困难, 需要结合临床表现及实验室检查, 特发性肺纤维化一般仅肺部表现, 无多系统受累表现, p-ANCA为阴性。结缔组织病引起的肺间质性纤维化, 如原发性干燥综合、多肌炎、系统性红斑狼疮等, 均有小血管炎表现, 明确诊断需结合临床表现及实验室检查。本组病例中1例误诊肺间质性肺病伴支气管扩张合并感染。
与韦格肉芽肿病鉴别:两者均为原发性血管炎, 但WG有肉芽肿形成, 多为两肺多发性斑片、结节及空洞影, 而且WG90%有上呼吸道为首发症状, 如副鼻窦、鼻腔、气管有慢性炎症改变。MPA无肉芽肿形成, 多表现为多发或单发斑片状、大片状浸润或间质性改变, p-ANCA为阳性主要见于MPA。
| [1] |
张晓玮, 刘晶哲, 罗朝峰, 等. 抗中性粒细胞胞质抗体相关肺血管炎的少见CT表现[J]. 中国医学影像学杂志, 2013, 9(20): 702-705. |
| [2] |
Park J, Banno S, Sugiura Y, et al. Microscropic polyangiitis associated with diffusc panbronchiolitis[J]. Inter Med, 2004, 43: 331-335. DOI:10.2169/internalmedicine.43.331 |
| [3] |
Lane SE, Watts R, Scott DG. Epidemiology of systemic vascultitis(Review)[J]. Curr Rheumatol Rep, 2005, 7: 270-275. DOI:10.1007/s11926-005-0036-5 |
| [4] |
中华医学会风湿病学分会. 显微镜下多血管炎诊断指南(草案)[J]. 中华风湿病学杂, 2004, 8(9): 564-565. DOI:10.3760/j:issn:1007-7480.2004.09.020 |
| [5] |
刘鸿瑞. 肺非肿瘤性疾病诊断病理学[M]. 北京: 人民卫生出版社, 2010: 252-261.
|
| [6] |
李俊, 蔡伯蔷. 显微镜下多血管炎29例肺部病变特点分析[J]. 中国实用内科杂志, 2008, 28(11): 940-951. |
| [7] |
Ando Y, Okada F, Matsumoto S, et al. Thoracic manifestation of myeloperoxidase-antineutrophil cytoplasmic antibody(MPO-ANCA)-related disease:CT findings in 51 patients[J]. J C ompul Assist Tomogr, 2004, 28: 710-716. DOI:10.1097/01.rct.0000135280.79012.c7 |
| [8] |
Vassilopoulous D, NilesJI, Villa-Forte A, et al. Prevalence of antineutrophil cytoplasmic antibodies in patients with various pulmonary diseases or multiorgan dysfunction[J]. Arthritis Rheum, 2003, 49: 151-155. DOI:10.1002/art.10997 |




