放射免疫分析技术是利用放射性标记物与免疫学蛋白分子的特异性结合进行疾病诊断的一种分析方法, 广泛应用于内分泌、心血管、肿瘤、消化、呼吸、血液、病毒等疾病的临床诊断领域。放射免疫分析药盒(以下简称"放免药盒")的主要特点是价格低、设备简单、稳定性好, 特别适用于二级医疗机构及边远地区的医疗机构。放免药盒中含有放射性核素125I, 按照国家相关法律法规, 放免药盒的使用单位需办理辐射安全许可证和放射性物质转让手续, 为了便于放免分析技术在二级医疗机构及边远地区的推广, 本文对放免药盒使用豁免管理进行了安全评价。
1 放免药盒产品介绍和使用情况 1.1 放免药盒产品介绍放免药盒中125I标记化合物的制备原理是把125I直接引进分子中的酪氨酸残基的羟苯基上, 采用化学氧化碘化法实现, 待标记化合物氧化碘化后, 在制备的125I标记化合物溶液中加入一定量的还原剂使其稳定存在。
放免药盒由标准品、125I标记物、抗体、分离剂、质控品组成, 其中仅125I标记试剂有放射性。放免药盒含有125I标记试剂一般为5~10mL, 放射性核素125I的含量约3.7×104~1.48×105Bq。125I核素主要γ能量为27.47keV, 半衰期为59.4d[1]。
1.2 放免药盒的使用市场调查根据放免药盒生产厂家营销市场的调查, 2011年全国放免药盒总使用量约为40万盒, 平均每个检测单位年用量约200盒、月用量约18盒、日用量不到1盒。个别用量最多的医院年用量约800盒, 日用量约4盒, 个别体检或独立医学检验机构年用量最多为1600盒, 日平均用量约7盒。由于放免药盒的有效期为一个月, 故所有使用单位一次订货量均采取月或半月需求计。放免药盒使用量较大的体检或独立医学检验机构持有辐射安全许可证。
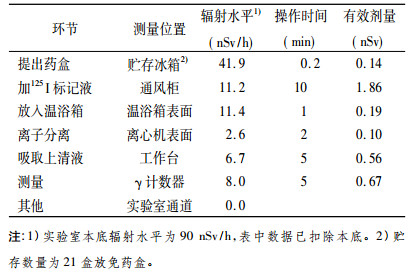
2 放免药盒使用活动的监测及分析中国原子能科学研究院辐射安全研究所对北京中同蓝博临床检验所放免药盒使用活动的场所、检验人员甲状腺和放射性废物进行了监测。测量仪表及主要参数见表 1。
|
|
表 1 监测仪表及主要参数 |
放免药盒使用按照药盒提取, 加125I标记液, 样品温浴, 离心分离, 吸取上清液, 测量六个环节进行了辐射水平监测并记录了操作时间, 监测结果见表 2。根据放免药盒使用的现场监测数据来看, 每操作一盒, 工作人员的个人最大外照射剂量为1.86nSv/h, 按照市场调查年用量最大为1600盒计算, 工作人员年最大外照射剂量为3μSv/h; 操作一盒放免药盒外照射集体有效剂量为3.42nSv, 按照年用量40万盒计算, 放免药盒使用活动的外照射集体有效剂量为1.37人·mSv。
|
|
表 2 放免药盒使用场所辐射水平监测结果 |
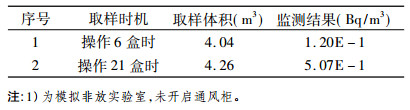
通过对放免药盒使用场所进行取样测量, 测量结果见表 3。
|
|
表 3 放免药盒使用场所气溶胶测量结果1) |
根据气溶胶监测结果分析, 操作1盒放免药盒产生的平均气溶胶浓度为0.022Bq/m3, 按照每天操作7盒, 平均气溶胶浓度为0.088Bq/m3, 按照工作人员年工作2000h, 吸入空气量为2400m3, 计算工作人员最大年摄入量为211Bq, 按照GB18871-2002[2]中125I核素工作人员吸入单位摄入量所致的待积有效剂量为7.3×10-9Sv /Bq,估算操作人员最大待积有效剂量为15 μSv。
北京中同蓝博临床检验所放免检验室尺寸为4m (长)×3.5m(宽)×3m(高), 实验室容积为42m3, 按照每盒产生的平均气溶胶浓度为0.022Bq/m3, 那么每盒挥发的125I核素活度为0.92Bq, 按年用量40万盒计算, 放免药盒使用活动每年向环境排放125I核素的活度为3.70×105Bq, 按照全部吸入人体计算, 产生的待积有效剂量为2.70人·mSv。
对操作21盒放免药盒检验人员进行了甲状腺125I核素测量, 测量结果低于仪表最低检测限(MDA), 详见表 4。
|
|
表 4 检验人员甲状腺125I核素测量结果 |
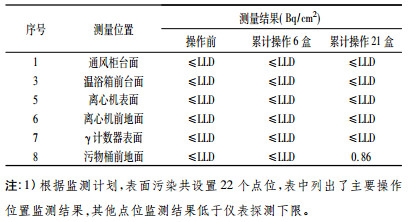
在放免药盒使用过程中, 多次对工作台面、实验室地面进行表面污染监测, 除发现1点位有0.86Bq/cm2的轻微污染外, 其它实验室内相关点位的表面污染测量结果全部小于监测仪表的探测下限, 详见表 5。
|
|
表 5 放免药盒使用场所表面污染测量结果1) |
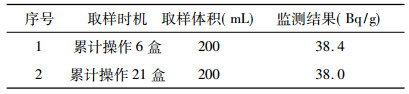
放免药盒使用产生的废液主要为离心机分离检测样品生成的上清液, 利用真空泵使废液暂存瓶形成负压, 用连接在暂存瓶的吸液管吸入废液暂存瓶内。每个分析样品可产生1.3 mL废液, 每盒放免药盒使用可产生约130 mL废液。对产生的废液取200 mL进行了测量, 检测结果见表 6。
|
|
表 6 放射性废液样品测量结果 |
放免药盒产生的放射性废物主要为试管和试管内存留的样品标记物。通过对固体废物取样测量, 测量结果见表 7。
|
|
表 7 固体放射性废物样品测量结果 |
放免药盒使用活动, 检验人员的外照射年最大有效剂量低于3μSv/h, 内照射年待积有效剂量低于1.5 μSv/h, 合计为4.5μSv/h; 放免药盒使用活动, 年产生的外照射集体有效剂量低于1.37人·mSv, 年产生的内照射集体有效剂量低于2.70人·mSv, 合计4.07 mSv。符合GB18871-2002中豁免准则"被豁免实践或源使任何公众成员一年内所受的有效剂量预计为10μSv/h量级或更小和实施该实践一年内所引起的集体有效剂量不大于约1人·Sv"[2]的要求。
放免药盒使用单位产生的放射性废液活度浓度≤38.4Bq/g, ,放射性固体废物的活度浓度≤250.4 Bq/g, 低于GB18871-2002中125I核素的豁免活度浓度1×103Bq/g[2], 而放射性废物清洁解控水平是参照豁免的活度浓度或活度执行的, 故放免药盒使用产生的放射性废液和固体废物低于清洁解控水平。
放免药盒单盒125I活度最大为1.48×105Bq, 125I核素的豁免活度1×106Bq[2](相当于7盒放免药盒的总活度), 根据市场调查, 放免药盒使用单位一般日操作量低于豁免活度, GB18871-2002中丙级非密封源工作场所日等效操作量的下限为豁免活度[2], 可以在非放工作场所进行操作。对于日操作量有可能大于豁免活度的体检中心或独立医学检验机构具有辐射安全许可证及丙级以上非密封源工作场所。
4 结论125I放免药盒使用活动满足GB18871-2002中豁免准则, 产生的放射性废物低于清洁解控水平, 能够保障在实践中公众和环境的安全, 建议对放免药盒使用活动实行豁免管理。
| [1] |
卢玉楷. 简明放射性同位素应用手册[M]. 上海: 上海科学普及出版社, 2003: 285-286.
|
| [2] |
中华人民共和国国家质量监督检验检疫总局.GB 18871-2002电离辐射防护与辐射源安全基本标准[S].北京: 中国标准出版社, 2002.
|