人们在享受核技术快速发展带来的便利同时也要面对核污染、核事故等的危害。寻找高效、低毒的辐射防护剂一直受到重视。由于小剂量的稀土在医学、生物学、药学等方面的广泛应用(主要为轻稀土元素),并被证明是生物微量元素,属低毒物质,适量摄入有助于提高机体免疫力和抗病能力[1]。纳米材料一般是指粒径为1 ~ 50 nm的极小微粒物质,当材料被制成纳米级时,其理化性质可能会发生变化,纳米氧化铈兼具纳米材料和稀土的特性,在功能陶瓷、抛光、燃料、食品抗氧化剂等方面得到广泛应用[2-5]。近年来的研究表明,纳米稀土可以和活细胞、蛋白兼容,具有较高载药量,易于穿透血管,免受酶的降解,局部聚集浓度高,毒性小等特点,在疾病的诊断和防治中将发挥更大的作用[6-7]。但目前有关纳米稀土的生物效应及辐射防护方面的作用研究甚少,本研究欲探讨氧化铈对小鼠抗辐射功能的影响。
1 材料与方法 1.1 试剂纳米氧化铈(纯度99.99%、粒径30 ~ 50 nm,广州惠州瑞尔化学科技有限公司),用5‰羧甲基纤维素纳溶液将纳米氧化铈粉末配制成3种剂量的混悬液。
1.2 实验动物及分组SPF (无特定病原体)级BALB /c小鼠购于北京维通利华实验动物技术有限公司。生产许可证号: SCXK (京) 2012-0001,雌雄各半,体重(18 ± 2) g。小鼠适应性喂养5天后随机分为6组:实验组按照纳米氧化铈不同剂量分为低剂量组(100 mg/kg)、中剂量组(300 mg/kg)、高剂量组(900 mg/kg)。对照组分为阴性对照组、照射对照组和阳性药物(氨磷汀)对照组。阴性对照组和照射对照组灌服给水,实验组给予不同浓度的纳米氧化铈羧甲基纤维素钠混悬液。均以0.02 ml /g做灌胃处理,每日1次,每周6次。灌胃持续时间自照射前2周至照后处死。每组20只小鼠,雌雄各半。阳性药物组于照射前30 min腹腔注射氨磷汀(200 mg/kg) 1次。
1.3 照射条件照射时,每只小鼠放进1个独立的有机玻璃容器中进行单次60Co γ射线源均匀静态全身照射,照射剂量为3.5 Gy,剂量率1 Gy /min(北京师范大学钴源)。
1.4 样本检测照射后3天和8天,每组各取10只小鼠,称取小鼠体质量后,从小鼠眼眶取血后,颈椎脱臼处死。
1.4.1 脾脏和胸腺系数处死小鼠后取脾脏和胸腺称重,计算脏器系数。以小鼠胸腺、脾脏的重量除以小鼠体重,得到胸腺系数和脾脏系数(mg/g × 1000‰)。
1.4.2 骨髓嗜多染红细胞微核率取小鼠胸骨,用止血钳挤出骨髓于滴有血清的玻片上,常规制备骨髓涂片。甲醇固定5 min,Giemsa染色,油镜下观察。选取分散均匀、染色良好、完整清晰的嗜多染红细胞群,统计微核的出现率。每只小鼠计数1000个以上嗜多染红细胞,观察含有微核的嗜多染红细胞数,微核率以千分率(‰)表示。一个嗜多染红细胞中出现一个或多个微核,仍按一个细胞计数。
1.4.3 血清总超氧化物岐化酶(SOD)的测定按南京建成生物工程研究所试剂盒说明操作。
1.4.4 小鼠胸腺淋巴细胞肌动蛋白微丝骨架观察解剖小鼠,取出胸腺,用注射器吸PBS冲出胸腺细胞,1000 rpm离心5 min。弃上清,加入溶血素,避光5 min,离心弃上清,加入4%多聚甲醛,混匀,离心弃上清,加入0.2% Triton-X100,静置8 min,离心后加入0.5% BSA,静置10 min,离心弃上清,加入终浓度为5 μg /ml FITC-Phalloidin,混匀,37℃,孵育30 min,离心弃上清,加入终浓度为20 μg /ml PI,混匀后37℃,孵育5 min,离心弃上清,用1 ml 0.01 M清洗1次,调整细胞浓度约为104 ~ 105。吸出细胞悬液滴片,并用抗荧光淬灭剂封片。激光共聚焦显微镜观察胸腺细胞肌动蛋白微丝骨架的形态。
1.5 数据统计采用SAS 9.1软件进行数据分析,小鼠脏器系数、骨髓嗜多染红细胞微核率和血清总SOD活性数据均方差齐,采用t检验进行实验组与对照组的比较。
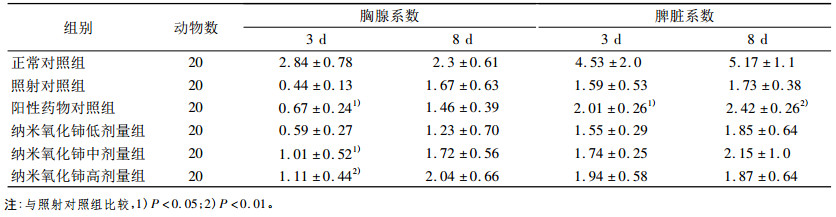
2 结果 2.1 脾脏和胸腺系数受照后3天和8天,照射对照组与正常对照组相比小鼠脾脏系数和胸腺系数均降低(P<0.05);与照射对照组相比,照后3天给药组胸腺系数均增高,除低剂量组外各给药组差异有统计学意义(P<0.05或P<0.01)。照后3天和8天脾脏系数均增高,阳性药物组差异有统计学意义(P<0.01)。纳米氧化铈各剂量组与照射对照组相比差异无统计学意义。见表 1。
|
|
表 1 纳米氧化铈对照射后3天和8天小鼠胸腺和脾脏系数的影响 |
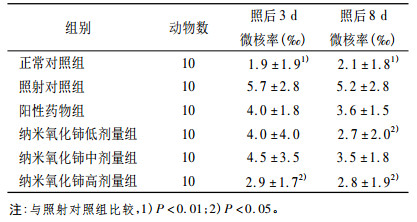
照后3、8天,照射对照组与正常对照组相比骨髓嗜多染红细胞微核细胞率显著升高(P<0.01)。纳米氧化铈低、中、高三个剂量组骨髓嗜多染红细胞微核细胞率均较照射对照组降低; 其中照后3天的低剂量组及照后8天的低、高剂量组与照射对照组相比差异有显著性(P<0.05),见表 2。由表 2可知,小鼠受60Co γ射线照射后,骨髓中含有微核(MN)的骨髓嗜多染性红细胞(PCE)数目显著增多,与对照组相比差异极显著(P<0.01),这是γ射线导致遗传物质染色体损伤的结果。在小鼠辐照前后,每日灌胃纳米氧化铈给药照射组,辐射诱发产生微核的PCE数明显低于未给药的照射组,照后3天低剂量组及照后8天的低、高剂量组与照射对照组差异有显著性(P<0.05)。说明纳米氧化铈具有抑制γ射线诱发微核细胞增加的效应,即具有抗辐射的作用。
|
|
表 2 纳米氧化铈对受照小鼠骨髓嗜多染红细胞微核率的影响 |
从表 3可以看出,照射组小鼠血清中总SOD酶活性显著降低(P<0.05),表明辐照后机体抗氧化能力下降,而阳性药物组和纳米氧化铈中剂量组小鼠的总SOD活性均高于照射对照组的总SOD,表明纳米氧化铈中剂量组有一定的保护抗氧化酶和还原性物质免受自由基的攻击,从而提高机体的抗氧化能力。
|
|
表 3 纳米氧化铈对照后8天小鼠血清总SOD活性的影响 |
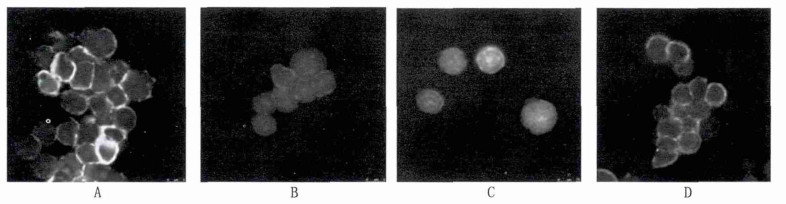
由图A可见,对照组未受射线照射,胸腺淋巴质F-actin(纤维状肌动蛋白)清晰可见,排列紧密,边缘光滑、完整,G-actin(球状肌动蛋白)显色不明显。图B,3.5 Gy γ射线照射后,F-actin分布较少荧光暗弱,分段不连续,可见红色G-actin弥散分布。图C,氨磷汀阳性药物组经3.5 Gy γ射线照射后,可见弥散分布的F-actin,有的F-actin收缩呈球状,G-actin显色不明显。图D,纳米氧化铈中剂量组经3.5 Gy γ射线照射后可见边界较为清晰完整的F-actin,有的成条索状,G-actin呈局部浓聚。
|
图 1 不同组中胸腺淋巴细胞微丝骨架形态变化(63倍油镜观察) 注: A为正常对照组; B为照射对照组; C为阳性药物组; D为纳米氧化铈中剂量组。 |
辐射可以直接作用于DNA、蛋白质及酶类,使分子变性、细胞结构破坏; 也可以作用于机体内水分子,使其产生大量的具有强氧化性能的自由基,致使机体代谢紊乱,引起免疫、神经和内分泌系统的调节功能障碍等一系列病变。骨髓细胞微核数增高、血或组织中SOD活性降低及脾脏指数和胸腺指数明显降低等均为一次性全身γ射线照射引起辐射损伤的主要表现。
胸腺和脾脏是免疫系统的重要组成部分,对辐射很敏感。辐射使脾脏指数和胸腺指数明显降低,意味着免疫功能受损。本研究结果表明:小鼠经3.5 Gy60Co γ射线照射后,脾指数和胸腺指数明显下降,表明电离辐射对小鼠的免疫器官造成严重损伤,照前及照后给予纳米氧化铈,纳米氧化铈中、高剂量组均能提高脾指数和胸腺指数,特别是照后3天脾指数和胸腺指数与照射对照组比较明显增高,表明纳米氧化铈在急性照射早期对胸腺有一定的保护作用。通过对胸腺淋巴细胞微丝骨架成像也发现纳米氧化铈对胸腺细胞形态完整具有保护作用。有研究表明纳米氧化铈可以通过清除细胞内活性氧自由基来缓解过氧化氢所致的细胞氧化损伤,抑制过氧化氢诱导的细胞凋亡,从而对细胞起到一定的保护作用[8-9]。
辐射会导致骨髓嗜多染红细胞微核细胞率增加,微核是在细胞有丝分裂后期没有进入细胞核而留在细胞质中的染色体或片段,它微核的多少直接反映染色体的损伤程度,也间接代表机体受辐射损伤的状况[10-12]。检测结果表明,阳性药物组及纳米氧化铈各剂量组小鼠骨髓细胞的微核细胞率虽然仍高于阴性对照组,但和照射对照组比较,有微核细胞率降低的表现,可推测纳米氧化铈或增强细胞DNA损伤修复能力或保护遗传物质免于损伤,从而提高细胞的辐射耐受性,保全造血功能,利于造血干细胞恢复和再生,提示纳米氧化铈具有一定的抗辐射功能,对辐射损伤小鼠具有良好的保护作用。
另外,正常组织受到辐射后,会产生大量自由基,后者作用于生物膜引起脂质过氧化,造成生物膜功能和代谢的改变。SOD作为机体组织主要清除自由基的抗氧化酶,其活力的高低可间接反映机体清除自由基的能力。因此,SOD活性的高低间接地反映机体清除氧自由基的能力。本实验结果表明:小鼠受到3.5 Gy 60Co γ射线照射后,与正常对照组相比总SOD活性显著下降,机体的氧化-还原平衡遭到破坏; 照射前、后给予纳米氧化铈后,中剂量组小鼠的血浆中SOD活性有提高的趋势,但差异无统计学意义。申世刚[13]等所做的研究发现3种尺寸的纳米氧化铈可以不同程度地缓解A549氧化损伤,能够清除部分自由基,对A549细胞起到了一定的保护作用。并证实纳米氧化铈可以通过清除细胞氧自由基来实现对细胞的保护作用。而Oberdorster等[14]的研究结果表明纳米颗粒的生物学效应与其表面积大小密切相关,并且提出纳米颗粒的尺寸与其生物学效应有一定的相关性。本研究纳米氧化铈清除自由基的作用不十分明显,是否与纳米氧化铈的粒径有关有待于进一步的研究。
纳米氧化铈能够降低骨髓微核率,说明在一定程度上它能够抑制辐射所致的突变病变,抗辐射损伤的机理还可能与它能提高小鼠体内抗氧化物酶的活性、保护细胞微丝骨架结构完整、刺激胸腺和脾脏的增殖有关。纳米氧化铈可以提高辐射损伤小鼠的脾脏和胸腺指数,减轻其对细胞DNA的损伤,具有提高机体抗氧化能力的趋势,表明纳米氧化铈对60Co γ射线造成的小鼠造血和免疫系统及抗氧化功能损伤具有一定的防护作用。
志谢: 感谢广州惠州瑞尔化学科技有限公司姜亚昌在试验过程中给予的帮助。
| [1] |
Schubert D, Dargusch R, Raitano J, et al. Cerium and Yttrium oxide nanoparticles are neuroprotective[J]. Biochemical and Biophysical Research Communication, 2006, 342: 86-91. DOI:10.1016/j.bbrc.2006.01.129 |
| [2] |
宋晓岚, 杨振华, 邱冠周, 等. 纳米氧化铈在高新技术领域中的应用及其制备研究进展[J]. 材料导报, 2003, 17(12): 36-39. DOI:10.3321/j.issn:1005-023X.2003.12.011 |
| [3] |
GAO Feng, LU Qingyi, KOMA RNENIS, et al. Fast synthesis of cerium o xide nanoparticles and nanorods[J]. J Nanosci Nanotechnol, 2006, 6(12): 3812-3819. DOI:10.1166/jnn.2006.609 |
| [4] |
MASUIT, OZAKIT, MACHIDAK, et al. Prè paration of ceria-zirconia sub-catalysts for automotive exhaust cleaning[J]. J Alloy Compd, 2000, 303: 49-55. |
| [5] |
洪广言. 稀土纳米材料的应用研究[J]. 稀土信息, 2007(11): 15-18. |
| [6] |
Colon J, Herrera L, Smith J, et al. Protection from radiation-induced pneumonitis using Cerium oxide nanoparticles[J]. J Nanomedicine, 2009, 5: 225-231. DOI:10.1016/j.nano.2008.10.003 |
| [7] |
Colon J, Herrera L, Smith J., et al. Cerium oxide nanoparticles protect gastrointestinal epithelium from radiation-induced damage by reduction of reaction oxygen species and upregulation of superoxide dismutase 2[J]. J Nanomedicine, 2010, 6: 698-705. DOI:10.1016/j.nano.2010.01.010 |
| [8] |
吕丽萍, 杨静, 杨通旺, 等. 纳米氧化铈对大鼠肺泡巨噬细胞NR8383的增殖影响[J]. 包头医学院学报, 2014, 30(5): 1-4. |
| [9] |
周国强, 王文颖, 刘慧玲. CeO2纳米颗粒对过氧化氢所致A549细胞损伤的保护作用[J]. 环境与健康杂志, 2012, 29(2): 142-145. |
| [10] |
吴健全. 染料大黄酮抗辐射作用的研究进展[J]. 中华预防医学杂志, 2003, 4(4): 311-313. |
| [11] |
Hosny Mansour H, Farouk Hafez H. Protective effect of Withania somnifera against radiation-induced hepatotoxicity in rats[J]. Ecotoxicol Environ Saf, 2012, 80: 14-19. DOI:10.1016/j.ecoenv.2012.02.003 |
| [12] |
彭晓莉, 杨臻, 吕晓华. 番茄红素对小鼠辐射损伤的防护作用[J]. 卫生研究, 2006, 35(2): 232-233. DOI:10.3969/j.issn.1000-8020.2006.02.032 |
| [13] |
申世刚, 刘慧玲, 王文颖, 等. CeO2纳米颗粒对A549细胞的保护作用[J]. 河北大学学报(自然科学版), 2011, 31(2): 160-166. DOI:10.3969/j.issn.1000-1565.2011.02.011 |
| [14] |
Oberdorster G, Oberdoster E, Oberdoster J, et al. Na no toxicology: an emer ging discipline ev olving from studies of ultrafine particles[J]. Enviro n Health Perspect, 2005, 113(7): 823-829. DOI:10.1289/ehp.7339 |