2. 四川省科学城医院
2. Sichuan Science City Hosipital
氚是一种天然的放射性核素, 它广泛存在于自然界中。同时氚也是一种重要的聚变核素, 在医学[1]、环境科学[2]、生物学及工业等领域中广泛使用并具有重要的研究价值。由于核工业的快速发展, 会产生大量的氚并释放到环境中。由于氚与氢具有相似的化学性质, 因此通过同位素交换反应氚可以进入含氢物质相应分子当中。体内氚的生物半排期虽不长(约8~10 d), 但生物氚的半排期可达300~600 d[3], 很难排出体外。氚的β粒子平均能量5.72 keV, 最大能量为18.6 keV, 在空气中平均射程很短为0.036 cm, 不会对人造成外照射危害, 但摄入生物体后会造成内照射危害。依据ICRP 60号出版物可知, 对于空气中相同的浓度, 氚-水(HTO)相对氚-气(HT)的放射学危害是10 000:1。氚极易经呼吸、饮水、饮食及皮肤途径进入人体并与体内细胞的DNA或RNA结合, 直接产生辐照作用, 从而诱发染色体畸变、微核的产生。与氢不同的是氚本身还具有一定的化学毒性, 研究证明HTO β粒子的辐射权重变化范围在1.7~2.4之间[4], 是一个与公众健康密切相关的核素。本文拟通过低活度氚水β射线和60Co γ射线照射G0期人体淋巴细胞研究其诱发染色体畸变的剂量效应关系, 并用CB微核的结果进行对比, 讨论氚β射线对于60Co γ射线对人体的相对生物效应。
1 材料和方法 1.1 材料实验所用氚水活度4.65 × 108 Bq/ml, 中国工程物理研究院核物理与化学研究所。其他常用试剂均为化学纯, Sigma公司。
1.2 外周血淋巴细胞染色体标本制备采集3名健康人静脉血10 ml (2男1女, 无吸烟史, 年龄25~28岁)用肝素(500 kU/L)抗凝, 在采血后24 h内培养。每瓶接种0.4 ml全血, 严格无菌操作。每瓶培养液内含有RPMI 1640培养液4 ml、5-溴脱氧尿嘧啶核苷、PHA 25 mg、链霉素、青霉素、肝素(500 kU/L)0.1 ml、小牛血清1ml, 其最终浓度为5 mg/L, 用3.5% NaHCO3溶液调pH值至7.4。加血摇匀后置(37.0 ± 0.5)℃温箱内避光培养72 h, 淋巴细胞分别在培养的第24 h、48 h加入HTO (0.1~100 μl), 对照组加入相同体积的0.9 g%的NaCl溶液。终止培养前3 h加秋水仙素, 最终浓度是0.14 mg/L。终止培养后吸去上层清液, 加入0.075 mol/L的KCl低渗, 然后用新鲜配制的固定液(甲醇:冰醋酸为3:1)进行固定。制成玻璃片后自然风干用5% Giemsa染色后, 每份标本在油镜下选择分散度好、图像清晰、细胞完整的500个中期相细胞计数。
1.3 外周血淋巴细胞微核制备采用微量全血培养法, 微核培养方法与染色体一致, 只是在培养的第44 h加入细胞松弛素B (Cytochalasin-B, Cyt-B)在培养基中最终浓度达到6 μg/ml, 继续培养至72 h收获。制片时加低渗液后立即预固定, 使细胞膨胀而胞浆保持完整。滴片时, 细胞悬液滴在冰冷条件下浸泡过的洁净玻片上, Giemsa染色。每例观察1000个转化的淋巴细胞, 结果以微核细胞率(‰)和微核率(‰)表示。
1.4 照射条件在60Co γ射线照射对照实验中, 所用60Co源剂量率为2.5 × 10-4 Gy/s, 对用肝素抗凝的静脉血照射不同时间(与氚水照射样品剂量一致), 采用氚水组的方法培养和处理得到的不同剂量照射样品。
2 β射线照射淋巴细胞所产生的平均吸收剂量的计算人体外周血淋巴细胞在含有氚培养基中照射t秒, 其平均吸收剂量由公式(1)估算:
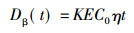
|
(1) |
式中:Dβ(t)是t时接受的β剂量, Gy; t是暴露的时间, s; C0在培养基中的活性浓度, Bq·kg-1; E是β射线的平均能量, 5.7 keV; K是转换系数, 1.6 × 10-13 kgGyMeV-1; η是氚在淋巴细胞中的浓度和正常浓度的比值, 其值为0.92(淋巴细胞中氚浓度的修正系数)。
3 结果与讨论 3.1 β射线照射G0期淋巴细胞诱发染色体畸变的剂量-效应关系分析各剂量点样片, 根据初算的畸变率及公式(2)计算20%允许误差所需分析细胞数目。
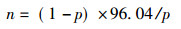
|
(2) |
式中, n为应分析细胞数, 个; p为畸变细胞率, (dic+r)/细胞。
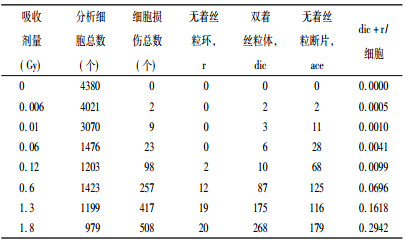
表 1给出几种染色体型畸变的非稳定性畸变, 包括:无着丝粒断片、无着丝粒环、双着丝粒体。其中双着丝粒体的计数包括了产生2、3、4个着丝粒的染色体, 而无着丝粒的短片由于其不稳定性, 一般不作为染色体辐射损伤的指示物, 因此在本文不做分析。
|
|
表 1 氚水诱发人体外周血淋巴细胞染色体畸变的几种非稳定畸变体型的统计结果 |
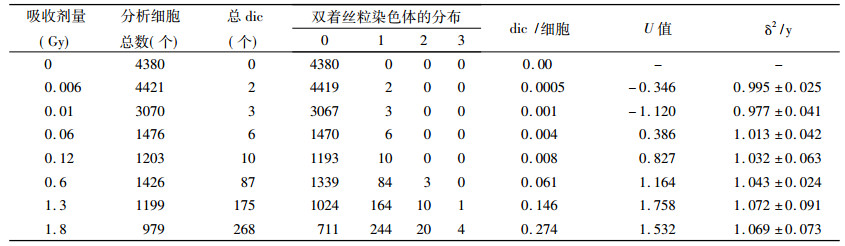
从表 2可知, 在剂量率一定时, 随吸收剂量增加, 各剂量点的dic/cell增加。将表 2中着丝粒的个数在细胞中的分布进行分析, 可通过泊松分布u检验来判断低活度氚水均匀照射是否符合泊松分布。已知当均匀照射时, 满足|u| < 1.96, 方差与均值之比约为1.00, dic在细胞间符合泊松分布。实验中氚水在不同照射剂量下计算泊松分布u检验的结果可知, 低剂量HTO均匀照射诱发的dic在细胞间的分布符合泊松分布。
|
|
表 2 氚水诱发人体外周血淋巴细胞产生双着丝粒染色体在细胞内的分布 |
根据表 1、表 2拟合回归方程得到HTO β射线诱发人体外周血淋巴细胞染色体畸变的拟合结果列于表 3。分析表 3可知, 3号方程自发率c项为负值, 不符合实际情况, 不能采用; 4号方程c项高于自发率(每细胞dic+r自发率为0.05%), 不能采用; 不同的实验室关于人体外周血淋巴细胞与HTO作用后的剂量效应回归方程结果都有所差异, 这主要与实验操作、细胞作用时间、细胞毒性分析以及数据处理过程有关。Bocian等[9]认为, 当HTO β射线剂量率在2.4~21.3 mGy·min-1时, 与外周血淋巴细胞作用2 h得到线性平方剂量效应方程; 而与剂量率更高的HTO作用后Y =aDn (n=1.45)将更合适, 而在长时间低剂量率的作用条件下(作用时间53 h, 剂量率0.09~0.80 mGy·min-1), 染色体畸变更符合线性方程。Pross等[10]实验则得到在HTO β射线剂量率为0.07~1.0 mGy·min-1与细胞反应24 h, 剂量变化范围在0.1~ 4.1 Gy时, 染色体畸变频率符合线性平方方程。综上所述, 尽管不同研究者所得的染色体畸变剂量效应方程不尽相同, 但都认为染色体畸变频率与HTO剂量以及剂量率都有关系。而针对本实验低剂量长时间的作用下, 综合考虑方程拟合度以及运算的方便, 确定HTO β射线的最佳回归方程为1号方程Y=0.001 +0.062D+0.053D2(r2=0.995, P < 0.01)。
|
|
表 3 HTO诱发人体外周血淋巴细胞染色体畸变的拟合结果 |
不同种类射线的RBE值的大小由多种因素共同决定, 其中射线的剂量、剂量率、线性能量损失是物理方面的主要因素; 而对辐射的敏感程度以及受照后的再生补偿能力是生物方面的因素。通常情况下, 作为一种近似值, 也可以用传能线密度(LET)值之比来表示不同类型电离辐射的相对生物效应(RBE)。这是因为, LET值越大, 表示该辐射在受照组织中的能量越集中, 其诱发的生物效应也就越高。但由于辐射与物质的相互作用机理复杂多变而同时又与人体生命过程相结合, 因此电离辐射的生物效应不仅与辐照的物理条件相关, 还取决于受辐照体系被观察的生物效应终点、生物种系和剂量效应曲线形状等, 因此研究RBE更有利于揭示能量沉积于生物效能之间的关系。
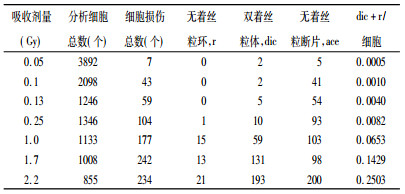
估算低剂量氚水作用下β射线的生物效能, 用60Co γ射线诱发产生相同染色体dic+r畸变频率的剂量作为基准。实验中HTO的剂量率为0.024~ 1.230 mGy·min-1, 剂量范围是0~1.8 Gy; 作为基准的60Co γ射线的剂量率为14.4 mGy·min-1, 剂量范围是0~2.2 Gy, γ射线照射离体人血诱发的无着丝粒、双着丝粒和环畸变的情况如表 4所示。
|
|
表 4 60Co γ射线诱发人体外周血淋巴细胞染色体畸变的几种非稳定畸变体型的统计结果 |
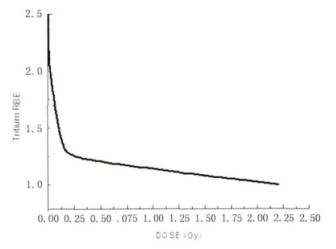
通过表 4得到γ射线的最佳回归方程为Y= 0.001+0.013D+0.045 D2(r2=0.996, P < 0.01)。HTO的β射线诱发双着丝点体和环的效应与其它低LET辐射一样, 适用于Y=aD+bD2的模式。对比β和γ射线最佳回归方程的系数可知, 两者的主要区别在于a项, 而a项的结果与剂量率无关, 与不同辐照类型射线的LET值相关。通过对比β和γ射线的系数比值λ(a/b)可知, 在低剂量范围内, HTO β射线aD项对染色体畸变产额增加的的影响比60Co γ射线大, RBE值大; 随着剂量的增加bD2对染色体畸变产额增加的影响逐渐升高, 而aD项的影响逐渐降低; 当剂量增至一定程度时aD项可忽略不计。因此, 可通过公式(3)得到低活度氚水的RBE值, 氚水剂量与生物效能的关系如图 1所示。
|
图 1 HTO β射线的RBE值与剂量的关系 |
由图 2可知, 与γ射线相比, 在所研究的低剂量范围内, HTO β射线对生物体的作用更加明显。从图 1可以看出, 在本研究的低剂量范围内, HTO相对于γ射线所得的生物效能的最大值为2.17出现在氚水剂量很小的0.06 Gy; 而随着HTO剂量增大, RBE值缓慢下降, 最终在HTO剂量为1~2 Gy的范围内趋于稳定, 其值为1.29。
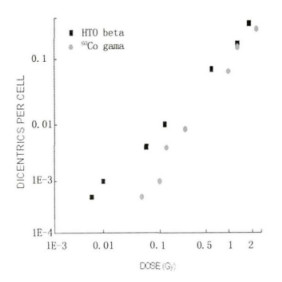
|
图 2 淋巴细胞受HTO和γ射线作用后平均每个细胞畸变率与剂量的关系 |
通过以上实验结果可知, 在低剂量辐照作用下, β射线诱发染色体畸变的能力比同剂量的γ射线强, 提示HTO具有一定的遗传毒性。考虑到DNA链断裂后如产生错误修复会导致人体不同水平的突变, 包括基因突变、细胞染色体畸变、生物体某一中间代谢发生障碍等。因此, 仅从人体外周血淋巴细胞染色体畸变效应来研究HTO导致的遗传效应是不足的, 需要采用其它生物终点更全面的探讨HTO诱发的遗传效应机理, 重视氚的辐射防护。
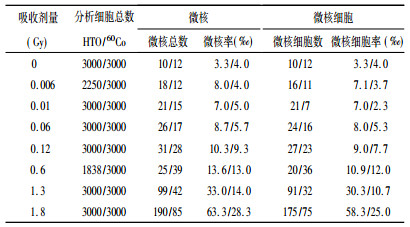
3.3 HTO β射线和60Co γ射线照射离体人体外周血淋巴细胞微核分析图 3所示为CB微核法涂片辐照后双核CB细胞中的微核, 可以看到, 微核呈圆形或椭圆形, 核边缘光滑, 包浆完整, 直径是主核的1/16~1/3, 与主核嗜色性一致, 独立于主核存在。表 5为经过HTO β射线和60Co γ射线照射离体人体外周血淋巴细胞的微核率和微核细胞率。
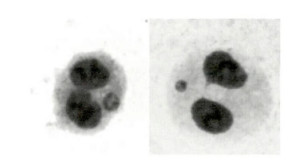
|
图 3 HTO β射线诱发人体外周血淋巴细胞双核微核 |
|
|
表 5 HTO β射线和60Co γ射线诱发细胞微核率 |
通过表 5对HTO和60Co诱发染色体产生微核进行剂量-效应的曲线拟合。拟合结果如图 4所示, 表明在0~1.8Gy的剂量范围内, HTO和60Co射线照射诱发微核的剂量-效应关系符合线性回归方程Y=C +αD。其中Y表示与剂量D相关的细胞微核发生率, α为线性回归方程系数。HTO的最佳回归方程为Y =(3.44 ± 3.36)+(31.78 ± 3.95) D, r2=0.941, P < 0.01, 60Co的最佳回归方程为Y=(5.50 ± 0.91)+ (12.72 ± 1.06)D, r2=0.973, P < 0.01。结合以上方程, 以微核率为生物终点得到60Co γ射线对HTO β射线诱发微核的RBE值在1.46~2.17之间, 如表 6所示, 可知在低剂量辐射照射的RBE值变化较大。
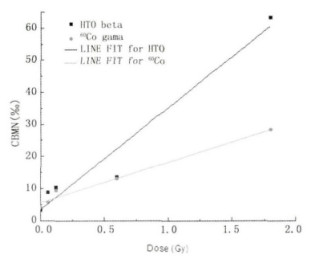
|
图 4 HTO β射线和60Co γ射线诱发细胞微核的剂量效益曲线 |
|
|
表 6 HTO β射线和60Co γ射线诱发人体外周血淋巴细胞微核的RBE值 |
实验HTO的剂量率为0.024~1.230 mGy · min-1, 剂量范围是0~1.8 Gy, 分别用四种不同的回归方程进行拟合, 最终实验结果符合线性平方模型Y =c+aD+bD2, 为Y=0.001+0.047D+0.056D2, r2= 0.994, P < 0.01。该模型的含义是一个双着丝粒体畸的形成需要DNA的二次断裂, 而二次断裂是分别位于两个染色单体上。与HTO β射线的λ(a/b)值1.17 Gy相比γ射线为0.29 Gy、X射线为0.42 Gy[11], 这主要是由于β射线LET值不同造成的, 提示β粒子通过一个电离径迹导致两个染色单体分别发生断裂的效率要高于γ、X射线。
通过实验可知, HTO的β射线剂量效应关系呈曲线, 随剂量的增加RBE减少而后趋于稳定。产生这种现象可能的原因有以下几个方面:首先, HTO不同于γ射线, 它可以进入细胞内从而参与DNA分子结构的构建。而HTO衰变时除了β射线辐射作用外, 3H衰变产生的核转变作用, 会在衰变地址留下一个具有3He原子的分子。依赖于3He原子所在分子及其在分子中的具体位置, 畸变可能比β粒子的电离辐射更加危险[12], 主要是由于3He原子替代3H产生的畸变终点不易被DNA分子原有的损伤修复机制发觉, 使此类损伤在DNA结构中不断积累, 最终导致基因片段的丢失。这种转化后它所产生的DNA双链断裂约占1/8[13]。其次, 在高剂量的情况下, 不同射线电离径迹在单位细胞中的能量沉积区别不大, 而在低剂量的情况下, 不同种类射线电离径迹在细胞内的能量沉积区别明显; 最后, 与HTO在低剂量长时间作用下导致淋巴细胞畸变效率更高的最主要原因是氚特殊生物作用机制。已知氚β粒子射程很短, 但在β粒子的作用范围内, 氚β粒子的平均电离密度为4.7 keV/μm, 远远大于200 keV的X射线(1.7 keV/μm)和60Co γ射线(0.22 keV/μm)。因此, 随着氚在细胞核中的积累导致可产生生物效应的剂量增加, 作用增强。
实验用0~1.8 Gy的HTO和60Co γ射线作用于人体外周血, 检测诱导人体外周血淋巴细胞微核的形成情况, 在此基础上建立了不同能量辐射和不同类型的剂量-效应曲线。表明在0~1.8 Gy的剂量范围内, 淋巴细胞微核率与受照剂量呈正相关(P < 0.01), 与之前大剂量照射的研究结果一致[14-17]。以CB微核率为终点所得的RBE值与染色体畸变所得值一致, 符合IAEA的结论[18]。而微核作为一种辐射生物剂量估算方法, 比染色体畸变研究更加快速、简便、经济, 可被用于检测染色体损伤的快速初筛实验方法, 适用于事故或应急情况下大量人员的快速剂量估算[19-20]。
| [1] |
Filer Crist N.. Tritium labelled photoaffinity agents[J]. Radioanal Nucl Chem, 2009, 281: 521-530. DOI:10.1007/s10967-009-0023-9 |
| [2] |
Lassaad Dassi. Use of chloride mass balance and tritium data for estimation of groundwater recharge and renewal rata in an unconfined aquifer from North Africa:case study from Tunisia[J]. Environ Earth, 2010, 60: 861-871. DOI:10.1007/s12665-009-0223-1 |
| [3] |
IAEA.International Basic Safety Standards for Protection against Ionizing Radiation and for the Safety of Radiation Sources IAEA Safety[S].Series No.115.IAEA, Vienna: 1996.
|
| [4] |
D Galeriu, A Melintescu, H Takeda.Risk from tritium exposure[C]//IRPA, Regional Congress for Central and Eastern Europe, 2007, 9: 24-28.
|
| [5] |
Fenech M. The lymphocyte cytokinesis-block micronucleus cytomeassay and its application in radiation biodosimetry[J]. Health Phys, 2010, 26(1): 11-17. |
| [6] |
Samavat H, Mozdarani H. Chromosomal abrrations in Iranian radiation workers due to chronic exposure of X-irradiation[J]. Int J Low Radiat, 2004, 1(2): 216-222. DOI:10.1504/IJLR.2004.003873 |
| [7] |
Fenech M. Cytokinesis-block micronucleus cytome assay[J]. Nat Protoc, 2007, 2(5): 1084-1104. DOI:10.1038/nprot.2007.77 |
| [8] |
Thomas P, Fenech M. Cytokinesis-block micronucleus cytome assay in lymphocytes[J]. Methods Mol Biol, 2011, 682: 217-234. DOI:10.1007/978-1-60327-409-8 |
| [9] |
Bocian E., Ziemb_Zak B., Rosiek O., et al. The use of nitroaromatic compounds as hypoxic cell radiosensitizors[J]. Current Topics in Radiation Research Quarterly, 1977, 8(11): 347-398. |
| [10] |
Prosser JS, Lloyd DC, Edwards AA, et al. Biological dosimetry in radiological protection:recent developments[J]. Journal of the Society for Radiological Protection, 1984, 4(1): 21. |
| [11] |
Sreedevi B, Shankaanaayanan N, Rao BS. The induction of micronuclei and chromosomal aberrations in human lymphocytes irradiated in vitro with fission neutrons[J]. Radiation Protection and Environment, 1997, 20(1): 21-25. |
| [12] |
Balonov, M. I., Likhtarev, I. A., Moskalev, Yu I.. The Metabolism of 3H Compounds and Limits for Intakes by Workers[J]. Health Physics, 1984, 47(5): 761. DOI:10.1097/00004032-198411000-00008 |
| [13] |
Svensson H, Hanson G.P, Zsdanzky K. The IAEA/WHO TL dosimetry service for radiotherapy centres 1969-87[J]. Acta Oncologica, 1990, 29(4): 461-467. DOI:10.3109/02841869009090030 |
| [14] |
Satow Y, Hori H, Lee J-Y. Teratogenic effect of fission neutron and tritium water on rat embryo[J]. J UOEH, 1989, 11: 416-431. |
| [15] |
Revina VS, Voronin VS, Lemberg VK, Sukhodoev VV. Comparative evaluation of the tumorigenic effect of chronic exposure to tritium oxide and external γ-radiation[J]. Radiobiologiia, 1984, 24: 697-700. |
| [16] |
Chopra C, Heddle JA.Cytogenetic measurements of therelative biological effectiveness of tritium[R].Ottowa: Atomic Energy Control Board, 1988.
|
| [17] |
Vulpis N. The induction of chromosome aberrations in human lymphocytes by in vitro irradiation with β particles from tritiated water[J]. Radiat Res, 1984, 97: 511-518. DOI:10.2307/3576141 |
| [18] |
IAEA.The radiological accident in Istanbull[R].IAEA, Vienna: 2000.
|
| [19] |
Schreiber GA. Automated flow cytometric micronucleus assay for human lymphocytes[J]. Int J Radiat Biol, 1992, 62: 695-709. DOI:10.1080/09553009214552651 |
| [20] |
Tates AD, Van Welie MJ, Ploen JS. Present status of automated micronucleus assay in binucleated lymphocytes[J]. Int J Radiat Biol, 1990, 58: 813-825. DOI:10.1080/09553009014552191 |