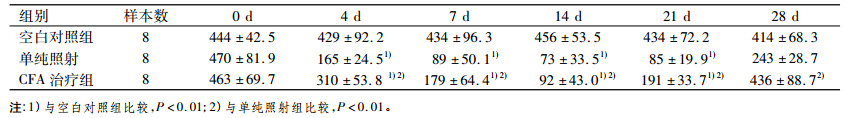放射治疗是治疗恶性肿瘤的重要手段之一, 射线在杀伤肿瘤细胞的同时, 也伴随着正常组织细胞不同程度的损伤, 尤其对由增殖更新迅速的细胞构成的组织损伤更为严重[1], 因此对辐射防护剂的需求逐渐增加。国内外已发现多种辐射防护剂, 但能满足安全低毒、高效、价廉、储存和使用方便者并不多, 因此开发新型辐射防护剂成为放射防护医学领域研究的热点。咖啡酸(caffeic acid, CFA)具有升高白细胞及血小板、止血、抗氧化、抗炎等药理作用[2], 临床常用于白细胞及血小板减少症以及各种出血的防治, 目前尚未见CFA用于辐射防护的报告。本研究以X射线照射小鼠为模型, 旨在观察CFA对辐射损伤小鼠造血恢复的影响, 探讨CFA作为辐射防护剂可能。
1 材料与方法 1.1 材料 1.1.1 药物咖啡酸原药, 山东德州德药制药有限公司生产, 淡黄色, 粉末状, 无臭, 味微酸, 水溶液呈酸性反应, 批号110301。
1.1.2 实验动物12~16周龄的SPF级近交系BALB/c小鼠42只, 雌雄各半, 体重25~29 g, 购自山东大学实验动物中心, 合格证号:20090001。
1.1.3 主要仪器X射线直线加速器, 美国Rad Source Technologies公司RS2000PRO型; 全自动血细胞分析仪器仪, 深圳市普康电子有限公司PE-6800VET型。
1.2 方法 1.2.1 实验分组及给药方法SPF级近交系BALB/c小鼠随机分为3组:空白对照组, 单纯照射组, CFA组。CFA组:照射当天开始咖啡酸100 mg/kg·d灌胃, 每天1次, 一次灌0.1 ml/10 g, 连续灌胃至照射后28 d; CFA灌胃液配制:因CFA不溶于水, 置于水中有较多沉淀, 故将CFA原药溶解于0.5%羧甲基纤维素钠中制备成浓度10 mg/ml的混悬液, 临用前新鲜配制。单纯照射组:照射后当天开始等量0.5%羧甲基纤维素钠灌胃。空白对照组:不照射, 仅给予等量0.5%羧甲基纤维素钠灌胃。
1.2.2 照射方法受试小鼠接受X射线直线加速器一次性全身照射, 吸收剂量率1.21 Gy/min, 照射时间为223 s, 照射剂量为4.5 Gy。空白对照组设置类似环境, 但不照射。
1.3 观察指标 1.3.1 一般情况及存活率每日观察各组小鼠毛发、精神、活动度、饮食饮水量, 每周测体重; 观察各组小鼠30天内存活情况, 记录每日小鼠死亡数, 计算观察30天存活率、平均存活天数。
1.3.2 外周血象检测于照射当天, 照后第4天、7天、14天、21天、28天眼球后静脉丛取血20 μl, 用全自动血细胞分析仪动态监测白细胞、血红蛋白和血小板的变化。
1.3.3 骨髓有核细胞数(bone marrow nucleated cells, BMNC)测定照射后第14天脱颈处死小鼠, 无菌条件下迅速取左侧完整股骨, 去除肌肉及血液, 剪开股骨两端, 用6号针头以5 ml不含血清的DMEM培养液冲出全部骨髓, 4号针头过滤, 3%乙酸液混合充分, 制成单细胞悬液备用, 晾干、吉姆萨染色, 倒置显微镜下计数BMNC。
1.3.4 骨髓造血祖细胞的体外培养及计数骨髓粒细胞巨噬细胞集落形成单位(granulocyte-macrophage colony-forming unit, CFU-GM)体外培养及计数[3]:将单个核细胞悬液, 调整浓度为2 × 105/ml骨髓细胞接种于6孔板中, 每孔0.5 ml, 于37℃、5% CO2, 饱和湿度环境下培养。培养体系包括20%胎牛血清, 50 ng/ml GM-CSF, 琼脂终浓度为0.3%, 甲基纤维素终浓度为0.9%~1.0%, 其余用RPMI-1640补齐。培养14 d观察并计数集落。
骨髓巨核细胞形成单位(colony-forming unit of megakaryocyte, CFU-MK)培养及计数[4]:将单个核细胞数调至2 × 105/ml置于含35 mm培养液的培养皿中, 其中含0.3%琼脂, 0.02 mg·ml-1天冬酰胺, 0.15 mg·ml-1谷氨酰胺, 1 × 104mmol·L-1 2-巯基乙醇, 20%的胎牛血清, 1%小牛血清白蛋白, 重组人促血小板生成素100 ng·ml-1、肝素5 U·ml-1和适量的DMEM培养液。37℃, 5% CO2条件下培养14 d, 用滤纸吸干培养皿中的培养基, 1%多聚甲醛固定, PBS洗, 乙酰胆碱酯酶染色, 计数集落。
1.3.5 脾集落形成单位(colony formation units of spleen, CFU-S)、脾脏指数(spleen index, SI)测定CFU-S测定[5]:照射后14 d摘除眼球取血后脱颈处死小鼠, 于无菌条件下迅速摘除脾脏置入Bouins液固定24 h, 在解剖镜下观察CFU-S, 并计数。
SI测定:在照后第14天脱颈处死小鼠, 用电子分析天平称量小鼠体重, 迅速摘取脾脏并称重, 计算SI。计算公式为:SI=脾脏重量(mg)/体重(g)。
1.4 统计学分析采用SAS 8.1统计软件处理数据, 各数据用均数±标准差(x ± s)表示。血细胞计数不同时相点和组间差异的整体比较采用重复测量设计的方差分析, 同一时相点的组间比较采用单因素方差分析, 并采用SNK法进行两两比较, 检验水准α=0.05, P < 0.05认为差异有统计学意义。
2 结果 2.1 一般情况及存活率 2.1.1 一般情况与空白对照组相比, 两受照组小鼠照射后4 d均逐渐出现活动减少, 蜷缩, 懒动, 饮食水减少, 精神不振, 毛发失去光泽, 耳廓、尾部皮肤苍白, 温度低, 体重下降, 其中以单纯照射组体重下降明显; 21 d后存活小鼠一般情况逐渐好转, 体重开始增长, CFA组小鼠体重增长较快, 至实验结束时单纯照射组体重最低, 与CFA组相比差异有统计学意义(P < 0.01), 见表 1。
|
|
表 1 各组小鼠体重变化表(x ± s, g) |
空白对照组小鼠未发生死亡, 存活率100%, 平均存活天数30 d; 单纯照射组于9 d死亡1只小鼠, 15 d死亡2只小鼠, 存活率62.5%, 平均存活23.63 d; CFA组于12 d死亡1只小鼠, 存活率87.5%, 平均存活27.75 d, 单纯照射组和CFA治疗组比较, 差异有统计学意义(P < 0.05)。
2.2 CFA对辐射后小鼠血细胞的影响 2.2.1 各组小鼠辐射后WBC变化从表 2可看出各组小鼠在照射前WBC无统计学差异(P > 0.05), 照射后单纯照射组、CFA组4 d WBC数即出现明显下降, 与空白对照组比较有明显统计学差异(P < 0.01), 且较照射前下降超过1/3, 表明骨髓型ARD模型制作成功, 其中单纯照射组较CFA组下降更明显, 差异有统计学意义(P < 0.01);7 d WBC进一步下降, 14 d单纯照射组和CFA组WBC达最低点; 21 d两受照组小鼠WBC开始恢复, CFA组较单纯照射组明显升高, 差异有明显统计学意义(P < 0.01);28 d CFA组WBC进一步升高, 但仍未恢复正常, 与单纯照射组相比升高更明显, 差异有统计学意义(P < 0.01)。
|
|
表 2 各组小鼠辐射后WBC变化(x ± s, × 109/L) |
从表 3可看出各组小鼠在照前HGB无统计学差异(P > 0.05), 照射后4 d单纯照射组及CFA组HGB明显下降, 与空白对照组比较有明显统计学差异(P < 0.01);单纯照射组、CFA组7 d HGB进一步下降, 于14 d达最低点, 此时CFA组HGB明显高于单纯照射组(P < 0.01);21 d两受照组小鼠HGB开始恢复, CFA组明显高于单纯照射组, 差异有明显统计学意义(P < 0.01);28 d CFA组HGB恢复正常, 与空白对照组比较无统计学差异(P > 0.05), 与单纯照射组相比差异有明显统计学意义(P < 0.01)。
|
|
表 3 各组小鼠辐射后HGB变化(x ± s, × 109/L) |
从表 4可看出各组小鼠在照前PLT差异无统计学意义(P > 0.05), 照射后4 d两受照组PLT明显下降, 与空白对照组比较差异有明显统计学意义(P < 0.01);7 d PLT进一步下降, 14 d两受照组PLT均达最低点, 此时CFA组PLT明显高于单纯照射组(P < 0.01);21 d两受照组小鼠PLT开始恢复, 此时CFA组PLT恢复正常, 明显高于单纯照射组(P < 0.01);28 d两受照组PLT基本恢复正常, CFA组PLT数与空白对照组比较无统计学差异(P > 0.05), 而与单纯照射组相比差异有统计学意义(P < 0.01)。
|
|
表 4 各组小鼠辐射后PLT变化(x ± s, × 109/L) |
CFA组小鼠14天骨髓BMNC、CFU-GM、CFU-MK数量、CFU-S和SI明显增加, 与单纯照射组相比差异有统计学意义(P < 0.01), 见表 5。
|
|
表 5 CFA对辐射后14 d小鼠BMNC、CFU-GM、CFU-MK、CFU-S、SI的影响(x ± s) |
CFA化学名称3-(3, 4-二羟苯基)-丙烯酸, 广泛存在于西红柿、草莓、胡萝卜、咖啡谷类等多种可食性植物及中草药如小蓟中。文献表明CFA可以促进化疗相关性骨髓抑制的恢复, 提升白细胞和胸腺指数, 改善毛细血管通透性, 减少感染和出血[6]。CFA还可通过刺激巨核细胞成熟和刺激粒细胞增殖、分化、成熟、释放而提升血小板[7]。
造血系统更新活跃, 对辐射高度敏感, 辐射损伤后主要表现为不同程度的造血功能障碍[8], 出现外周血白细胞、血小板和红细胞先后明显下降, 易致感染和出血, 体重下降, 甚至死亡。如何使造血功能得到保护和恢复是改善预后的关键因素。本实验采用1.21 Gy/min剂量率、4.5 Gy吸收剂量建立辐射损伤模型, 照射后小鼠的白细胞、血红蛋白、血小板计数显著下降, CFA组白细胞、血红蛋白、血小板计数较单纯照射组恢复快, 提示CFA对辐射损伤小鼠造血恢复有促进作用; 骨髓造血干细胞是辐射损伤的主要靶细胞, 实验观察到单纯照射组小鼠第14天骨髓BMNC、CFU-GM、CFU-MK数量明显减低, 而CFA组明显增加, 提示CFA能提高造血干细胞数量, 也保护了其集落形成能力, 这说明CFA对辐射损伤小鼠造血干细胞损伤有较好保护作用, 对骨髓细胞增殖有明显促进作用, 为造血系统的重建提供了保障。
脾脏是机体重要的造血器官, 对射线也高度敏感, 当脾脏受到辐射后, 脾脏体积迅速缩小, 重量减轻, 造血功能下降。SI越大, 表明脾脏的大小、重量下降越少, 造血功能越强。辐射损伤后, 残存的具有增殖分裂能的造血干细胞会迁移至脾脏进行代偿性增殖, 使脾内出现许多小结节状造血灶, 称为CFU-S。CFU-S计数是测定造血干细胞的经典手段, 脾结节的多少反映了残存造血干细胞的多寡。实验结果显示单纯照射组小鼠第14天CFU-S、SI明显减低, 而CFA组明显增加, 提示CFA对造血干细胞增殖有明显促进作用。以上结果表明, CFA对外周血象的保护作用可能是通过促进骨髓造血干细胞分化、增殖而实现的。
本实验还观察到CFA组小鼠体重、30天存活率和平均存活天数也明显提高, 表明CFA能保护辐射小鼠, 减轻辐射损伤。辐射诱导产生大量自由基导致DNA损伤的氧自由基学说被国内外学者认为是辐射损伤的主要理论基础[9]。CFA属于有机酸中的酚酸类物质, 具有羟基苯丙烯酸结构, 不仅能够提供氢原子, 还具有芳环羟化作用, 有较强的还原性, 能够清除超氧化物阴离子, 并与金属离子螯合, 发挥抗氧化作用, 早期研究表明文献报告CFA是天然生成的而又安全的自由基清除剂、能从抑制脂质过氧化, 保护生物膜磷脂不受氧化损伤, 从而维持细胞正常功能[10]。由此推测CFA对辐射损伤的保护作用机制可能与其抗氧化作用有关。
综上可看出, CFA有望作为辐射损伤的有效防护剂, 有关CFA对辐射损伤保护的最佳剂量、应用的最佳时机以及作用机制尚需进一步研究。
| [1] |
Brown KR, Rzucidlo E. Acute and chronic radiation injury[J]. J Vasc surg, 2011, 53(1, suppl): 15S-21S. DOI:10.1016/j.jvs.2010.06.175 |
| [2] |
Prasad NR, Jeyanthimala K, Ramachandran S. Caffeic acid modulates ultraviolet radiation-B induced oxidative damage in human blood lymphocytes[J]. J Photochem Photobiol B, 2009, 95(3): 196-203. |
| [3] |
郭朝华, 孔佩艳, 邹仲敏, 等. E838对IRM-2和ICR小鼠的辐射防护作用[J]. 第三军医大学学报, 2001, 23(5): 544-546. DOI:10.3321/j.issn:1000-5404.2001.05.017 |
| [4] |
Sharma S, Haldar C. Melatonin prevents X-ray irradiation induced oxidative damage in peripheral blood and spleen of the seasonally breeding rodent, Funambulus pennanti during repro-ductively active phase[J]. Int J Radiat Biol, 2006, 82: 411-419. DOI:10.1080/09553000600774105 |
| [5] |
Nunia V, Goyal PK. Prevention of gamma radiation induced anaemia in mice by diltiazem[J]. J Radiat Res, 2004, 45(1): 11-17. DOI:10.1269/jrr.45.11 |
| [6] |
祝晓玲, 陆阳, 李成文, 等. 咖啡酸对化疗后骨髓抑制合并肺组织急性损伤小鼠毛细血管通透性及免疫功能的影响[J]. 中药药理与临床, 2013, 29(1): 23-25. |
| [7] |
Zhang Q, Hu Z, Wang F, et al. Preventive and therapeutical effects of caffeic acid on leucopenia and thrombocytopenia and MPV change induced by cytosine arabinoside in mice[J]. Chin J Clin Pharmacol Ther, 2008, 13(5): 508-511. |
| [8] |
Povinelli B, Kokolus KM, Curtin L, et al. The influence of metabolic stress on radiosensitivity of hematopoietic stem and progenitor cells[J]. Blood, 2013, 122(21): 2447. |
| [9] |
王崇道, 强亦忠. 电离辐射所致自由基对机体的损伤与自由基清除剂的研究[J]. 中华放射医学与防护杂志, 2002, 6(22): 461-463. |
| [10] |
Gulcin I. Antioxidant activity of caffeic acid (3, 4-dihydroxy- cinnamic acid)[J]. Toxicology, 2006, 217(2-3): 213-220. DOI:10.1016/j.tox.2005.09.011 |