低剂量辐射诱导适应性反应是指低剂量辐射(Low dose radiation, LDR)预先处理使机体对随后的高剂量照射(High dose radiation, HDR)产生适应性反应, 从而减轻HDR引起的损伤作用。Olivieri[1]等用人外周血淋巴细胞与低剂量3H-胸腺嘧啶核苷(3H- TdR)共培养, 再使其接受较高剂量X射线照射, 结果发现经过3H-TdR预处理, 再接受较高剂量X射线照射的人外周血淋巴细胞的染色体畸变率明显低于单独接受较高剂量X射线照射的人外周血淋巴细胞, 说明低剂量3H-TdR可以诱导人外周血淋巴细胞的适应性反应。放射性核素131I广泛应用于医疗行业, 大量实验证明高剂量131I对机体有明显的损伤作用, 但是低剂量131I对机体的作用, 尤其是低剂量131I诱导的适应性反应报道甚少。本实验利用琼脂糖凝胶电泳和凝胶成像后灰度值分析的方法观察低剂量和较高剂量及其两种组合剂量的131I对小鼠胸腺细胞DNA的损伤差异, 探讨低剂量131I内照射诱导小鼠胸腺细胞DNA损伤的适应性反应, 为阐明低剂量辐射诱导适应性反应机制提供有价值的实验资料。
1 材料与方法 1.1 实验动物选用雄性4~6周龄昆明小鼠65只, 体重(20 ± 2) g, SPF级, 由南方医科大学实验动物研究中心提供。动物合格证编号:44005900000827。
1.2 实验试剂和仪器碘[131I]化钠溶液由成都中核高通同位素股份有限公司提供, 产品批号为2013-10 -30;DNA提取试剂盒及DNA Mark购于天艮公司; TRIS、硼酸、EDTA-Na2为Solarbio公司产品; Ultra PowerTM核酸染料为百泰克生物技术有限公司产品。DYY-6C型电泳仪和WD-9403C型紫外仪购于北京六一厂; ND-1000型核酸蛋白含量检测仪为NanoDrop科技有限责任公司产品; ChemiDocTM XRS+型成像仪购于美国伯乐公司。
1.3 动物处理及DNA检测① 将小鼠随机分为A、B、C、D四组, 每组5只。A为空白对照组, 未进行任何处理; B、C、D组小鼠分别腹腔注射104 Bq/g、105 Bq/g、106 Bq/g的131I。②将小鼠随机分成E、F、G、H、I五组, 每组5只小鼠。E组小鼠预先给予生理盐水腹腔注射; F、G、H为实验组, 小鼠预先分别腹腔注射10 Bq/g、102 Bq/g、103 Bq/g的131I, 12 h后E、F、G、H各组小鼠再给予106 Bq/g的131I腹腔注射; I为空白对照组, 小鼠未进行任何处理。③将小鼠随机分为J、K、L、N四组。J为空白对照组, 小鼠未进行任何处理; K、L组小鼠分别腹腔注射102 Bq/g、106 Bq/g的131I; N组小鼠为预先注射102 Bq/g的131I, 12 h后再注射106 Bq/g的131I。以上实验每次给予小鼠的131I是0.5 ml不同浓度的碘[131I]化钠溶液, 给予小鼠生理盐水的容量同样是0.5 ml。各组在最后一次给予131I 12 h后颈椎脱臼法处死小鼠, 未给予131I的小鼠也在此时处死。所有处死的小鼠取出胸腺, 研磨成细胞悬液, 然后用DNA提取试剂盒提取小鼠胸腺DNA。调整DNA浓度, 各组取等量DNA进行琼脂糖凝胶电泳, 电压110 V, 电泳时间为45 min。
1.4 结果分析凝胶电泳成像后对各组标本电泳成像结果梯形末端条带用Quantity One软件中的灰度分析工具进行分析, 然后计算出每组梯形末端条带的平均灰度值。
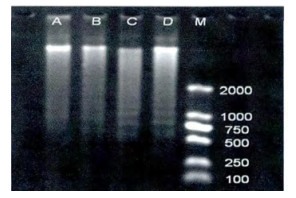
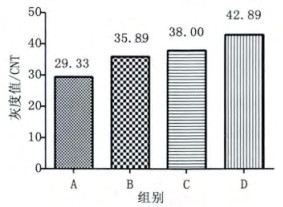
2 实验结果 2.1 不同剂量的131I对小鼠胸腺细胞DNA损伤的影响给予小鼠不同剂量的131I处理, A组未出现琼脂糖凝胶电泳梯形条带, B、C、D组出现梯形条带, 且条带影像随着131I剂量的增加而逐渐清晰(图 1)。B、C、D组梯形末端条带的平均灰度值也随着131I剂量的增加而依次增高(图 2)。
|
图 1 131I对小鼠胸腺细胞DNA损伤的琼脂糖凝胶电泳图像 注:A空白对照组; B 131I 104 Bq/g; C 131I 105 Bq/g; D 131I 106 Bq/g; M DNA Mark D2000 |
|
图 2 131I对小鼠胸腺细胞DNA损伤的电泳梯形末端条带灰度值 注:A空白对照组; B 131I 104 Bq/g; C 131I 105 Bq/g; D131I 106 Bq/g; M DNA Mark D2000 |
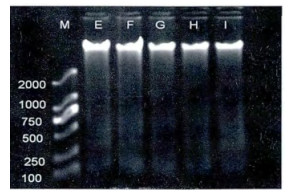
从图 3可以看出, E、F、G、H四组均有琼脂糖凝胶电泳梯形条带出现, F、G、H组梯形条带影像清晰度与E组比明显减弱, F组梯形条带影像清晰度高于G和H组, G和H组的梯形条带影像清晰度相当, I组未见梯形条带; E、F、G、H组末端条带平均灰度值变化与梯形条带图像清晰度基本一致(图 4); 即F、G、H组末端条带平均灰度值与E组比明显降低, F组末端条带平均灰度值高于G和H组, I组末端条带平均灰度值均低于E、F、G、H各组。
|
图 3 131I诱导小鼠胸腺细胞DNA损伤适应性反应的电泳图像 注:E 131I 106 Bq/g; F 131I (10+106) Bq/g; G 131I (102+106) Bq/g; H 131I (103+106) Bq/g; I空白对照组; M DNA Mark D2000 |

|
图 4 131I诱导小鼠胸腺细胞DNA损伤适应性反应的电泳梯形末端条带灰度值 注:E 131I 106 Bq/g; F 131I (10+106) Bq/g; G 131I (102+106) Bq/g; H 131I (103+106) Bq/g; I空白对照组; M DNA Mark D2000 |
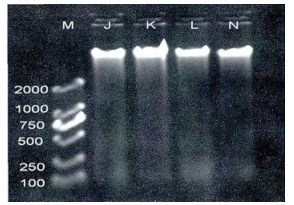
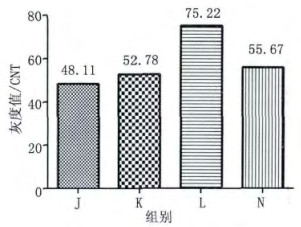
如图 5所示, K、L、N组均有梯形条带出现, K组与L组相比, 随着131I剂量的增加, L组的梯形条带影像清晰度高于K组; L组与N组相比, L组的梯形条带影像清晰度高于N组。J、K、L、N组末端条带平均灰度值变化与梯形条带影像清晰度基本一致(图 6), 即L组末端条带平均灰度值高于K组, N组末端条带平均灰度值明显低于L组。
|
图 5 102Bq/g的131I诱导小鼠胸腺细胞DNA损伤适应性反应的电泳图像 注:J空白对照组; K 131I 102 Bq/g; L 131I 106 Bq/g; N 131I (102+106) Bq/g; M DNA Mark D2000 |
|
图 6 102Bq/g的131I诱导小鼠胸腺细胞DNA损伤适应性反应的电泳梯形末端条带灰度值 注:J空白对照组; K 131I 102 Bq/g; L 131I 106 Bq/g; N 131I (102+106) Bq/g; M DNA Mark D2000 |
在过去的二十多年, LDR引起越来越多研究者的关注, 许多实验证实LDR预处理实验对象后, 其可以产生对随后相对高剂量照射诱发损伤的抗性, 称为LDR诱导的适应性反应[2]。低剂量辐射效应主要包兴奋效应及适应性反应[3-4], 这些效应可以发生在培养细胞、癌细胞和动物模型中, 低剂量辐射能促进细胞的增殖并能减小后续高剂量辐射对机体的损伤[5-7]。本实验是在大量低剂量外照射诱导适应性反应的基础上, 探讨低剂量131I内照射诱导小鼠胸腺细胞DNA损伤的适应性反应。旨在证明被医学领域广泛应用的131I是否可以诱导适应性反应, 并找出131I诱导适应性反应的适宜低剂量和损伤剂量。
本实验结果发现, 正常小鼠胸腺细胞未出现梯形条带, 说明小鼠胸腺细胞DNA完整, 未受到损伤; 给予不同剂量131I组的小鼠胸腺细胞DNA琼脂糖凝胶电泳出现梯形条带, 且条带影像随着131I剂量的增加而逐渐清晰(图 1), 梯形末端条带的平均灰度值也随着131I剂量的增加而依次增高(图 2), 提示小鼠胸腺细胞DNA损伤随着131I剂量的增加而加重。Rombouts等[8]在检测人上皮细胞的DNA双链断裂(DSB)和细胞凋亡时, 发现DNA的DSB数目和细胞凋亡率随着X射线剂量(0.05~0.5 Gy)的增加而升高, 在一定范围内呈现剂量依赖性, 与本实验结果一致, 表明较大剂量的内照射和外照射对实验对象的损伤作用均随着剂量的增加而增大。图 3和图 4显示I组未见琼脂糖凝胶电泳梯形条带, E、F、G、H四组均有琼脂糖凝胶电泳梯形条带出现, 说明I组的正常小鼠胸腺细胞DNA未受损伤, 而E、F、G、H四组小鼠均有胸腺细胞DNA损伤; 而F、G、H组梯形条带影像清晰度和梯形末端条带平均灰度值与E组比明显降低, 说明低剂量的131I (10 Bq/g、102 Bq/g、103 Bq/g)可以诱导抗损伤剂量131I的适应性反应; F组梯形条带影像清晰度和梯形末端条带平均灰度值高于G和H组, G和H组的梯形条带影像清晰度和梯形末端条带平均灰度值相当, 表明102 Bq/g和103 Bq/g的131I诱导适应性反应的效果最佳, 且102 Bq/g和103 Bq/g的131I诱导适应性反应的效果无明显差异, 因为102 Bq/g的剂量小于103 Bq/g, 所以102 Bq/g的131I可以作为最适宜诱导适应性反应的剂量。有文献报导[9], 将昆明小鼠放置于900 MHz的射频场, 每天4 h, 分别持续1、3、5、7天, 然后接受3 Gy的γ射线照射, 通过检测外周血白细胞的DNA断裂, 结果发现射频预处理1天就能够降低由高剂量γ射线引起的DNA损伤。除此之外, 有研究者[10]抽提经131I治疗前后病人的外周血淋巴细胞, 然后用1.0 Gy的60Co γ射线照射, 结果发现经131I治疗后的人外周血淋巴细胞加γ射线照射组所产生的微核率显著低于131I治疗前的人外周血淋巴细胞加γ射线照射组, 说明低剂量131I可以诱导人外周血淋巴细胞抗γ射线损伤的适应性反应, 与本次实验结果相似。由为了进一步证明低剂量的131I诱导适应性反应的现象, 我们在低剂量131I三个剂量(10 Bq/g、102 Bq/g、103 Bq/g)基础上, 选择其中一个最适宜的低剂量131I (102 Bq/g)进行实验设计, 增加102 Bq/g单独作用的效果观察。结果发现102 Bq/g、106 Bq/g和(102+106) Bq/g组均有梯形条带出现, 说明前三种剂量的131I对小鼠胸腺细胞均有损伤作用; 106 Bq/g组的梯形条带影像清晰度和梯形末端条带平均灰度值高于102 Bq/g组; 提示106 Bq/g的131I损伤作用大于102Bq/g的131I; (102+106) Bq/g组的梯形条带影像清晰度和梯形末端条带平均灰度值明显低于106 Bq/g组, 也必然显著低于102 Bq/g和106 Bq/g单独作用的总和, 表明102 Bq/g的131I可以诱导106 Bq/g 131I损伤小鼠胸腺细胞DNA的适应性反应(图 5, 图 6)。有研究者用X射线对小鼠生殖细胞和淋巴细胞进行离体或在体实验[11-12], 发现预先给予低剂量的X射线照射能够降低后续高剂量照射导致的细胞凋亡率, 减小了高剂量辐射对细胞的损伤作用, 说明低剂量X射线预照射能够诱导细胞DNA损伤的适应性反应, 提示低剂量内外照射均可以诱导适应性反应。
有文献表明[13-14], 非同源末端连接(NHEJ)是真核细胞修复DNA双链断裂最主要的途径, DNA-蛋白激酶(DNA-PKcs)在DSB的修复中也发挥重要作用, NHEJ和DNA-PKcs均参与细胞凋亡和抗辐射的调节。本实验结果显示低剂量131I内照射能够诱导小鼠胸腺细胞DNA损伤的适应性反应, 拮抗高剂量的辐射损伤, 推测可能与DNA损伤和修复有关, 也可能有NHEJ和DNA-PKcs的参与, 所以低剂量131I诱导小鼠胸腺细胞DNA损伤的适应性反应机制有待今后进一步深入研究。
| [1] |
Olivieri G, Bodycote J, Woff S. Adaptive response of human lymphocytes to low concentrations of radioactive thymidine[J]. Science, 1984, 223(4636): 594-597. DOI:10.1126/science.6695170 |
| [2] |
Esposito G, Campa A, Pinto M, et al. Adaptive response:modeling and experimental studies[J]. Radiat Prot Dosimetry, 2011, 143(24): 320-324. |
| [3] |
Feinendegen LE. Evidence for beneficial low level radiation effects and radiation hormesis[J]. Br J Radiol, 2005, 78(925): 3-7. DOI:10.1259/bjr/63353075 |
| [4] |
Cai L. Research of the adaptive response induced by low-dose radiation:where have we been and where should we go[J]. Hum Exp Toxicol, 1999, 18(7): 419-425. DOI:10.1191/096032799678840291 |
| [5] |
Joksic G, Petrovic S. Lack of adaptive response of human lymphocytes exposed in vivo to low doses of ionizing radiation[J]. J Environ Pathol Toxicol Oncol, 2004, 23(3): 195-206. DOI:10.1615/JEnvPathToxOncol.v23.i3 |
| [6] |
Scott BR. Low-dose-radiation stimulated natural chemical and biological protection against lung cancer[J]. Dose Response, 2008, 6(3): 299-318. |
| [7] |
Cheng GH, Wlu N, Jiang DF, et a1. Increased levels of p53 and PARP-1 in EL-4 cells probably related with the immune adaptive response induced by low dose ionizing radiation in vitro[J]. Biomed Environ Sci, 2010, 23(6): 487-495. DOI:10.1016/S0895-3988(11)60012-3 |
| [8] |
Rombouts C, Aerts A, Beck M, et al. Differential response to acute low dose radiation in primary and immortalized endothelial cells[J]. Int J Radiat Biol, 2013, 89(10): 841-850. DOI:10.3109/09553002.2013.806831 |
| [9] |
Jiang B, Nie J, Zhou Z, et al. Adaptive response in mice exposed to 900 MHz radiofrequency fields:primary DNA damage[J]. PLoS One, 2012, 7(2): 1-4. |
| [10] |
Myriam A.Monsieurs, Hubert M.Thierens, Anne M.Vral, et al. Adaptive Response in Patients Treated with 131I[J]. Dierckx J Nucl Med, 2000, 41(1): 17-22. |
| [11] |
Liu G, Gong P, Bernstein LR. Apoptotic cell death induced by? low-dose radiation in male germ cells:hormesis and adaptation[J]. Crit Rev Toxicol, 2007, 37(7): 587-605. DOI:10.1080/10408440701493061 |
| [12] |
Hongsheng Yu, Ning Liu, Bo Ju. Low dose radiation induced adaptive response of apoptosis in mouse spleen cells[J]. Chinese-German Journal of Clinical Oncology, 2010, 9(4): 235-238. DOI:10.1007/s10330-010-0004-z |
| [13] |
B.L.Mahaney, K.Meek, S.P.Lees-Miller. Repair of ionizing radiation-induced DNA double-strand breaks by non-homologous end-joining[J]. Biochem.J, 2009, 417(3): 639-650. |
| [14] |
Stefanie Schanz, Nadine Schuler, Yvonne Lorat. Accumulation of DNA damage in complex normal tissues after protracted low-dose radiation[J]. DNA Repair, 2012, 11(10): 823-832. DOI:10.1016/j.dnarep.2012.07.005 |




