2. 济南大学山东省医学科学院医学与生命科学学院;
3. 胶州市铺集镇中心卫生院
2. School of Medicine and Life Sciences, University of Jinan-Shandong Academy of Medical Sciences;
3. Puji Town Center Hospital of Jiaozhou City
氧化应激(Oxidative stress, OS)是机体受到多种因素刺激后, 体内活性氧簇(ROS)产生过多, 抗氧化能力下降, 打破了机体正常氧化还原动态平衡, 造成生物大分子如蛋白质、脂质和核酸等的氧化损伤, 干扰正常生命活动而形成的一种严重的应激状态。ROS是由氧化激发的化学性质十分活泼的分子, 包括氧自由基和非自由基的含氧产物, 前者的外层电子轨道上含有不配对电子, 如O2-、OH等, 后者包括H2O2和HOCL等[1]。ROS和含氮的活性氧簇(RNS)存在于机体的各个组织和器官, 肺组织疾病可以归因于炎性病变过程中产生大量的ROS和RNS[2-6]。肺组织对氧化损伤的易感性或致敏性很大程度上依赖于它对ROS和RNS清除系统的正调节保护能力[7]。机体为了使氧对生物分子的损伤减小到最低程度, 产生了一系列抗氧化系统, 包括酶类和非酶类的抗氧化剂。炎性反应是矽尘接触的早期特征性表现, 在矽肺发生过程中, 是否存在氧化应激反应有待证实。本实验通过大鼠高浓度矽尘接触实验, 检测血清中SOD、CAT、T-AOC活性及MDA、GSH含量, 初步探讨矽尘接触过程是否存在氧化应激反应。
1 材料和方法 1.1 实验动物选取健康的40只SPF级Wistar雄性大鼠, 由山东鲁抗医药股份有限公司质检中心实验动物室提供, 实验动物生产许可证号为SCXK (鲁) 20130001, 大鼠体重为180~200 g。实验动物饲养于SPF屏障动物房, 实验动物房使用许可证号为SYXK (鲁)20120001号。实验室温度为20~24℃, 相对湿度为50%~60%。染尘期间大鼠自由摄食、饮水, 饲料由山东省实验动物中心提供。
1.2 实验材料与试剂受试物游离二氧化硅含量大于97.5%的石英砂, 由天津某化工有限公司提供; 超氧化物歧化酶(SOD)测试盒、丙二醛(MDA)测试盒、过氧化氢酶(CAT)测试盒、总抗氧化能力(T-AOC)测试盒、还原型谷胱甘肽(GSH)测试盒, 均由南京建成生物工程研究所生产。
1.3 主要仪器HOPE-MED 8050全相态动式染毒控制系统(天津开发区合普工贸有限公司产品)、722型可见光分光光度计等。
1.4 实验方法 1.4.1 染毒方式大鼠适应性喂养7天后, 随机分为4组, 每组10只, 分为高剂量染尘组(1000 mg/m3)、中剂量染尘组(500 mg/m3)、低剂量染尘组(100 mg/m3)和对照组(0 mg/m3)。将动物成笼放入动式染毒室内染尘, 每只动物每天染尘2小时; 染尘49天后处死大鼠; 对照组不染尘, 正常喂养49天后处死。各组大鼠在同等条件下饲养, 观察其一般生长状况。
1.4.2 检测指标处死前称体重、肺组织湿重并观察动物的一般状况; 摘眼球采血5ml离心取上清液, 检测血清SOD、T-AOC、TAC活性及MDA、GSH含量; 颈椎脱臼处死动物, 暴露并分离气管、称取肺脏重量, 计算肺组织的脏体比(%); 取右肺做HE染色病理切片。
1.5 统计分析采用SPSS 17.0统计软件进行统计分析, 实验结果以x± s, 各指标比较采用单因素方差分析(ANOVA), 若差异有统计学意义, 则进一步采用SNK检验进行组间两两比较, 以P<0.05为差异具有统计学意义。
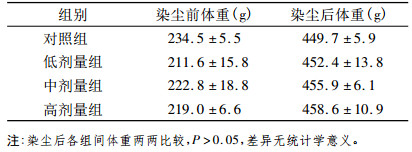
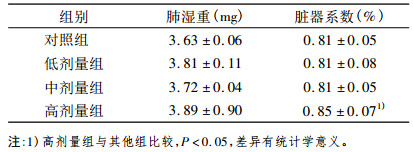
2 结果 2.1 一般情况动物染尘早期各组动物饮水和饮食量未出现明显减少, 对刺激反应敏感, 毛发光亮; 在染尘后期, 高剂量组出现毛发蓬松, 色晦暗情况, 但饮水和饮食量减少不明显, 染尘后高剂量组肺组织脏器比与其他组比较显著升高(P<0.05), 具体结果见表 1、2。
|
|
表 1 矽尘染尘对雄性大鼠体重的影响(x± s) |
|
|
表 2 矽尘染尘对雄性大鼠肺脏重量及脏器系数的影响(x± s) |
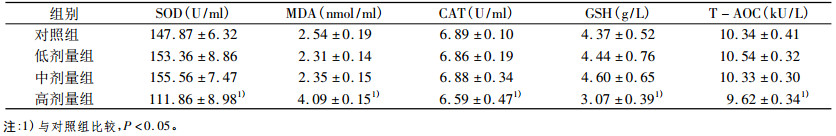
各组大鼠经49天动式染尘后, 摘眼球取血, 离心后测定血清中SOD、CAT、T-AOC活性及MDA、GSH含量, 结果提示:高剂量组氧化指标SOD与CAT、T-AOC活性、GSH含量明显降低, 和其他组比较差异具有统计学意义(P<0.05), 脂质过氧化指标MDA含量显著升高, 和其他组比较差异具有统计学意义(P<0.05), 结果见表 3。
|
|
表 3 矽尘染尘对雄性大鼠血清氧化应激水平的影响(x± s) |
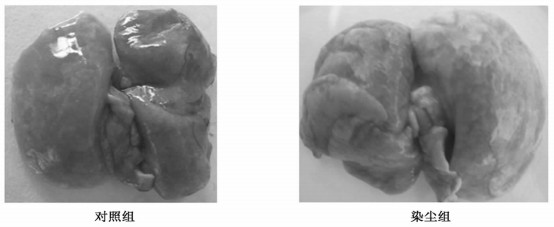
对照组双肺组织呈粉红色或淡粉红色, 质地柔软, 表面光滑; 染尘49天双肺颜色呈暗红色, 肿胀, 片状白斑明显增多(见图 1)。
|
图 1 矽尘染尘对大鼠肺组织的肉眼观察变化 |
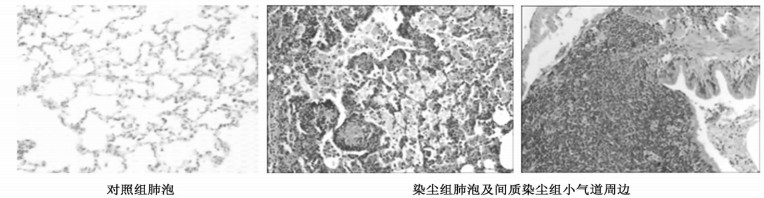
对照组:大鼠肺泡无炎细胞浸润, 无充血水肿, 肺间质无纤维化; 染尘组(HE, × 100)肺泡及局部间质内可见大量尘细胞, 肺泡上皮增生, 肺泡间隔明显增宽, 成纤维细胞及纤维组织增生; 小气道周围淋巴细胞弥漫浸润, 毛细血管扩张、充血、出血明显(见图 2)。
|
图 2 矽尘染尘对大鼠肺组织的病理学变化(HE, × 100) |
自由基对机体的毒作用是通过交联蛋白、脂类、核酸及糖类使生物膜变性、细胞器受损, 最终导致细胞代谢功能障碍, 甚至死亡[8]。在正常生理条件下, 机体内有一套完整的抗氧化系统, 不断清除产生的自由基, 从而维持相对的动态平衡, 当外源性和内源性因素作用于肺组织, 打破此平衡, 肺组织内抗氧化物质不足以对抗自由基引发的组织损伤时, 组织就将发生不可逆的损伤, 自由基的生成增加, 体内SOD、T-AOC及MDA水平随之发生改变[9]。
MDA作为脂质氧化反应的产物, 它的含量反映机体脂质过氧化的速率及强度, 也间接反映机体细胞受自由基攻击损伤的程度。SOD可将自由基变成H2O2, 而CAT将H2O2变成水, SOD和CAT的活性可反映机体氧化应激所处的状态和抗氧化能力的强弱。还原性谷胱甘肽对机体内H2O2起到还原作用, 起到保护细胞膜结构和功能完整的作用, 在多种疾病情况下均出现降低情况[10]。因此, 测定以上氧化-抗氧化相关的酶活性和脂质过氧化指标, 对研究病理情况下是否具有氧化应激具有十分重要的意义[11]。
本次研究采用动式染尘方式, 模拟大鼠自然染尘条件下矽尘接触情况下的氧化应激反应, 结果显示大鼠在高浓度接触矽尘49天后, 血清存在氧化和抗氧化体系的失衡, 表现为氧化相关指标SOD、CAT、T- AOC活力和GSH含量降低, 脂质过氧化指标MDA升高, 与对照组比较, 差异具有统计学意义(P<0.05), 分析原因可能是由于矽尘接触引起的炎症反应, 炎症因子趋化白细胞向肺损伤部位聚集, 释放大量中性粒细胞弹性蛋白酶, 促进氧自由基的产生增多, 从而启动脂质过氧化反应, 本实验染尘组肺组织HE染色出现以炎症反应为主的结果较为一致; 同时, 除高剂量组外, 其他剂量组各个指标比较, 差异无统计学意义(P > 0.05), 分析可能与本次试验采用自然染尘的矽尘吸入量、染尘剂量、动物活动量等因素有关[12]。史宏博等发现, 纳米SiO2染尘导致小鼠肺组织SOD降低和MDA升高, 同时, 细胞出现凋亡并呈空泡样变[13], 和本次试验结果较为一致。同时也发现, 高剂量接尘肺脏器系数和对照组比较显著升高, 可能与高浓度矽尘接触后矽尘在肺泡中蓄积、动物食量降低等因素有关。
本研究发现在矽肺发生过程中, 机体存在氧化-抗氧化失衡的情况, 其机制与自由基的产生、脂质过氧化有关, 但其关键调控环节尚不清楚, 有待进一步研究。
| [1] |
Morcillo EJ, Estreal J, Cortijo J. Oxidative stress and pulmonary inflammation:pharmacological intervention with antioxidants[J]. Phamacol Res, 1999, 40: 393-402. |
| [2] |
Cantin PA. Oxidant and antioxidants in lung injury.In:Lam and Other Diseases Characterized by Smooth Muscle Proliferation[M]. New York: Dekker, 1999: 519-531.
|
| [3] |
Doelman CJ, Bast A. Oxygen radicals in lung pathology[J]. Free RadicBiol Med, 1990, 9: 381-400. DOI:10.1016/0891-5849(90)90015-B |
| [4] |
Meyer KC. Beryllium and lung disease[J]. Chest, 1994, 106: 942-946. DOI:10.1378/chest.106.3.942 |
| [5] |
Tanswell AK, Freeman BA. Antioxidant therapy in critical care medicine[M]. New Horizol, 1995: 330-341.
|
| [6] |
Vallyathan V, Shi X. The role of oxygen free radicals in occupational and environmental lung diseases[J]. Environ Health Perspect, 1997, 105(Suppl1): 165-177. |
| [7] |
Fels AOS, Nathan CF, Cohn ZA. Hydrogen peroxide release by alveolar macrophages from sarcoid patients and by alveolar macrophages from normals after recombinant interferons, and γ and 1, 25 -dihydroxyvitamin D3[J]. J Clin Invest, 1987, 80: 381-386. DOI:10.1172/JCI113083 |
| [8] |
Busse R, Mulsch A. Induction of nitric oxide synthase by cytokines in vascular smooth muscle cells[J]. FEBS Lett, 1990, 275: 87-90. DOI:10.1016/0014-5793(90)81445-T |
| [9] |
张育, 邓惟德. 缺铁性贫血患者血清丙二醛及超氧化物歧化酶的研究[J]. 中华血液学杂志, 1993, 14(5): 255-256. |
| [10] |
邹朝霞, 何志义, 冉丕鑫. 吸烟对大鼠肺内谷胱甘肽与γ-GCS的影响及乙酰半胱氨酸的干预作用[J]. 中国病理生理杂志, 2007, 01: 67-68. DOI:10.3321/j.issn:1000-4718.2007.01.015 |
| [11] |
Cheryl LF, Li sa, TimDO. Extrcellular superoxide dismutase in biology and medicine[J]. Free Rad Biol Med, 2003, 35(30): 236-256. |
| [12] |
杨莎莎, 林匡飞, 张卫, 等. 多尺寸纳米SIO2对小鼠肝、肾和脾的急性氧化损伤[J]. 华东理工大学学报自然科学版, 2009, 35(6): 834-838. |
| [13] |
史宏博, 王尊, 于宏升, 等. 纳米二氧化硅体内与体外氧化应激及细胞毒性实验研究[J]. 宁波大学学报, 2013, 26(1): 127-132. |