宫颈癌是女性常见的生殖系统恶性肿瘤, 我国其发病率在女性生殖系统恶性肿瘤中高居榜首, 且有年轻化的发展趋势。手术和放疗是治疗宫颈癌的两大主要手段。ⅡA期宫颈癌以手术治疗为主, 但对于肿瘤直径较大者手术切除效果不佳, 多采用根治性放疗。ⅡB期宫颈癌多采用根治性放疗, 但也有部分患者具备手术的指征。两者的有机结合即新辅助放疗后手术应用于治疗Ⅱ期宫颈癌可望能提高疗效、减少放疗副反应、延长生存期。本研究回顾性分析Ⅱ期宫颈癌患者资料, 以根治性放疗为对照, 观察新辅助放疗联合根治性手术的临床疗效, 分析新辅助放疗对手术的影响、放疗副反应及生存率的差异。
1 材料与方法 1.1 病例选择选取2003年7月至2011年4月山西医科大学第二医院收治的109例Ⅱ期宫颈癌患者, 卡氏评分在80分以上, 心电图、肝功、肾功、血常规均基本正常, 无放疗及手术禁忌症, 所有患者均不伴其他恶液质疾病且未接受过其他治疗。
1.2 临床资料新辅助放疗联合根治性手术组(R + S组) 59例, 年龄32~73岁, 中位年龄50岁。ⅡA期29例、ⅡB期30例; 鳞癌53例、腺癌4例、腺磷癌2例。单纯根治性放疗组(R组) 50例, 年龄27~71岁, 中位年龄49岁。ⅡA期24例、ⅡB期26例; 鳞癌40例、腺癌7例、腺磷癌3例。
1.3 治疗方法 1.3.1 R + S组首先给予术前放疗, 全部患者均在X射线模拟机下定位, 以髂嵴水平为上界, 耻骨联合下缘为下界, 两侧缘在股骨头内1/3附近设野, 大小约15 cm × 16 cm。采用加拿大(THERATRON78OC) 60 Co治疗机前后两野交替对穿照射, 盆腔大野DT 32 Gy/16次/4周, 同时给予宫腔内高剂量率192 Ir后装治疗使A点达DT 20 Gy/4次/4周。放疗结束后休息3~4周行根治性手术即广泛子宫切除+盆腔淋巴结清扫术。
1.3.2 R组单纯根治性放疗, 定位及设备同上, 盆腔两大野交替对穿照射使盆腔DT达32 Gy/16次/4周后改为盆腔四野照射, DT再加20 Gy/10次/2.5周, 总量达52 Gy, 同时予以宫腔内后装治疗A点达DT 40 Gy/8次/8周。
1.4 疗效判定 1.4.1 新辅助放疗后肿瘤消退的疗效判定主要根据治疗前目测以及妇科B超观察肿瘤瘤体大小。放疗后疗效判定标准参照国际抗癌联盟(UICC)疗效判定标准:肉眼观肿瘤完全消失且无新病灶为完全缓解(CR); 肿瘤缩小≥ 50%, 且无新病灶为部分缓解(PR); 肿瘤缩小 < 50%且无新病灶为病情稳定(SD); 肿瘤无缩小或有新病灶出现为病情进展(PD)。CR和PR判定为有效, SD和PD判定为无效。
1.4.2 新辅助放疗后对手术影响的疗效判定影响手术的评定项目:手术切除情况、盆腔淋巴结清扫情况、术中出血量, 术后并发症及术后病理切缘癌浸润等。
1.4.3 放疗副反应根据患者的病程记录、检查报告及回访记录评价放疗副反应。放疗副反应包括近期副反应及远期并发症。近期副反应:全身反应表现为乏力、食欲不振; 膀胱反应表现为尿频、尿急、尿痛; 直肠反应表现为大便次数增多、血便或粘液便; 骨髓抑制表现为白细胞及血小板减少。远期并发症主要有放射性直肠炎、放射性膀胱炎、阴道直肠瘘、肠粘连、肠梗阻、肠穿孔、盆腔纤维化、阴道挛缩、粘连及闭锁、宫腔积液等。
1.4.4 总体疗效判定比较宫颈癌患者3年、5年生存率, R + S组从术后开始计算生存时间, R组从放疗结束后开始计算生存时间。
1.5 统计学方法所有数据采用SPSS 13.0统计软件处理, 累计生存率用Kaplan-Meier法计算, 用卡方检验或四格表的确切概率法进行生存率及放疗副反应程度的比较。检验水准取α = 0.05, P < 0.05认为有统计学意义。
2 结果 2.1 R + S组放疗后肿瘤消退的情况表 1列出了肉眼观察的结果。
|
|
表 1 放疗前后肿块直径 |
放疗后56/59例(94.92%)患者的宫颈肿块有不同程度的缩小, 直径6 cm的肿块最小的缩至2 cm, 有3例(5.09%)患者直径2cm的肿块变化不明显。
2.2 新辅助放疗后对手术的影响R + S组患者在放疗结束3~4周后经检查宫颈均有不同程度变软和/或宫旁间隙增宽, 10例出现乏力、食欲不振, 7例出现轻度腹泻, 3例出现I~II度骨髓抑制, 患者术前经对症治疗恢复正常, 无手术禁忌, 59例患者均可行宫颈癌根治术, 且盆腔纤维结缔组织无明显粘连; 术中淋巴结分离顺利; 无1例出现膀胱、输尿管、直肠损伤。未发生不可控制的大出血, 出血量平均为(450 ± 57.38) ml。术后并发症主要为尿潴留、淋巴囊肿、泌尿系感染。发生率分别为22.03% (13/59)、8.47% (5/59)、8.47% (5/59), 经对症处理后均痊愈。术后病理:盆腔淋巴结转移8例, 其中宫旁浸润者5例, 阴道残端均无癌细胞浸润。
2.3 放疗副反应近期副反应: R + S组全身反应16.95% (10/59), 直肠反应11.86% (7/59), 骨髓抑制5.09% (3/59)。R组全身反应58.00% (29/50), 直肠反应50.00% (25/50), 骨髓抑制24.00% (12/50)。
远期并发症: R + S组放射性直肠炎6.78% (4/59), 放射性膀胱炎5.09% (3/59), 阴道直肠瘘0 (0/59), 及盆壁纤维化1.69% (1/59)。R组放射性直肠炎16.00% (8/50), 放射性膀胱炎16.00% (8/50), 阴道直肠瘘4.00% (2/50), 盆壁纤维化14.00%(7/50)。见表 2。
|
|
表 2 两组放疗副反应比较 |
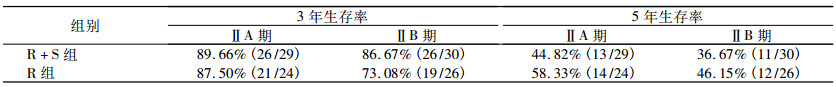
R + S组59例, 随访57例。术后1年死亡1例, 3年死亡1例, 4年死亡1例, 失访2例, 失访病例按随访日死亡计算, 随访率96.61%。R组50例, 随访46例, 失访4例, 随访率92%。两组生存率见表 3。
|
|
表 3 两组生存率的比较 |
两组患者随访时大多数均生存, 由于随访时间太短, 发生的死亡病例太少, 所以数据分析结果没有统计学意义。
3 讨论手术与放疗为宫颈癌的两大治疗措施, 需根据临床分期选择不同的治疗手段。传统认为早期患者以手术为主, 术后根据肿瘤的病理结果及其他因素综合决定术后辅助治疗。一般认为直径超过4 cm的ⅡA期宫颈癌单纯手术难度较大, 失败的主要原因是肿瘤局部复发及随后发生的远处转移[1], 因此常采用根治性放疗, 而且这种方法成为ⅡB期以上宫颈癌是主要治疗方法, 但也有一些学者尝试了部分ⅡB期宫颈癌用手术的方法进行治疗[2, 3]。单纯根治性放疗由于放疗剂量大、疗程长, 导致放疗后一是局部复发率高[4], 二是放疗副反应重, 且远期并发症发生率高。常见的放射性直肠炎患者大便次数增加, 严重者粘液便、伴血便, 直肠坏死穿孔、形成必须手术修复的阴道直肠瘘[5], 严重放射性膀胱炎久治不愈者, 在长期随访中也屡见不鲜。
宫颈癌患者日益增多且年龄日趋年轻化[6], 巨块型患者增多, 对放射治疗不敏感的腺癌比例也逐年增加, 特别是患者对治疗后生活质量要求的提高都给宫颈癌的治疗提出了更高的要求。新辅助放疗联合根治术由于其放疗剂量较根治术低, 在很大程度上降低了放疗副反应, 提高患者的生存率且不增加手术难度及术后并发症。杨英等[7]报道术前腔内后装治疗宫颈癌肿瘤消退有效率为92.9%。我们治疗的一些患者只是在给予了预防照射剂量的情况下, 就使部分肿瘤完全消失, 也说明了这个问题。本研究术前新辅助放疗CR 6例、PR 50例, 总有效率为94.92%, 降低了临床分期, 从而扩大了宫颈癌的手术适应证, 有力地说明新辅助放疗有使肿瘤分期降级使一些不能切除的肿瘤提高手术切除率。放疗结束后需休息3~4周以使放疗导致的盆腔充血水肿尽量消失, 如果休息时间过长, 可能导致放射性纤维化形成, 使穹窿萎缩, 有可能加重手术难度。通过放疗使肿瘤血管闭塞, 可有效减少术中出血, 也降低术后感染的机率, 此观点与国内一些报道[8]相似。本研究59例患者术中平均出血量为(450 ± 57.38) ml, 术后并发症为尿潴留、淋巴囊肿、泌尿系感染, 发生率分别为23.1%、7.99%、6.77%, 这些数据与以后的报道[9]相似。放疗时放射副反应是不可避免的, 也是允许的。影响放疗副反应的最重要因素是组织耐受剂量。阴道特别是宫颈组织耐受量较肿瘤的致死剂量高, 所以出现放疗反应的几率低, 膀胱及直肠组织耐受量较低, 因此在宫颈癌放射治疗后常出现放射性直肠炎及放射性膀胱炎。本研究结果中根治性放疗的远期并发症发生率与文献[10-13]报道的外照射后严重的远期并发症发生率(5%~15%)相近。本研究放疗近期副反应:全身反应(16.95%)、直肠反应(11.86%)、骨髓抑制(5.99%)。远期并发症中:放射性直肠炎(6.78%)、放射性膀胱炎(5.09%)、盆壁纤维化(1.69%), 无1例患者出现阴道直肠瘘, 单纯放疗组出现2例, 可见减少放疗量近期副反应及远期并发症均较低。而副反应发生率的降低是保证患者放疗后生活质量的重要因素。本研究3年、5生存率由于随访时间较短, 还不能得出有统计学意义的结论。
综上所述, Ⅱ期宫颈癌采用新辅助放疗具有以下优点: ①可使肿瘤明显缩小甚至消失, 扩大手术适应证、提高手术治愈率。②不增加手术难度及术后并发症。③降低患者近期放疗副反应和远期并发症。④降低癌细胞的活力, 减少转移的几率。⑤可取得与传统根治性放疗相近甚至更高的远期生存率。新辅助放疗加根治术治疗将两种治疗方法结合起来。对于不宜直接行手术治疗的Ⅱ期宫颈癌患者, 行新辅助放疗后再行根治术是较为理想的选择。此外, 对于单纯放疗疗效不佳或放疗不敏感的年轻腺癌患者, 新辅助放疗加根治术是一种较好的治疗方法。
| [1] |
魏丽惠. 宫颈癌的化学治疗[J]. 实用妇产科杂志, 2001, 17(2): 68-69. DOI:10.3969/j.issn.1003-6946.2001.02.006 |
| [2] |
王文英. 279例子宫颈癌手术治疗远期随访[J]. 实用妇科与产科杂志, 1989, 5(6): 303. |
| [3] |
Benedetti P, Greggi S, Scambia G, et al. Locally advanced cervical advanced cervical adenocarcinoma: Is there a place fo r chemosurgical treatment[J]. Gynecol Oncol, 1996, 61(1): 44-49. DOI:10.1006/gyno.1996.0094 |
| [4] |
盛修贵, 侯晓彤. II、III期子宫颈癌放疗后2年内267例死因探讨[J]. 肿瘤, 2000, 1(20): 49. |
| [5] |
侯友贤. 肿瘤放疗并发症防治[M]. 北京: 人民军医出版社, 2008: 54-59.
|
| [6] |
Massad SL, Markwell S, Cejtin HE, et al. Risk of high-grade cervical intraepithelial neoplasia among young women with abnormal screening cytology[J]. J Low Genit Tract Dis, 2005, 9(4): 225-229. DOI:10.1097/01.lgt.0000179862.75198.3d |
| [7] |
杨英, 厉霞玲. 宫颈癌术前放疗疗效观察[J]. 肿瘤学杂志, 2006, 12(2): 117-118. |
| [8] |
孟祥兰. Ⅱ期宫颈癌的术前放疗加手术根治[J]. 山西医药杂志, 1998, 20(3): 273-274. |
| [9] |
黄萍, 周丽. 247例子宫颈癌根治术的并发症[J]. 癌变, 畸变, 突变, 2008, 20(4): 21-23. |
| [10] |
Nag S. Modern techniques of radiation therapy for erdometrial cancer[J]. Clin Obstet Gynecol, 1996, 39: 728-744. DOI:10.1097/00003081-199609000-00020 |
| [11] |
Rotman M, Aziz H, Halpern J, et al. Endometrial carcinoma: Influence prognostic factors on radiation management[J]. Cancer, 1993, 71: 1471-1479. DOI:10.1002/cncr.2820710412 |
| [12] |
Lampe B, Kurzl R, Hantschmann P. Prognostic factors that Predict pelvic lymph node metastasis from endometrial carcinoma[J]. Cancer, 1994, 74: 2508-2512. |
| [13] |
Corn BW. Intermediate-risk endometrial cancer. A managemen approach[J]. American Journal of Clinical Oncology, 1996, 19: 631-635. DOI:10.1097/00000421-199612000-00021 |