2. 天津大港油田总医院
放射治疗治疗恶性肿瘤时照射腹部可以同时照射到肝、肾、脾等重要器官。肾为晚反应器官之一, 放射损伤发展较慢, 急性放射性肾损伤出现在照射后6 - 12月内, 慢性放射性肾损伤由急性放射性肾损伤演变而来, 通常在照射后1年或数年后表现出来, 发生肾纤维化, 甚至肾衰[1], 对患者产生严重的影响, 甚至危及生命。影像学检查对于放射性肾损伤的诊断和随访有重要价值。本研究以SD大鼠为实验对象, 制作急性放射性肾损伤模型, 观察放射性肾损伤病理变化及影像学表现, 评价CT、MRI对放射性肾损伤的早期诊断价值。
1 材料与方法 1.1 实验动物分组健康雄性SD大白鼠48只, 体重(300 ± 10) g, 由北京华阜康生物科技股份有限公司提供。随机分为对照组24只。照射组分为4组, 每组6只, 采用左肾单次照射。大鼠由天津医科大学动物实验中心常规饲养。整个实验过程全部动物无一死亡。
1.2 建立动物模型照射组24只实验动物, 采用Siemens Primus M直线加速器产生的5 MeV电子线左肾照射, 剂量为20 Gy, 其步骤如下: ①动物麻醉:采用10%水合氯醛溶液4. 5 ml /kg腹腔注射麻醉。②固定:待大白鼠完全麻醉后, 取俯卧位确切固定在自制固定板上, 模拟机下定位, 左肾照射野面积2.5 cm × 2.5 cm, 周围挡铅。③照射:剂量率300 cGy /min, 源皮距为100 cm。照射完毕, 苏醒后送回继续饲养。
1.3 CT、MRI检查于各组动物(每组6只)照射后4、12、24、36周后行CT、MRI检查。动物麻醉及固定方法同上, 采用LightSpeed VCT扫描, 参数:正位Scott定位, 扫描范围包括整个腹腔及盆腔200 mm, 120 kV, 10 mA。轴位扫描: 120 kV, 100 mA, 0. 6 s, 层厚1.25cm, 3.75 mm /sHQ模式, DFOV 9. 6 cm。平扫后大鼠尾静脉注射碘海醇0. 4 ml, 行CT常规增强扫描。采用GE Signa HDxt MRI扫描, 自制动物线圈, 参数:常规冠位扫描, SE序列T1WI (TR2700ms, TE15ms), 快速自旋回波(FSE)序列T2WI(TR2840ms, TE122ms)扫描矩阵352 × 192, 回波链长度(ETL) 24, 视野(FOV) 12 cm × 12 cm, 层厚2 mm, 零间隔连续扫描。将CT、MRI图像输入STAR - 2000适形放疗系统, 勾画各组大鼠肾脏, 计算大鼠肾脏体积。测量肾实质厚度:左侧肾脏取三个测量层面, 上肾盏、肾门大血管、下肾盏水平三个层面。以平行于肾门肾静脉直线为长轴线, 与之垂直为短轴线, 分别测量轴线上肾盂内脂肪外缘到肾脏外缘的长度, 得到肾脏实质内、后、外厚度, 取平均值作为肾门层面平均肾实质厚度, 三个层面在取平均值作为肾脏皮质厚度[2]。
1.4 影像学评价采用盲法原则, 由3位非课题组影像专家单独阅片, 意见相同者为阳性诊断, 否则为阴性诊断。
1.5 肾脏病理学检查动物行影像学检测后, 将左肾摘除, 于10%甲醛溶液中固定, 石蜡包埋制成普通病理切片, HE染色。光镜下观察病理改变。另取部分组织, 2.5%戊二醛溶液固定, 透射电镜下观察。
1.6 使用SPSS8. 0统计软件, 分别对每次检查的数值进行t检验, 以均数标准差表示结果, 进行两两比较, 对4次扫描肾脏指标值进行多重比较方差分析, 进行两两比较, P < 0. 05为差异有统计学意义。
2 结果 2.1 病理大鼠照射后病理学观察结果从每组在照射后4、12、24、36周通过颈部脱节方式处死并迅速取肾。对照组肾小球及肾小管结构无明显改变, 少部分24、36周后可见基膜增厚, 考虑大鼠肾脏退行性变。照射组光镜:照射后4周肾脏逐渐出现少量的肾小球内皮细胞增生, 肾小球囊腔的变窄、消失及周围肾小管变窄, 肾小球硬化趋势。照射后12、24周肾小球囊腔变窄、消失, 较前显著。肾小管变窄, 被膜下部分肾小管破坏, 间质内可见淋巴细胞浸润。照射后36周肾小球明显的硬化趋势, 肾小管及肾间质纤维化。照射组电镜: 4周之后, 基底膜变厚, 足突细胞可见融合。肾小球内皮细胞可见水肿。系膜基质及系膜细胞增加。肾小管玻璃样变性。12周之后, 进一步明显的肾小球内皮细胞损伤, 线粒体水肿。明显的基底膜增厚和扭曲, 并部分足突细胞消失。肾小管变性并萎缩进一步加重。肾细胞间隙可见少量胶原纤维。24周之后肾小球及肾小管可见较前明显损伤。肾小管再生可见。肾间质大量胶原纤维。36周之后肾小球、肾小管、间质损伤进一步加重, 纤维化较前明显显著。
2.2 大鼠左侧肾脏体积、肾实质厚度CT及MRI测值的比较照射前各组行CT、MRI检测, 测量每一只大鼠左侧肾脏体积及肾实质厚度, 各组间数值差异无统计学意义(P > 0. 05)。
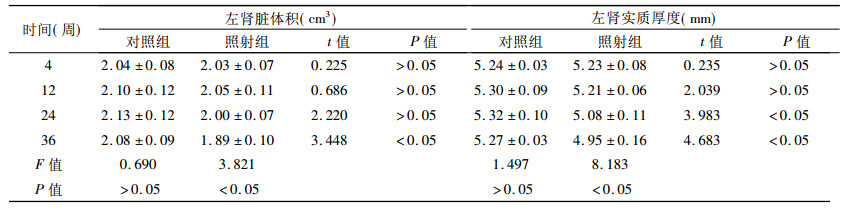
2.2.1CT及MRI扫描大鼠左肾肾脏体积、肾实质厚度值比较可见表 1及表 2, 显示随时间延长体积缩小, 肾实质厚度变薄。
|
|
表 1 对照组与照射组左肾体积实及肾实质厚度在CT测值的比较 |
|
|
表 2 对照组与各照射组左肾实质厚度及体积在MRI测值的比较 |
CT平扫显示在照射后第4、12、24及36周左侧肾脏均无明显影像学改变, CT强化均未见未强化区。MRI显示在照射4、12周后左侧肾脏未见明显信号改变, 其皮髓质分界清晰, 第24周2例可见皮髓质分界模糊征象改变(2 /6), 第36周可见3例可见皮髓质分界模糊征象改变(5 /6)。
3 讨论 3.1 放射性肾损伤动物模型和照射剂量的选择在放射性肾损伤的动脉模型选择方面, 有学者[3]采用接近人肾体积大小的狗、猪等作为动物模型为理想选择, 然而实验操作难度大, 饲养、观察随访等都比较困难。本实验采用SD大鼠, 运用CT、MRI观察肾脏病变准确及敏感度高, 获得的实验图像比较令人满意。
肾功能损伤主要是根据放射总剂量, 分次照射剂量, 照射体积等因素有关[4]。本实验旨在观察动物照射后影像学变化, 需要最大程度保证生存率, 故采用20Gy左肾单次照射, 在相对短时间建立放射性肾损伤模型, 并且全部动物无一死亡, 使用CT及MRI等非创性检查手段研究动物36周内影像学征象的系列变化成为可能。Diange Liu等采用7, 15, 25 Gy左肾单分割照射, 都可以造成放射性肾损伤改变, 但严重程度与剂量明显相关[5]。
3.2 放射性肾损伤的病理表现肾照射后肾单位组织改变呈时间和剂量依赖性改变, 引起肾小球硬化, 肾小管萎缩和肾间质纤维化, 导致肾功能进行性减退[6]。有研究[7]显示放射靶细胞为肾小球毛细血管内皮细胞, 肾小球系膜细胞, 肾小管上皮细胞及近肾小球旁血管。受照射的肾小球发生损伤, 包括不同程度的毛细血管襻增厚、上皮细胞肿胀和基膜双轨形成, 肾小球内毛细血管襻可见单核细胞、淋巴细胞浸润。系膜可发生明显病变包括系膜细胞溶解、上皮细胞与系膜基质粘连, 最终导致毛细血管襻塌陷和系膜硬化。一些报道显示近端肾小管上皮细胞也是靶细胞[8], 肾小管上皮细胞损伤特征表现为细胞核增大、细胞核有丝分裂明显和细胞质嗜碱性。随着损伤的进展, 肾小管基膜不规则增厚, 肾小管逐渐萎缩, 小管基膜裸露。肾间质纤维化和炎细胞浸润。放射性肾病血管损伤的类型亦为多种多样。早期报道为基本的损伤为肾动脉硬化造成血管堵塞, 缺血进一步造成肾小管的变性[9]。小动脉和动脉常有血栓形成, 且与肾小球血栓形成相平行, 其他表现包括小动脉和动脉中膜增厚、闭塞性内膜增厚[10]。
3.3 放射性肾损伤的CT、MRI影像学表现 3.3.1 放射性肾损伤的影像学评价手段的应用本实验采用CT、MRI作为影像学手段观察放射性肾损伤。CT有扫描速度快, 可以减少实验动物因呼吸造成的伪影的影响, 使观察结果更较准确。而MRI检查可以多方位扫描肾脏, 并对肾皮质及髓质等显示清晰。
3.3.2 放射性肾损伤的CT、MRI影像学表现CT的改变在放射性肾病是非特异性的。在急性放射性肾损伤, CT的表现可以是正常的[11], 在慢性期局部或整体的萎缩是放射性肾损伤的表现。有学者发现放射性肾损伤的CT表现为放射区域造影剂密度减低。造影剂的低浓聚是判断急性放射性肾炎的影像表现方法[12]。Andersen BL[13]报道患者放射治疗11和12个月之后显示注射造影剂后未见明显异常, 延迟两个小时之后扫描照射区密度增高。原因是造影剂在肾小管中淤滞及近端肾小管造影剂的重吸收。以前的报道显示受高剂量照射的患者肾功能已经发生明显损害, 但扫描后得到正常影像。本实验研究显示照射后36周内大鼠肾脏体积逐渐缩小, 于第24周后照射组肾脏体积与对照组体积差异有统计学意义(P < 0. 05), 体积缩小。而第12周后照射组肾实质厚度于对照组肾实质厚度比较差异有统计学意义(P < 0. 05), 厚度变薄, 出现时间较早。而平扫及增强扫描均未见上述影像学改变, 可能与大鼠处于急性放射性肾损伤有关。同时, 本实验CT增强扫描操作为尾静脉团注方法, 动脉期掌握不好, 皮髓质分界显示不佳。
本实验显示MRI显示放射性肾损伤的变化亦是非特异性改变。T1WI及T2WI上均未见明显异常信号影。MRI同样可以显示照射肾脏体积及肾实质厚度随观察时间延长而缩小与变薄, 于第12周后与对照组对比差异有统计学意义(P < 0. 05), 其改变与慢性肾病改变不易区分。正常肾脏肾脏皮髓质分界(corticomedullary differentiation, CMD)清晰。在肾功能下降、各种肾病, CMD表现出不同程度模糊, 甚至消失[14]。在MRI成像中, 肾脏的CMD呈现一条清晰的界限。在MRI上显示较为清晰。由于单位组织内含水量髓质比皮质多, 正常皮质血流量比髓质血流量大, 致使皮髓质因信号不同而分界清晰。皮质水肿或肾小管流量减少, 蛋白或血性物质沉积于髓质, 或者肾脏血流量改变及重新分布等, 都可以使皮髓质分界模糊或消失[15]。放射性肾损伤病理组织学改变为弥散非特异性的, 包括小血管硬化, 肾小球病变, 肾小管萎缩及间质纤维化, 可使皮髓质分界模糊或消失。本实验显示MRI扫描对皮髓质及CDM的显示明显优于CT扫描, MRI对软组织的分辨率更能对病变清晰显示, 且对肾脏无明显肾毒性, 对于病变的定位及诊断MRI优于CT。
| [1] |
Robbins MEC, Bonsib SM. Radiation nephropathy: A review[J]. Scanning Microsc, 1995, 9: 535-560. |
| [2] |
许玉峰, 唐光健. CT测量肾脏皮质厚度与年龄关系的研究[J]. 中华放射学志, 2004, 38: 805-810. |
| [3] |
Robbins MEC, Stephens LC, Johnston DA, et al. A morphometric analysis of glomerular and tubular alterations following fastneutron irradiation of pig and monkey kidney[J]. Int J Radiat Oncol Biol Phys, 1998, 41(5): 1149-1156. DOI:10.1016/S0360-3016(98)00161-8 |
| [4] |
Krochak RJ, Baker DG. Radiation nephritis: Clinical manifestations and pathophysiologic mechanisms[J]. Urology, 1986, 27: 389-93. DOI:10.1016/0090-4295(86)90399-7 |
| [5] |
Diange Liu, Mohammed S Razzaque. Role of heat shock protein 47 on tubulointerstitium in experimental radiation nephropathy[J]. Pathology International, 2002, 52: 340-347. DOI:10.1046/j.1440-1827.2002.01362.x |
| [6] |
Robbins MEC, Bonsib SM. Radiation nephropathy: a review[J]. S canning Microsc, 1995, 9(2): 535-560. |
| [7] |
Janke RS, Robbins MES, Byeaters T, et al. Capilary endothelium: Target site of renal radiation injury[J]. Lab Invest, 1993, 68: 396-405. |
| [8] |
Otsuka M, Meistrich ML. Cell proliferation and abnormal nuclei induced by radiation in renal tubule epithelium as early manifestation of late damage[J]. Radiat. Res, 1990, 123: 285-291. DOI:10.2307/3577734 |
| [9] |
White A. Decrements in late radiation injury: Late radiation nephrosclerosis[J]. Cancer, 1976, 37: 1135-1140. |
| [10] |
Te Poele JA, VanK leef EM, Vander Wal AF, et al. Rad iation - induced glomerular thrombus formation and nephropathy are not prevented by the ADP receptor antagonist clopidogrel[J]. Int J Radiat Oncol Biol Phys, 2001, 50(5): 1332-1338. DOI:10.1016/S0360-3016(01)01617-0 |
| [11] |
Moore L, Curry NS. Computed Tomography of Acute Radiation Nephritis[J]. Urol Radiol, 1986, 8: 89-91. DOI:10.1007/BF02924084 |
| [12] |
Wiston BW, McAfee JG, Sagerman RH, et al. Renal uptake of the Tc - 99m methylene diphosphonate after radiation therapy[J]. J Nucl Med, 1979, 20: 32-34. |
| [13] |
Andersen BL, Lauver JW, Ross P, et al. Demonstration of radiation nephritis by computed tomography[J]. Comput Radiol, 1982, 6: 187-191. DOI:10.1016/0730-4862(82)90014-2 |
| [14] |
Munechika H, Sllivan DC, Hedlund LW, et al. Evaluation of acute renal failure with magnetic resonance imaging using gradient - echo and Gd - DTPA[J]. Invest Radiol, 1991, 26-22. |
| [15] |
Marrotti M, Hricak H, Terrier F, et al. MR in renal disease: Importance of cortico - medullary distinction[J]. Magn Reson Med, 1987, 5: 160. DOI:10.1002/(ISSN)1522-2594 |