人支气管上皮细胞是氡及子体的主要靶细胞。哥伦比亚大学研究人员率先建立了α粒子照射诱发永生化人支气管上皮细胞(BEP2D)转化模型[1]。军事医学科学院在国内首先建立了该模型[2], 他们用1. 5 Gy α粒子照射BEP2D细胞并进行传代, 第20代细胞(R15H20)开始出现细胞转化的部分特征, 但接种裸鼠不成瘤, 表明R15H20处于转化的早期, 为癌前病变期。第35代细胞接种裸鼠成瘤, 组织切片证实为人上皮来源的鳞癌, 将接种的鳞癌进行克隆培养并建立了恶性转化细胞系(RHT - 35)。α粒子诱发BEP2D细胞体外转化模型与体内癌症的发生一样, 是一个渐进的多阶段的连续发展过程。因此, 以该转化模型为研究对象, 对于深入了解癌症发生、发展和恶性转化的分子机制具有重要价值。微小RNA(microRNAs)是一类18 ~ 24nt的非编码RNA分子。有关microRNAs是否参与氡及子体诱发肺癌的过程, 少见报道。本研究利用α粒子诱发人支气管上皮细胞(BEP2D)转化模型, 探讨了miR - 200家族在α粒子诱发BEP2D转化不同时期的表达情况, 为发展用于诊断的肿瘤标志物和识别候选的药物靶标提供依据。
1 材料与方法 1.1 细胞培养α粒子照射诱发永生化人支气管上皮细胞转化模型(BEP2D、R15H20和RHT35细胞)由军事医学科学院周平坤博士惠赠。细胞培养于LHC - 8无血清培养基中, 置37 ℃、5% CO2培养箱中传代培养。
1.2 细胞总RNA的提取用TRIzol试剂(美国Invitrogen公司)提取细胞总RNA。用紫外分光光度计测定总RNA浓度。以OD260 nm /280 nm比值评估纯度, 全部样品总RNA的OD260 nm /280 nm比值均在1. 8 ~ 2. 1之间。用甲醛变性琼脂糖凝胶电泳检测总RNA的完整性, 高质量的和完整的总RNA用于实验。
1.3 实时荧光定量PCRmiR - 200家族及相关基因用ABI 7500 fast实时荧光定量PCR进行检测。miR -200家族引物及探针由美国ABI公司TaqMan MicroRNA assays试剂盒提供, 以三个细胞系的总RNA各5 ng为模板进行cDNA反转录合成, 反应体系包括: ①总RNA, 5 ng ②茎环反转录引物, 50 nM ③ dNTPs, 0. 25 mM ④RNA酶抑制剂, 250 kU ⑤反转录酶, 250 kU ⑥10 ×反转录缓冲液。反应条件: 16 ℃, 30 min, 42 ℃, 30 min, 85 ℃, 5 min。实时荧光定量PCR反应体系包括: ①cDNA, 1. 33 μl ②TaqMan miRNA (含miR - 200家族的引物及探针), 1 μl ③ TaqMan 2 × Master Mix, 10 μl ④无RNA酶水, 7. 67 μl。反应条件: 95 ℃, 10 min; 95 ℃, 15 sec, 60 ℃, 1 min, 共40个循环。用RNU6B作为内参照基因, 实验数据以2-△△Ct表示。ZEB家族及上皮间质转变(EMT)相关标志分子(Marker)引物[3]由上海生工生物技术有限公司合成。以三个细胞系的总RNA各2 μg为模板, 用RT - PCR试剂盒(美国Invitrogen公司)进行cDNA反转录合成, 操作按产品说明书进行。用SYBR试剂盒(美国ABI公司)进行实时荧光定量PCR反应。反应条件: 95 ℃, 10 min; 95 ℃, 15 sec, 60 ℃, 1 min, 共40个循环。用GAPDH作为内参照基因, 实验数据以2-△△Ct表示。
1.4 统计学分析数据用x±s表示, 用SPSS 12. 0统计软件对数据进行单因素方差分析, P < 0. 05为差异具有统计学意义。
2 结果 2.1 miR - 200家族在α粒子诱发BEP2D转化细胞中的表达用实时荧光定量PCR检测了miR - 200家族在BEP2D、R15H20和RHT35细胞中的表达, 结果见图 1。由图 1可知, 与BEP2D和R15H20细胞相比, RHT35细胞中miR - 200家族的表达显著下调(P < 0. 01)。
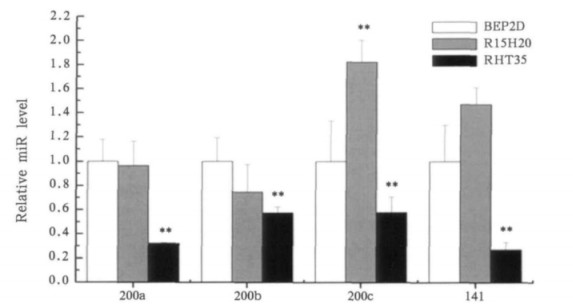
|
图 1 MiR - 200家族在BEP2D、R15H20和RHT35细胞中的表达 |
用实时荧光定量PCR检测了ZEB家族及EMT相关Marker在BEP2D、R15H20和RHT35细胞中的表达, 结果见图 2和图 3。与BEP2D和R15H20细胞相比, RHT35细胞中ZEB1和ZEB2的表达显著上调(图 2), 其中ZEB1和ZEB2 mRNA分别上调9. 44和27. 56倍, **P < 0. 01。与BEP2D和R15H20细胞相比, RHT35细胞中上皮Marker上皮-钙连接素(E - cadherin, E - cad) mRNA的表达显著下调(下调4. 4倍, **P < 0. 01);间质Marker神经-钙连接素(N - cadherin, N - cad) mRNA的表达显著上调(上调4. 3倍, **P < 0. 01), 而波形蛋白(Vimentin, Vim)和纤维连接蛋白(Fibronectin, FN) mRNA的表达未出现明显改变(图 3)。

|
图 2 ZEB家族在BEP2D、R15H20和RHT35细胞中的表达 |

|
图 3 EMT相关Marker在BEP2D、R15H20和RHT35细胞中的表达 |
miR - 200家族成员中miR - 200a和miR - 200b定位于人1号染色体, miR - 200c和miR - 141定位于人12号染色体。研究人员利用miRNA靶基因预测分析软件发现ZEB1和ZEB2基因含有许多miR - 200家族成员的作用位点。过表达miR - 200家族能下调ZEB家族的表达。Burk等报道[4]: ZEB1敲除的乳腺癌和结直肠癌细胞系中miR - 200c和miR - 141的表达明显上调。上述发现表明miR - 200家族与转录因子ZEB家族之间存在双向负反馈调控环。与BEP2D和R15H20细胞相比, RHT35细胞中miR - 200家族的表达显著下调的同时出现ZEB1和ZEB2的表达显著上调, 表明RHT - 35细胞中miR - 200家族与ZEB家族的表达存在反向关系, 提示ZEB家族过表达可能是RHT35细胞中miR - 200家族表达下调的机制。过表达miR - 200家族能抑制肿瘤细胞的上皮间质转变和侵袭及转移能力[5, 6], 提示过表达miR - 200家族有可能成为治疗α粒子诱发人支气管上皮细胞恶性转化的有效手段。
EMT指细胞由上皮表型向间质表型的转变, 这种转变在动物胚胎发育、伤口愈合和肿瘤转移等过程中扮演着重要的角色[7]。在上皮间质转变过程中, E - cad等上皮特征性分子表达减少或缺失, 而N - cad、Vim和FN等间质特征性分子表达增加。与BEP2D和R15H20细胞相比, RHT35细胞中上皮Marker(E - cad)的表达显著下调, 间质Marker(N - cad)的表达显著上调, 表明RHT - 35细胞在α粒子诱发恶性转化过程中发生了上皮间质转变。ZEB家族主要通过调控E - cad而发挥诱导上皮间质转变的作用。ZEB1和ZEB2都能与E - cad基因启动子上的二联E -盒结合而抑制E - cadherin基因的转录, 提示ZEB家族过表达可能与RHT35细胞中E - cad表达下调进而发生EMT相关, 这一假设有待进一步验证。X -或γ -射线能诱导人肺腺癌细胞、人子宫内膜癌细胞和人乳腺上皮细胞发生上皮间质转变并能增强细胞迁移能力, 同时这些细胞存在上皮Marker(E - cad)的表达下调以及间质Marker(N - cad、Vim和FN1)的表达上调[8-10]。这些分子水平的变化与RHT - 35细胞在高LET α粒子诱发恶性转化过程中发生EMT所经历的变化相似, 提示低LET和高LET辐射诱导细胞发生上皮间质转变具有相似的分子机制。
| [1] |
Hei TK, Piao CQ, Willy JC, et al. Malignant transformation of human bronchial epithelial cells by radon simulated α particles[J]. Carcinogenesis, 1994, 15(3): 431-437. DOI:10.1093/carcin/15.3.431 |
| [2] |
葛世丽, 楼铁柱, 项晓琼, 等. α粒子照射诱发BEP2D恶性转化模型的建立[J]. 癌症, 2001, 20(9): 901-905. |
| [3] |
Mani SA, Guo WJ, Liao MJ, et al. The epithelial - mesenchymal transition generates cells with properties of stem cells[J]. Cell, 2008, 133: 704-715. DOI:10.1016/j.cell.2008.03.027 |
| [4] |
Burk U, Schubert J, Wellner U, et al. A reciprocal repression between ZEB1 and members of the miR - 200family promotes EMT and invasion in cancer cells[J]. EMBO Rep, 2008, 9: 582-589. DOI:10.1038/embor.2008.74 |
| [5] |
Park SM, Gaur AB, Lengyel E, et al. The miR - 200 family determines the epithelial phenotype of cancer cells by targeting the E - cadherin repressors ZEB1 and ZEB2[J]. Genes Dev, 2008, 22: 894-907. DOI:10.1101/gad.1640608 |
| [6] |
Schliekelman MJ, Gibbons DL, Faca VM, et al. Targets of the tumor suppressor miR - 200 in regulation of the epithelial - mesenchymal transition in cancer[J]. Cancer Res, 2011, 71(24): 7670-7682. DOI:10.1158/0008-5472.CAN-11-0964 |
| [7] |
Zeisberg M and Neilson EG. Biomarkers for epithelial - mesenchymal transitions[J]. J Clin Invest, 2009, 119: 1429-1437. DOI:10.1172/JCI36183 |
| [8] |
Tsukamoto H, Shibata K, Kajiyama H, et al. Irradiation - induced epithelial - mesenchymal transition (EMT) related to invasive potential in endometrial carcinoma cells[J]. Gynecologic Oncology, 2007, 107: 500-504. DOI:10.1016/j.ygyno.2007.08.058 |
| [9] |
Jung JW, Hwang SY, Hwang JS, et al. Ionising radiation induces changes associated with epithelial - mesenchymal transdifferentiation and increased cell motility of A549 lung epithelial cells[J]. Eur J Cancer, 2007, 43: 1214-1224. DOI:10.1016/j.ejca.2007.01.034 |
| [10] |
Andarawewa KL, Erickson AC, Chou WS, et al. Ionizing radiation predisposes nonmalignant human mammary epithelial cells to undergo transforming growth factor B - induced epithelial to mesenchymal transition[J]. Cancer Res, 2007, 67: 8662-8670. DOI:10.1158/0008-5472.CAN-07-1294 |




