BLAP75 (BLM - associated polypeptides, 75KD)是于十年前发现的一个DNA解螺旋酶BLM的结合蛋白[1]。序列分析发现BLAP75是从酵母到人类的真核细胞生物中想当保守的一个蛋白, 它包含有结合核酸的OB - fold结构域(OB - fold nucleic acid binding domain) [2, 3]。由于BLAP75能与BLM紧密结合, 而BLM解螺旋酶参与细胞中很多DNA修复的过程, 其中, 迄今机理研究得最清楚的是BLM和DNA拓扑异构酶TopoIIIα合作, 通过同源重组修复DNA双链断裂的途径[4, 5], 从而我们推测BLAP75很有可能也参与DNA损伤修复。因此, 本研究旨在观察细胞中的BLAP75在电离辐射和紫外线辐射下的反应来寻找BLAP75参与DNA损伤修复的线索。
1 材料和方法 1.1 材料人宫颈癌HeLa细胞由本实验室保存, 用含10 %胎牛血清(FBS, 美国Gibco公司)的DMEM培养基, 在37 ℃、5 % CO2的条件下培养。BLAP75抗体购自Proteintech; 磷酸化Chk1抗体购自Cell Signaling Technology; Actin抗体购自Chemicon。细胞紫外照射用波长为254 nm的紫外交联仪(UVP); γ射线照射用铯源为137Cs, 剂量率为5 Gy /min。
1.2 Western印迹裂解细胞, 提取总蛋白, 测定总蛋白浓度。取40 μg总蛋白上样, 经SDS -聚丙烯酰胺凝胶电泳(SDS - PAGE)后, 采用半干转移法将蛋白转移到硝酸纤维素膜上, 5 %脱脂奶粉室温封闭1 h, 于4 ℃一抗孵育过夜, 室温二抗孵育1 h, 加显色剂显色曝光。
1.3 蛋白磷酸酶反应取60 μg总蛋白量的细胞裂解液, 稀释到每个反应的总体积为25 μl, 其中按说明书要求添加有磷酸酶buffer和MnCl2。然后在反应组样品中加入λ蛋白磷酸酶(购自美国NEB公司), 于30 ℃水浴中孵育1 h。最后加入上样缓冲液, 煮沸5 min, 以终止反应。
1.4 间接免疫荧光反应实验前一天, 将细胞接种于铺有盖玻片的细胞培养皿中。第二天, 取出长有细胞的盖玻片, 用PBS洗3遍后, 用4 %多聚甲醛固定细胞10 min, 再用含0.2 % Triton X - 100的PBS对细胞进行透化处理10 min, 接着用含7. 5% BSA的PBS封闭30 min。滴加稀释的一抗于覆盖有细胞的盖玻片上, 置37 ℃湿盒中避光孵育1 h, 二抗在同样条件下孵育1 h。于载玻片上滴上一滴含DAPI的防荧光萃灭封片剂(购自Vector公司), 将洗净的盖玻片封片。用荧光显微镜尼康TE800进行观察和拍照。
2 结果 2.1 紫外线辐射和电离辐射导致BLAP75蛋白被磷酸化Western印迹法可以用来检测蛋白的翻译后修饰, 因为在电泳的过程中, 通常被修饰的蛋白会比没有修饰的蛋白移动得慢一些, 所以最终显影出来的位置会比未修饰蛋白带的位置高。因此, 我们运用这个方法来检测BLAP75蛋白对辐射的反应。从图 1(A)可见, 照射前, BLAP75蛋白带的上面隐隐有一条修饰的蛋白带; 而紫外线照射(UV)后, BLAP75蛋白则全部呈现在被修饰的蛋白带位置; 电离辐射(IR)后, 大部分BLAP75为被修饰的形式, 仅有小部分BLAP75蛋白保持原本的迁移位置, 说明UV导致BLAP75蛋白几乎全部被修饰, 而IR仅导致部分BLAP75蛋白被修饰。为了进一步确定BLAP75蛋白被修饰的类型, 我们用λ蛋白磷酸酶(λ - PPase)来处理细胞裂解液, 发现紫外线照射后呈现的被修饰的蛋白带经过处理后又回到原初的位置(见图 1B), 说明λ蛋白磷酸酶能去除BLAP75蛋白的修饰, 进而说明BLAP75蛋白是被磷酸化修饰了。磷酸化的Chk1在此是作为蛋白磷酸酶反应的阳性对照, 如图 1B所示, 加入λ蛋白磷酸酶的样品中不再能检测到磷酸化Chk1的存在。
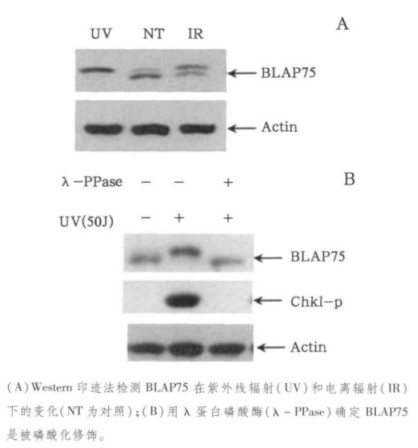
|
图 1 紫外线和电离辐射诱导的BLAP75蛋白的翻译后修饰 |
确定BLAP75蛋白在辐射后会被磷酸化之后, 我们进一步研究它的上游磷酸化激酶是什么。最有可能的就是ATM (ataxia - telangiectasia - mutated, 共济失调及毛细血管扩张症突变蛋白)与ATR(ATM and Rad3 - related, ATM与Rad3相关蛋白)这两个激酶, 因为它们是各类DNA损伤反应中最常见的两种激酶[6]。咖啡因(caffeine)是PIKK激酶(phosphinositide 3 - kinase - like kinase, 磷酸肌醇3激酶样激酶)的特异性化学抑制剂, 能够特异地抑制ATM和ATR的活性。因此, 我们用咖啡因预处理细胞1 h, 再接受照射。如图 2所示, 紫外线照射后, BLAP75蛋白带几乎全部上移, 但是经过咖啡因预处理的细胞中, 则有相当一部分BLAP75蛋白回归到原先的位置, 说明抑制ATM和ATR致使BLAP75的磷酸化不完全; 咖啡因预处理对IR的磷酸化BLAP75的效应也有相似的影响, 即削弱BLAP75磷酸化的程度。以上结果都提示, 辐射后ATM和ATR两个激酶起到磷酸化一部分BLAP75蛋白的作用。
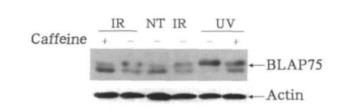
|
图 2 用咖啡因(caffeine)处理细胞对对BLAP75磷酸化的影响 |
间接免疫荧光是观察特定蛋白在细胞中定位的一个有效方法。我们采用免疫荧光技术观察到(见图 3), 照射前, 在大部分细胞中BLAP75蛋白均匀地分布在细胞核中; γ射线照射后, 大部分细胞中的BLAP75蛋白都在细胞核中聚集形成许多明显的小亮点, 称之为细胞核聚焦体(nuclear foci), 被普遍认为是DNA损伤及进行修复的部位, 表明很多BLAP75蛋白被招募到DNA损伤部位, 提示BLAP75参与DNA损伤修复过程。
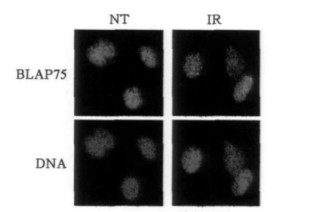
|
图 3 电离辐射(IR)诱导BLAP75形成核聚焦体 |
DNA是生命体的遗传物质, 物种的延续有赖于遗传物质忠实而完整的传递, 但是外界环境中的多种因素经常会引起DNA损伤, 其中, 紫外线和电离辐射是最常见的物理致伤因素。胸腺嘧啶二聚体是紫外线诱导的DNA损伤的主要形式, 核苷酸切除修复(nucleotide excision repair, NER)是修复此类损伤的主要途径; 电离辐射所导致的主要DNA损伤类型则是DNA双链断裂, 主要通过非同源末端连接(non - homologous end joining, NHEJ)或者同源重组(homologous recombination, HR)来修复。由于BLAP75能与BLM和TopoIIIα结合形成BTB(BLM - TopoIIIα - BLAP75)复合物, 在同源重组修复受损的DNA过程中, 具有提高BLM和TopoIIIα酶活性的重要作用[7], 并且BLM基因的突变就会导致基因组的不稳定性以及癌症的高发性[8], 所以BLAP75很可能在辐射损伤修复中起重要作用。因此, 在本研究中我们从分子水平和细胞水平观察了BLAP75对紫外线辐射和电离辐射的反应和变化。结果显示UV和IR都能诱导BLAP75蛋白的磷酸化, 磷酸化是分子信号传导的一种重要方式, 暗示BLAP75在辐射损伤反应中可能有转导损伤信号的作用。不过, 需要注意的是UV和IR诱导BLAP75磷酸化的程度不同, UV诱导的BLAP75磷酸化更彻底一些, 提示BLAP75磷酸化在不同辐射损伤条件下可能发挥不一样的作用。此外, 本实验中使用咖啡因能部分抑制辐射诱导的BLAP75磷酸化, 说明至少有一部分磷酸化是由ATM或者ATR激酶催化形成的, 而且BLAP75的上游还存在其他的磷酸激酶来调控BLAP75的损伤反应。另外, 今后还可以进一步区分到底是ATM还是ATR或者两者一起磷酸化BLAP75。因为ATM一般被认为激活电离辐射导致的检查点阻滞的信号通路, 而ATR则被认为负责复制受阻所致的DNA损伤的信号激活[6], 所以推测在电离辐射诱导的BLAP75磷酸化中ATM有可能起着主导作用。我们的实验还发现, 在γ射线照射过的细胞中, BLAP75蛋白在细胞核中的定位发生改变, BLAP75会被招募到DNA损伤部位形成细胞核聚焦体, 这充分提示BLAP75很可能参与修复DNA损伤, 因为许多DNA修复蛋白都会被集中到细胞核聚焦体来参与DNA损伤修复, 比如, Rad51、Ku、BRCA1等等。
总之, 本研究的结果显示, 电离辐射和紫外线辐射都会在细胞和分子水平上诱导BLAP75的变化, 说明BLAP75在辐射损伤修复中具有一定的作用, 为进一步深入研究具体的机制打下了坚实的基础。
| [1] |
Meetei AR, Sechi S, Wallisch M, et al. A multiprotein nuclear complex connects Fanconi anemia and Bloom syndrome[J]. Mol Cell Biol, 2003, 23(10): 3417-3426. DOI:10.1128/MCB.23.10.3417-3426.2003 |
| [2] |
Chang M, Bellaoui M, Zhang C, et al. RMI1 /NCE4, a suppressor of genome instability, encodes a member of the RecQ helicase /Topo Ⅲ complex[J]. EMBO J, 2005, 24(11): 2024-2033. DOI:10.1038/sj.emboj.7600684 |
| [3] |
Yin J, Sobeck A, Xu C, et al. BLAP75, an essential component of Bloom's syndrome protein complexes that maintain genome integrity[J]. EMBO J, 2005, 24(7): 1465-1476. DOI:10.1038/sj.emboj.7600622 |
| [4] |
Hickson ID. RecQ helicases: caretakers of the genome[J]. Nat Rev Cancer, 2003, 3(3): 169-178. DOI:10.1038/nrc1012 |
| [5] |
Wu L, Hickson ID. The Bloom's syndrome helicase suppresses crossing over during homologous recombination[J]. Nature, 2003, 426(6968): 870-874. DOI:10.1038/nature02253 |
| [6] |
Smith J, Tho LM, Xu N, et al. The ATM - Chk2 and ATR - Chk1 pathways in DNA damage signaling and cancer[J]. Adv Cancer Res, 2010, 108: 73-112. DOI:10.1016/B978-0-12-380888-2.00003-0 |
| [7] |
Wu L, Bachrati CZ, Ou J, et al. BLAP75 /RMI1 promotes the BLM - dependent dissolution of homologous recombination intermediates[J]. Proc Natl Acad Sci USA, 2006, 103(11): 4068-4073. DOI:10.1073/pnas.0508295103 |
| [8] |
Payne M, Hickson ID. Genomic instability and cancer: lessons from analysis of Bloom's syndrome[J]. Biochem Soc Trans, 2009, 37(Pt 3): 553-559. |




