骨形态蛋白受体2(Bone morphogenetic protein receptor, type Ⅱ, BMPR2)属于生长因子受体基因, 是骨形态蛋白信号通路(BMP signaling pathway)中的关键受体蛋白, 其含量的变化将会影响到BMP通路的正常运行; 已有研究表明[1, 2], BMP不仅对多种细胞的增殖、分化、迁移、凋亡等具有调控作用, 而且在组织器官的形成、胚胎的发育及损伤组织中的修复起关键作用。本课题组在前期利用基因芯片对人肝细胞株进行辐射相关基因的筛选过程中多次发现BMPR2有异常表达[3-5]。为了进一步了解BMPR2在人肝细胞株的表达情况, 本课题组又利用SYBR Green荧光定量PCR技术对人肝细胞株不同剂量及照后不同时间点的BMPR2表达情况进行研究, 以期为肝细胞的早期损伤提供依据。
1 材料与方法 1.1 实验材料正常人肝细胞株7702购自中国科学院上海细胞所。
1.2 主要试剂及仪器RNA提取试剂盒为TIANGEN RNAprep pure Cell/Bacteria Kit; PCR扩增反转录试剂盒为PrimerScript RT Master Mix Perfect Real Time; PCR扩增试剂盒为TaKaRa SYBR Premix; 蛋白核酸测定仪(NANODROP 2000), 英国Biochmm公司; Rotor-Gene 6000荧光定量PCR仪, Corbett Life Science公司。
1.3 细胞培养正常人肝细胞株培养于含20%小牛血清和200 U/ml青霉素、200 μg/ml链霉素的RPMI-1640培养液中, 置于37℃、5% CO2的培养箱中进行培养。
1.4 细胞照射培养好的人肝细胞株经中国辐射防护研究院附属医院钴-60治疗机照射, 照射剂量率为123.19 cGy/min, 照射剂量为0.1、0.2、0.5、1.0、2.0和4.0 Gy, 误差范围在1%。
1.5 总RNA的提取及cDNA的合成经过照射的人肝细胞迅速放回37℃、5% CO2条件下继续培养, 分别于照后6 h、12 h、24 h按照TIANGEN RNAprep pure Cell/Bacteria Kit试剂盒说明提取总RNA样品, 同时提取未经照射的人肝细胞总RNA, 获得的RNA样品利用TaKaRa PrimerScript RT Master Mix Perfect Real Time试剂盒合成cDNA, 其反应条件为:经37℃反应15min, 85℃反应5sec, 随后保存于-20℃备用。
1.6 SYBR Green实时荧光定量PCR扩增采用SYBRGreen实时荧光定量PCR技术对BMPR2基因进行PCR扩增, 并以B-actin为内参控制基因; 引物序列合成委托TaKaRa公司合成; 用Rotor-Gene 6000进行实时荧光定量PCR扩增, 每样品做3个平行, 并用Rotor-Gene 6000 Series Software进行分析, 具体的扩增引物及扩增条件见表 1。
|
|
表 1 RT - PCR扩增基因及内参基因的引物序列及扩增条件 |
通过对本试验提取的RNA样品采用蛋白核酸测定仪检测其浓度与纯度。检测结果显示, RNA浓度均在490~540 ng/μL之间, D260/D280比值均在1.84~2.03之间, 表明提取的RNA样品纯度较高、无降解, 可用于下一步实验。
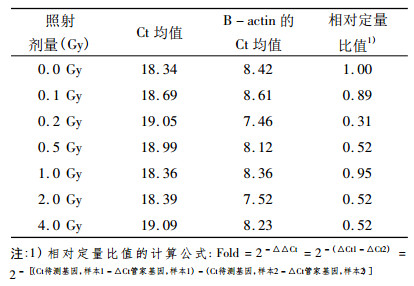
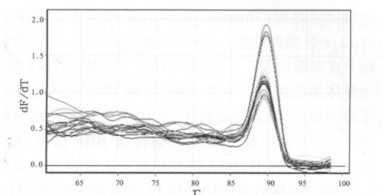
2.2 BMPR2照后6 h点的SYBR Green荧光定量PCR扩增结果通过对骨形态蛋白受体2(BMPR2)和内参基因B-actin在0.1、0.2、0.5、1.0、2.0和4.0 Gy 6个不同剂量照后6 h点的溶解曲线进行分析, 如图 1、2所示其溶解曲线均为单峰, 表明BMPR2和B- actin在照后6 h点均为特异性的扩增产物。另外通过对BMPR2和B-actin在不同剂量照后6 h点的扩增曲线(图 3、4)进行分析, 并通过相对定量比值公式进行计算, 得出如表 2所示的PCR扩增结果, 其相对定量比值均小于1, 说明BMPR2在6个不同剂量照后6 h点均表现为低表达趋势。
|
图 1 BMPR2基因照后6h点溶解曲线 |

|
图 2 管家基因B-actin照后6h点溶解曲线 |

|
图 3 BMPR2基因照后6h点扩增曲线 |
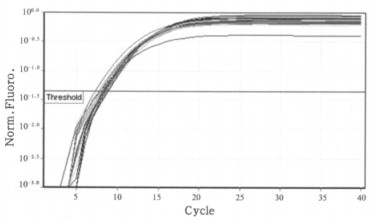
|
图 4 管家基因B-actin照后6h点扩增曲线 |
|
|
表 2 骨形态蛋白受体2(BMPR2)不同剂量点照后6 h点PCR扩增结果 |
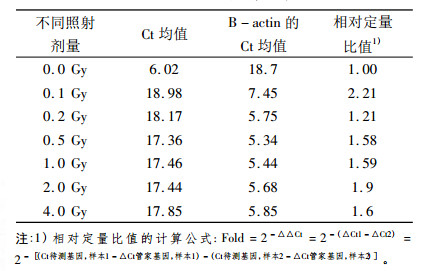
通过对骨形态蛋白受体2(BMPR2)和内参基因B-actin在0.1、0.2、0.5、1.0、2.0和4.0 Gy 6个不同剂量照后12 h点的溶解曲线进行分析, 如图 5、6所示其溶解曲线均为单峰, 表明BMPR2和B -actin在照后12 h点均为特异性的扩增产物。另外通过对BMPR2和B-actin在不同剂量照后12 h点的扩增曲线(图 7、8)进行分析, 并通过相对定量比值公式进行计算, 得出如表 3所示的PCR扩增结果, 其相对定量比值均大于1, 说明BMPR2在6个不同剂量照后12 h点均表现为高表达趋势, 与照后6 h点的表达趋势明显不同。

|
图 5 BMPR2基因照后12h点溶解曲线 |
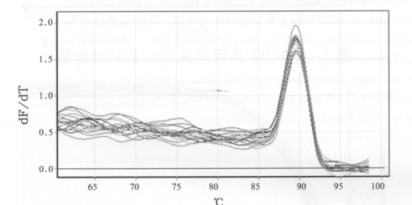
|
图 6 管家基因B-actin照后12h点溶解曲线 |
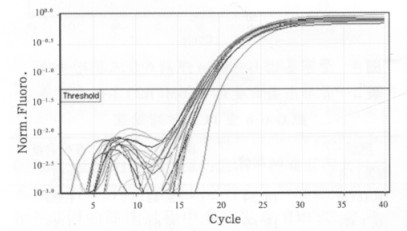
|
图 7 BMPR2基因照后12h点扩增曲线 |

|
图 8 管家基因B-actin照后12h点扩增曲线 |
|
|
表 3 骨形态蛋白受体2(BMPR2)不同剂量点照后12 h点PCR扩增结果 |
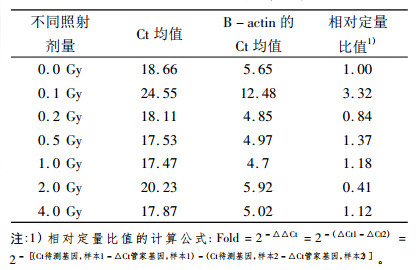
通过对骨形态蛋白受体2(BMPR2)和内参基因B-actin在0.1、0.2、0.5、1.0、2.0和4.0 Gy 6个不同剂量照后24 h点的溶解曲线进行分析, 其溶解曲线均为单峰, 表明BMPR2和B-actin在照后24 h点均为特异性的扩增产物。另外通过对BMPR2和B-actin在不同剂量照后24 h点的扩增曲线进行分析, 结果表明BMPR2在照后24 h点除个别剂量点表现为低表达趋势(0.2 Gy和2.0 Gy点), 其余剂量点均表现为高表达趋势。
|
|
表 4 骨形态蛋白受体2(BMPR2)不同剂量点照后24 h点PCR扩增结果 |
BMPR2作为骨形态蛋白信号通路(BMP signaling pathway)中的关键受体蛋白, 参与了机体许多重要的生命活动过程。Alarmo EL等[2]采用荧光定量PCR对22个乳腺癌细胞系、39个原发性乳腺癌、正常的乳腺上皮细胞系及正常乳腺癌中的7个BMP配体和6个受体情况进行了系统分析, 发现BMP配体表达水平差别较大, 但多为高表达, 而BMP受体表达水平较为一致, 提示乳腺癌细胞能够传递BMP信号; Kettunen E等[6]利用cDNA阵列和荧光定量PCR鉴定了13例鳞状细胞肺癌(SCC)和13例肺腺癌细胞(AC)中的肿瘤相关基因的表达状况, 并与正常肺组织相比, 结果发现SCC和AC中的BMPR2均出现了下调表达; Kleeff等[7]研究发现, 与正常的胰腺细胞相比, 胰腺癌细胞BMP-2、BMPR-IA、BMPR-II的mRNA表达水平均明显增加, 提示骨形态蛋白调控系统在胰腺癌的发病过程中起着重要作用; Kirk L.Lane等[8]研究认为, 先天性的肺动脉高压可能是与BMPR2的突变有关; 王韵等[9]研究发现, 肺动脉的构型重建可能与BMPR2表达量减少有关, 并成功通过氟西汀逆转BMPR2的表达预防野百合碱诱导大鼠肺动脉高压(pulmonary arterial hypertension, PAH)的发生; 张颖等[10]通过对BMPR2在CX43基因敲除胎鼠心脏近端流出道隔心肌化过程中的表达情况进行研究, 认为BMPR2可能参与心外膜和心肌细胞相互作用的分子机制, 并参与心肌细胞的成熟过程。本课题组在前期利用基因芯片对辐照后的人肝细胞进行了辐射损伤相关基因的筛选, 发现人肝细胞0.1、0.5和1.0 Gy照后24 h的基因芯片结果与本次实验扩增结果的趋势相一致, 均表现为上调表达。总之, 通过对前期的基因芯片结果和本次实验结果进行综合分析, 提示在对肝细胞进行辐照的过程中BMPR2确实参与了肝细胞损伤的调节过程, 并且随着照后时间的不同, 其表现出的调节趋势也明显不同。本研究结果将为辐射对肝细胞或肝脏损伤的作用机制提供依据, 并且还有待于从动物肝脏水平上进一步证实。
| [1] |
Petra Simic, Slobodan Vukicevic. Bone morphogenetic proteins in development and homeostasis of kidney[J]. Cytokine Growth Factor Reviews, 2005, 16(3): 299-308. DOI:10.1016/j.cytogfr.2005.02.010 |
| [2] |
Alarmo EL, Kuukasjarvi T, Karhu R, et al. A comprehensive expression survey of bone morphogenetic proteins in breast cancer highlights the importance of BMP4 and BMP7[J]. Breast Cancer Research and Treatment, 2007, 103(2): 239-246. DOI:10.1007/s10549-006-9362-1 |
| [3] |
闻建华, 李建国, 田还成, 等. 50 cGy γ射线照射人肝细胞基因差异表达谱研究[J]. 辐射防护, 2008, 28(2): 84-89. |
| [4] |
李建国, 闻建华, 段志凯, 等. 不同剂量γ射线照射人肝细胞基因差异表达谱的研究[J]. 辐射防护, 2009, 28(3): 148-152. |
| [5] |
张伟, 秦秀军, 许超琪, 等. γ射线照后不同时间点人肝细胞基因差异表达谱的研究[J]. 癌变·畸变·突变, 2011, 23(6): 416-420. DOI:10.3969/j.issn.1004-616x.2011.06.003 |
| [6] |
Kettunen E, Anttila S, Seppanen JK, et al. Differentially expressed genes in nonsmall cell lung cancer:expression profiling of cancer-related genes in squamous cell lung cancer[J]. Cancer Genetics and Cytogenetics, 2004, 149(2): 98-106. DOI:10.1016/S0165-4608(03)00300-5 |
| [7] |
Kleeff J, Maruyama H, Ishiwata T, et al. Bone morphogenetic protein 2 exerts diverse effects on cell growth in vitro and is expressed in human pancreatic cancer in vivo[J]. Gastroenterology, 1999, 116(5): 1202-1216. |
| [8] |
Lane Kirk L, Talali Megha, Austin Eric. Oxidative injury is a common consequence of BMRP2 mutations[J]. Pulmonary Circution, 2011, 1(1): 72-83. |
| [9] |
王韵, 刘明, 章新华, 等. 氟西汀对BMPR2表达的影响以及对野百合碱诱导大鼠肺动脉高压的预防作用[J]. 解剖科学进展, 2012, 18(2): 97-100. |
| [10] |
张颖, 陈伟呈, 黄国英. BMPR2在CX43基因敲除胎鼠心脏近端流出道隔心肌化过程中的表达[J]. 中华医学杂志, 2011, 91(31): 2211-2215. |