乳铁蛋白是一种非血红素铁结合性糖蛋白, 属于转铁蛋白家族[1]。1960年Groves等分别从牛乳和人乳中得到一种与铁结合的蛋白质, 其晶体呈红色, 故称之为"红蛋白"[2]。1961年Blanc等[3]从人乳中分离获得这种"红蛋白", 并正式命名为乳铁蛋白(Lactorferrin, 简写为LF)。LF是由多种哺乳动物(人类、牛、山羊、猪、马、狗、兔、小鼠等)的黏膜上皮细胞分泌的, 广泛存在于哺乳动物的乳汁中, 也存在于唾液、泪液、胰液、胆汁、阴道液、精液、鼻和咽喉分泌物、尿、羊水等分泌物中, 其中乳汁中的含量最高。人初乳中LF约6~8g/L, 人常乳中1~2g/L; 牛初乳中LF约1~2g/L, 牛常乳中0.02~0.35g/L。此外, 血液和嗜中性粒细胞中也含有微量的LF, 其中血液中的LE来自嗜中性粒细胞。最近的研究表明鱼也能产生LF, 利用分子生物技术已证实LF存在于彩虹鳟鱼中[4]。研究证实, 人乳铁蛋白能在动物和植物细胞表面中表达, 并保持一些LF活性[5]。LF具有广泛的生物学功能, 主要包括促进肠道铁的吸收、抗菌、抑菌、调节肠道菌群、抗病毒、抗氧化、抗肿瘤、免疫调节、抗辐射损伤等作用。
1 乳铁蛋白的分子结构与特性LF由一条肽链和两条多聚糖链构成, 相对分子质量约为80ku。牛和人的LF分别含有689和692个氨基酸, 其中谷氨酸、天冬氨酸、亮氨酸和丙氨酸含量较高, 除含少量半胱氨酸外, 几乎不含其他含硫氨基酸。多聚糖含量约占7%, 糖的组成有甘露糖、半乳糖、岩藻糖以及N-乙酰半乳糖胺等[6, 7]。牛和人的LF的三维结构非常相似, 69%的氨基酸序列相一致。LF的二级结构以α螺旋和β折叠为主, 两者在肽链上交替排列, 且α螺旋大大多于β折叠。LF的两端折叠形成N叶和C叶, N叶由1~332氨基酸组成, C叶由344~703氨基酸组成, 呈"二枚银杏叶型"。每个叶进一步形成两个结构域和一个裂缝, 裂缝是铁结合位点, 每个叶能结合一个Fe3+和一个CO32-或HCO3-, 此外Zn2+、Mn2+也可与LF结合。
铁离子结合到LF后会引起后者的构象变化, 使LF分子结构更加紧密。铁进入到每个叶敞开的缝隙内部, 然后此区域再相应闭合。LF的这种构象变化也解释了铁饱和LF比脱铁LF更不易变性和水解的缘故。LF具有可逆的铁结合特性, 铁结合的LF可随pH的降低而释放铁离子, 一般在pH降至6.0时开始释放铁, pH为4.0~5.0时铁释放速率最快, pH为2.5时趋于稳定, 铁完全释放。
LF的等电点为8.0~8.5, 在酸性环境下经胃蛋白酶作用N端释放一段多肽, 即乳铁蛋白肽(Lactoferricin, 简写为Lf cin)。牛乳铁蛋白肽(LfcinB)是从BLF的N端(17~41)被水解下来的25个氨基酸残基; 人乳铁蛋白肽(LfcinH)来源于HLF的1~45位氨基酸。LfcinB分子中18个氨基酸残基靠一个分子内二硫键结合而形成一个环; LfcinH分子中11与12位氨基酸残基之间的肽键断裂, 两个肽片段靠二者间的二硫键连接成为一个分子。
2 乳铁蛋白的生物学功能 2.1 促进肠道对铁离子的吸牧LF能耐受胃酸, 保持其生理活性, 而转铁蛋白不能耐受胃酸, 此时只有LF能在哺乳动物肠道中运载铁离子。LF到达肠道后能识别并特异结合小肠黏膜细胞表面的特异性乳铁蛋白受体(Lactoferrin Receptor, LfR), 进入细胞内部释放出铁离子。LF结合铁的能力约是转铁蛋白的260倍, 因而增强了机体对铁的吸收能力。机体能反馈调节铁的吸收, 当细胞内缺铁时, 细胞表面的LF受体分泌增多, 增加了LF与受体的结合机会。此外, LF和铁结合摄入能减轻铁对肠道的直接刺激作用, 同时也有助于对铁的吸收。
2.2 抑菌和杀菌现已确定, LF具有广谱的抗微生物感染的活性, 既可抑制需铁的革兰阴性菌, 如大肠菌群, 沙门氏菌等; 也可抑制革兰阳性菌和真菌, 但基本不抑制对铁需求不高的菌, 如乳酸菌、双歧杆菌。LF的抑菌效果受到多种因素影响:铁饱和度越低, 抑菌性越强, 完全饱和则没有抑菌能力; pH为7.5~8.0时抑菌效果最佳; 经过70℃以下的巴氏杀菌后抑菌活性没有影响; HCO3-浓度增加, 有利于增强抑菌性; 柠檬酸钠和阳离子浓度增加, 使抑菌活性下降[8]。
LF的杀菌作用是通过其与细菌细胞膜相互作用, 破坏细菌细胞膜, 增加细菌细胞膜的通透性, 直接起到杀菌作用。
2.3 促进双歧杆菌生长, 调整肠道菌群LF通过与铁离子的结合, 限制特定微生物的生长, 抑制或杀灭动物的多种肠道有害菌, 促进肠道有益菌的生长。研究表明, LF能促进双歧杆菌生长, 母乳喂养的婴儿肠道内双歧杆菌和乳酸杆菌数量明显多于用婴儿奶粉喂养的婴儿, 这与母乳中存在LF有直接关系[9]。Wang等[10]研究发现, 早期断奶仔猪添加乳铁蛋白1%, 能减少大肠杆菌和沙门氏杆菌的总活菌数(P<0.05), 增加结肠的乳酸菌和小肠的双歧杆菌(P<0.05), 减少有害菌的总活菌数(P<0.05)。
2.4 免疫调节LF具有增强免疫力的功能, 能够通过巨噬细胞、淋巴细胞、中性粒细胞进行机体免疫调节。当机体受到感染时, 噬中性粒细胞增多, 释放6~20倍的LF, 夺取致病菌的铁离子致使后者死亡。LF可以增强或是抑制淋巴细胞的增值。动物实验证明, LF能活化NK细胞、巨噬细胞, 促进淋巴细胞增殖, 促进抗体生成、T细胞成熟、细胞因子IL-8的释放[11]。张东送等[12]研究发现LF对小鼠脾淋巴细胞的增殖具有显著抑制作用, 且抑制程度与浓度有关, 在浓度达100μg/ml以上时, 抑制效果非常显著(P<0.001), 在浓度达1 000μg/ml时, 抑制作用最为明显。
LF还有促进巨噬细胞、中性白细胞向受伤部位的吸附和聚集的作用, 促进未成熟T细胞和B细胞的成熟, 调节免疫球蛋白分泌, 促进细胞间相互作用, 参与调节机体免疫耐受能力, 抑制补体系统激活或激活已有的补体途径等功能。
2.5 抗病毒LF对多种病毒具有抑制作用, 包括脊髓灰质炎病毒、轮状病毒、单纯疱疹病毒(HSV)、多瘤病毒、腺病毒、人免疫缺陷病毒(HIV)、人丙型肝炎病毒(HCV)、人乳头瘤病毒、人巨细胞病毒(HCMV)、乙型肝炎病毒(HBV)等。其作用机制主要有:①LF可以直接与病毒颗粒或宿主细胞分子结合, 阻止病毒颗粒对机体细胞的感染, 如, LF能与HCV囊膜蛋白E1、E2特异性结合, 阻断HCV与细胞的接触, 从而抑制HCV感染; ②通过机体的免疫反应, 诱导干扰素和白细胞介素的分泌, 增强机体防御病毒的能力。另外, LF与铁离子的饱和程度也影响抗病毒活性, 处于饱和状态的LF, 抑制病毒活性明显下降。
2.6 抗肿瘤LF对胃幽门螺杆菌感染引起的慢性胃炎、十二指肠溃疡、胃癌有很好的预防和治疗作用。另外, LF对消化道肿瘤, 如结肠癌、胃癌、肝癌、胰腺癌, 具有化学预防作用, 并可抑制肿瘤转移。LF的抗肿瘤机制主要有:①调节免疫的作用, LF可通过诱导细胞因子的产生、增加免疫细胞的数量以及增强免疫细胞的活性而提高宿主防御肿瘤的能力; ②调控致癌物代谢酶以及清除铁; ③抑制血管的发生, Norrby等[13]的研究认为LF可以抑制肿瘤的血管发生, LF在体外具有抗上皮细胞增殖的活性并且可以强烈抑制血管内皮生长因子介导的血管发生; ④抑制肿瘤细胞增殖, 研究显示, LF可阻碍体外培养的肿瘤细胞由脱氧核糖核酸(DNA)合成前期(G1期)向DNA合成期(S期)转化, 达到抑制肿瘤细胞生长的作用[14]; ⑤诱导细胞凋亡, Lee等[15]报道, LF可呈剂量-时间依赖性方式, 通过JNK/ Bcl-2途径导致半胱氨酸蛋白酶(Caspase)-9和caspase-3活化, 多聚腺苷二磷酸核糖酶(PARP)裂解, 从而诱导P53缺陷的Jurkat T淋巴细胞发生凋亡。王勇等[16]研究发现, LF在体外可显著抑制某些肿瘤细胞的生长, 并提高其辐射敏感性。
王雷等[17]研究发现, LF对口腔肿瘤细胞的生长也具有抑制作用。Mckeown[18]研究认为LF对口腔鳞癌的作用是变化的, 12.5μg/ml LF作用鳞癌细胞48 h可以引起细胞增殖, 但72 h是引起细胞死亡。大剂量(250, 100, 50μg/m1) LF 72 h均可以诱导细胞死亡。
2.7 抗氧化作用自由基是外层轨道上有不成对电子的原子、原子团或分子的总称。其中95%以上是氧自由基, 也称为活性氧, 主要有超氧阴离子自由基(O2-·)、羟自由基(·OH)、脂质自由基(LO·, LOO·)和氮氧自由基(NO·)等。通过体内的Fenton反应产生的·OH是氧化活性最强的氧自由基[19]。

|
(1) |
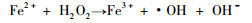
|
(2) |
在Fenton反应中Fe3+是氧自由基产生的催化剂。生物体可以通过自身的酶系统如超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶和过氧化氢酶等清除体内不断产生的自由基, 使自由基的产生和清除保持相对平衡。当机体感染或发炎时会产生大量的自由基, 自由基反应可引起细胞广泛损伤, 可引发心、脑、肝、肾等各脏器病变和衰老, 严重危害人类健康。Fe3+能加速自由基的产生, 而LF具有与Fe3+结合的能力, 因而LF可阻断Fe3+导致的脂质氧化和氧自由基的生成, 间接阻止自由基对组织的氧化损伤。另外, LF的抗氧化活性还受磷脂体系、缓冲条件、浓度以及氧化时间等的影响。
2.8 抗辐射作用1996年Shimmura等[20]通过兔紫外线(UV-B)角膜炎模型发现, 泪液中的LF在保护角膜上皮免受UV- B照射的伤害方面有重要的生理学作用。2000年Fujihara等[21]通过鼠紫外线角膜炎模型观察LF对UV-B引起的体内角膜损坏的保护效应。结果表明, 人类泪液中的LF可抑制UV-B角膜上皮损伤。
2006年日本研究人员发现, 牛奶和人类母乳中都含有的成分-LF具有防止辐射损伤的功效。研究人员将50只实验鼠分成数量相同的两组, 给其中一组的饲料中混人0.1%的LF, 持续一个月后, 用足以导致半数以上实验鼠死亡的高剂量X射线照射全部50只实验鼠。受X射线照射30d后, 未食用LF的实验鼠生存率为62%, 而食用含LF饲料的实验鼠生存率达85%。研究人员还进行了"紧急治疗实验", 用相同剂量的X射线照射另外一些未食用LF的实验鼠, 照射之后立即向实验鼠腹部注射含4mgLF的食盐水0.3ml。接受紧急治疗的这些实验鼠30天后的生存率高达90%。LF具有抗氧化作用, 可除去癌症诱因之一的活性氧。研究人员认为, LF防止辐射伤害应该也是这种抗氧化性质在起作用[22]。
2009年Ivanov等[23]用豚鼠和鼠做实验, 发现LF对急性辐射病的骨髓病变具有治疗效果; LF能减轻急性辐射病的脑部症状:延长抽搐开始时间由5.7h到14.1h, 维持正常生活时间由7.7h到15.3h。
电离辐射的损伤作用主要是由于电离辐射的间接作用, 也就是自由基对生物分子的作用引起的。自由基可造成机体细胞膜、DNA、蛋白质、脂质的损伤, 引起细胞损伤、死亡或癌变。超氧化物歧化酶(SOD)是体内重要的自由基、活性氧清除剂, 可保护细胞膜免受氧化和脂质过氧化损伤, 是放射性损害的重要指标。丙二醛(MDA)是自由基攻击生物膜引发脂质过氧化的产物, 其变化可间接反映组织自由基水平的变化。当机体遭受电离辐射伤害时会产生大量的自由基, 引起血清和肝细胞中SOD浓度降低, MDA浓度升高[24]。大量试验表明, 自由基清除剂和抗氧化剂具有抗辐射损伤的作用。赵红光等[25]研究认为, 含金属硫蛋白(MT)蛋奶粉的抗辐射损伤的作用与MT的抗氧化作用有关。LF具有抗氧化的作用, 推断LF主要是通过自身的抗氧化作用起到抗辐射损伤的作用。
2.9 其他功能LF除了具有以上功能, 还具有调控细胞增长、促进DNA合成、抑制血小板凝集、抑制胆固醇积累、抗炎症活性、抗血栓、镇痛等多种功能。
3 乳铁蛋白抗辐射作用的应用前景随着核工业与核技术的迅速发展, 放射性同位素在科研、教学、医疗、地质勘探等行业得到了日益广泛的应用, 人们暴露于电离辐射的机会也日益增多。由于放射源及核能的管理不当或操作不当导致的放射事故和核事故时有发生, 不仅造成了人员伤亡和巨大的财产损失, 对人的心理活动也会产生明显的影响, 重大的核事故使得人们承受的压力更大, 引发心理紊乱的程度也更为广泛、严重。随着核电站建设与应用的快速发展, 核电站事故导致的核辐射损伤和死亡的潜在可能性日益增大。在医疗领域, 随着X射线诊断学、介入放射学、核医学、放射肿瘤学等放射诊疗事业的迅速发展和普及, 受到医疗照射的放射工作人员、受检者与患者日益增多。这些放射诊疗设备的应用会损伤正常细胞和组织尤其是血细胞和造血系统。为了减轻和缓解辐射损伤, 辐射防护与辐射治疗剂的研究与开发显得尤为重要。LF具有抗辐射作用, 可将其开发为辐射损伤防护药, 用于核事故中受到核辐射损伤的人员和X射线诊断学、介入放射学、核医学、放射肿瘤学等放射诊疗患者的预防和治疗。同时由于LF具有绿色、安全、高效的优点, 因此LF在抗辐射损伤中的应用具有广阔的前景。
4 结束语目前LF已被作为一种高效补铁剂, 添加到婴儿配方奶粉和动物饲料中用于防治贫血, 增强免疫。临床上将LF作为抗细菌药、抗真菌药、抗病毒药等药物应用。由于我国牛奶产量较大, 牛乳LF的含量也较多, 因此生产LF的原料较丰富。我国应借鉴国外LF工业化生产的经验, 尽快实现LF生产的工业化。LF的多种生物学功能的特性和绿色、安全、高效的优点, 使其在食品、药品、饲料、抗辐射等众多领域的应用前景更加广阔。
| [1] |
Susana A, GonzálezCháve z, Sigifredo Arévalo Gallegos, et al. Lactoferrin:structure function and applications[J]. International Journal of Antimicrobial Agents, 2009, 33(301): e1301-e1308. |
| [2] |
Farnaud S, Evans RW. Lactoferrin-a multifunctional protein with antimicrobial properties[J]. Mol Immunol, 2003, 40(7): 395-405. DOI:10.1016/S0161-5890(03)00152-4 |
| [3] |
Blanc B, Isliker H. Isolation and characterization of the red siderophilic protein from maternal milk:lactotransferrin[J]. Bull Soc Chim Biol, 1961, 43: 929-943. |
| [4] |
Torres JM, Concepción JL, Vielma JR. Detección de lysozima and lactoferrin por western blot en ovas de Trucha arcoíris (Oncorhynchus mykiss[J]. Mundo Pecuario, 2006, 2: 57-59. |
| [5] |
郑月茂, 刘凤军, 何小宁, 等. 转人乳铁蛋白基因羊乳腺上皮细胞的研究[J]. 畜牧医学报, 2006, 37(12): 1 282-1 286. |
| [6] |
Haversen L, Kondori N, Baltzzer L. Structure-microbicidal activity relationship of synthetic fragments derived from the antibacterial alpha-helix of human lactoferrin[J]. Antimicrob Agents Chemother, 2010, 54(1): 418-425. DOI:10.1128/AAC.00908-09 |
| [7] |
Pauciullo A, Cosenza G, Nicodemo D. Molecular cloning, promoter analysis and SNP identification of Italian Nicastrese and Saanen lactoferrin gene[J]. Vet Immunol Immunopathol, 2010, 134(3-4): 279-283. DOI:10.1016/j.vetimm.2009.09.002 |
| [8] |
卢蓉蓉, 许时婴, 杨瑞金, 等. 乳铁蛋白抑菌活性及机理研究[J]. 食品科学, 2008, 29(2): 238-243. DOI:10.3321/j.issn:1002-6630.2008.02.047 |
| [9] |
刘红云, 童富淡. 乳铁蛋白生理功能研究现状[J]. 上海畜牧兽医通讯, 2003(3): 2-4. DOI:10.3969/j.issn.1000-7725.2003.03.001 |
| [10] |
WANG Yizhen, SHAN Tizhong, XU Zirong, et al. Effects of the lactoferrin (LF) on the growth performance, intestinal microlfora and morphology of weanling pigs[J]. Animal Feed Science and Technology, 2007, 135: 263-272. DOI:10.1016/j.anifeedsci.2006.07.013 |
| [11] |
程德勇. 乳铁蛋白对机体免疫功能的影响[J]. 临床儿科杂志, 2009, 27(2): 182-184. DOI:10.3969/j.issn.1000-3606.2009.02.024 |
| [12] |
张东送, 庞广昌, 刘萍, 等. 牛乳铁蛋白及其酶解产物对小鼠脾淋巴细胞增值的影响[J]. 营养学报, 2005, 27(3): 258-260. DOI:10.3321/j.issn:0512-7955.2005.03.024 |
| [13] |
Norrby K, Mattsby BI, Innocenti M, et al. OrallyAdministered bovine lactoferrin systemically inhibits VEGF(165)-Mediated angiogenesis in the rat[J]. Int J Cancer, 2001, 91: 236-240. DOI:10.1002/1097-0215(200002)9999:9999<::AID-IJC1024>3.3.CO;2-K |
| [14] |
Xiao Y, Monitto CL, Minhas KM, et al. Lactoferrin down-regulates G1 cyclin-dependent kinases during growth arrest of head and neck cancer cells[J]. Clin Cancer Res, 2004, 10(24): 8 683-8 686. DOI:10.1158/1078-0432.CCR-04-0988 |
| [15] |
Lee SH, Park SW, Pyo CW, et al. Requirement of the JNK-associated Bcl-2 pathway for human lactoferrin-induced apoptosis in the Jurkat leukemia T cell line[J]. Biochimie, 2009, 91(1): 102-108. DOI:10.1016/j.biochi.2008.05.004 |
| [16] |
王勇, 王彦, 杜利清, 等. 人乳铁蛋白提高H460细胞放射敏感性的初步研究[J]. 中国辐射卫生, 2009, 18(3): 265-266. |
| [17] |
王雷, 蔡研, 孙宏晨. 重组人乳铁蛋白对口腔癌细胞周期及周期因子表达影响的实验研究[J]. 口腔医学研究, 2010, 26(1): 19-21. |
| [18] |
Mckeown S, Lundy FT, Nelson J, et al. The cytotoxic effects of human neutrophil peptide-l(HNPl) and lactoferrin on oral squamous cell carcinoma(OSCC) in vitm[J]. Oral Oncology, 2006, 42: 685-690. DOI:10.1016/j.oraloncology.2005.11.005 |
| [19] |
杨芬, 张瑞萍, 贺玖明, 等. 羟自由基的产生、捕集及检测方法[J]. 药学学报, 2007, 42(7): 692-697. DOI:10.3321/j.issn:0513-4870.2007.07.002 |
| [20] |
Shimmura S, Suematsu M, Shimoyama M, et al. Subthreshold UV radiation-induced peroxide formation in cultured corneal epithelial cells:the protective effects of lactoferrin[J]. Exp-Eye-Res, 1996, 63(5): 519-526. DOI:10.1006/exer.1996.0142 |
| [21] |
Fujihara T, nagano T, Endo K, et al. Lactoferrin protects against UV-B irradiation-induced cornealepithelial damage in rats[J]. Cornea, 2000, 19(2): 207-211. DOI:10.1097/00003226-200003000-00015 |
| [22] |
日本研究发现牛奶成分可防放射伤害[J].社区医学杂志, 2006, 4(12X): 60.
|
| [23] |
Ivanov AA, Ulanova AM, Stavrakova NM, et al. Antiradiation on effect of lactoferrin[J]. Radiats Biol Radiocecol, 2009, 49(4): 456-461. |
| [24] |
涂序珉, 郑辉, 甄荣, 等. 辐射损伤后不同阶段细胞内外抗氧化酶活性和丙二醛含量变化的研究[J]. 中华放射医学与防护杂志, 2008, 28(1): 49-52. DOI:10.3760/cma.j.issn.0254-5098.2008.01.016 |
| [25] |
赵红光, 王志成, 龚平生, 等. 含金属硫蛋白蛋奶粉对辐射损伤的防护作用[J]. 中华放射医学与防护杂志, 2005, 25(4): 345-347. DOI:10.3760/cma.j.issn.0254-5098.2005.04.014 |



