2. 中国医学科学院放射医学研究所天津市分子核医学重点实验室, 天津 300192
2. Key Laboratory of Molecular Nuclear Medicine, Institute of Radiation Medicine, Chinese Academy of Medical Sciences and Peking Union Medical College, Tianjin 300192, China
食管癌发生率与死亡率位居恶性肿瘤第四位,对早、中期食管癌患者的治疗目前采用手术或放疗为主、化疗为辅的模式,晚期患者采取放化疗联合的姑息治疗。针对表皮生长因子受体(epidermal growth factor receptor,EGFR)的分子靶向药物给肿瘤的治疗带来新的希望。EGFR在人类多种实体肿瘤组织中有过度表达,其表达异常与恶性肿瘤细胞的增殖、黏附、血管形成、凋亡抑制、侵袭转移并导致放疗耐受等方面关系密切,而成为目前关注最为广泛、研究最为深入、最有前途的抗肿瘤靶点之一。食管鳞癌EGFR的表达为40% ~ 89%,属于中、高度表达。尼妥珠单抗(h-R3,泰欣生)是针对EGFR的单抗药物,能够竞争性抑制内源性配体与EGFR的结合,阻断由EGFR介导的下游信号传导通路和细胞学效应,从而抑制肿瘤细胞增殖,促进肿瘤细胞凋亡。本实验研究针对EGFR的单克隆抗体尼妥珠单抗联合13Cs γ射线照射对人食管癌细胞株Ec109生长的影响,并初步探讨其增敏机制。
1 材料与方法 1.1 细胞系及培养条件人食管癌细胞株Ec109由中国医学科学院放射医学研究所惠赠,含10%小牛血清的RPMI1640培养基,置5% CO2、饱和湿度、37℃培养箱中培养。
1.2 主要试剂和仪器尼妥珠单抗(泰欣生)由百泰生物药业有限公司惠赠,RPMI1640培养基(北京赛默飞世尔),MTT(天津华大欣源),分析纯DMSO(天津市江天化工科技),小牛血清(Gibco美国),Annexin V细胞凋亡试剂盒(天津三箭生物技术有限公司)。137Cs γ射线照射源(USD,加拿大),酶标仪(美国Thermo公司),流式细胞仪(BD FACSCalibur,由南开大学生命科学学院提供)。
1.3 分组数字随机表法分为空白对照组(不做任何处理)、h-R3组、照射组(137Csγ射线照射源4Gy照射,剂量率为0.75 Gy/min)和h-R3联合照射组(h-R3干预作用12h后进行4Gy照射)
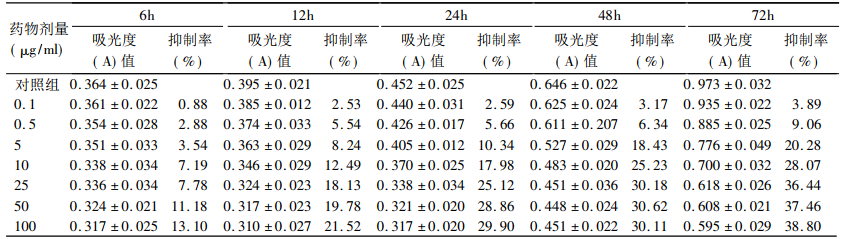
1.4 MTT测定h-R3、照射对Ec109的生长抑制作用取对数生长期Ec109细胞,8×103个/孔接种于96孔板(酶标板)中,每孔200μl,每组做6个复孔,培养24h后,更换不同浓度h - R3(0.1、0.5、5、10、25、50和100μg/ml)的培养液(均不含小牛血清),加药培养2、8、20、44和68h后每孔加入0.5% MTT液20μl,孵育4h后弃去培养液并加入150μlDMSO,振荡10min后酶标仪测定加药6、12、24、48及72h后492nm吸光度(A)值。计算细胞生长抑制率:生长抑制率(%)=(1-实验组A值/对照组A值)×100%。筛选出合适药物浓度后,设h-R3组(25μg/ml,不含血清)、照射组(4Gy照射)及联合组(25μg/ml的h-R3作用12h后给予4Gy照射),细胞个数8×103个/孔接种于96孔板,每孔200μl,每组做6个复孔,测定药物干预48h后不同组别492nm吸光度值并计算抑制率。
1.5 流式细胞仪检测细胞周期分布及细胞凋亡取对数生长期的Ec109细胞,4×105个/孔接种于6孔培养板,按上述分组处理设4组,每组设2复孔。孵育24h后,h-R3组及联合组各孔加入含25μg/ml h-R3的培养基(无血清),药物作用12h后照射组与联合组给予4Gy照射。药物作用48h后收集所有细胞,每组用冷PBS液洗涤2次,70%冰乙醇4℃固定1h后,-20℃保存过夜。检测前用冷PBS液洗涤,加入500μl碘化丙啶,轻轻混匀,避光反应30min,上流式细胞仪检测细胞周期。另取两6孔培养板,铺板、分组、各组处理同前,药物作用48h后收集各孔内培养基及细胞,PBS洗涤、离心,分别加入100μl binding Buffer,混匀后加入10μl17-AAD及5μl FITC-Annexin Ⅴ混匀,避光常温孵育15min。加入200μl FACS Buffer,30min内上流式细胞仪检测细胞凋亡。
1.6 统计学分析所有统计分析基于至少3次平行试验,应用PASW Statistics 18统计软件分析,实验数据以均数±标准差(x±s)表示,在检验数据正态分布及方差齐性的条件下,各组组间差异的比较用t检验,多组间数据用方差分析。P<0.05有统计学意义。
2 结果 2.1 h-R3对Ec109细胞的生长抑制作用不同浓度的h-R3对Ec109细胞增殖均有抑制作用,生长抑制率随浓度提高及时间延长而增加,呈剂量和时间依赖性,见表 1。
|
|
表 1 不同浓度h-R3不同时间作用下Ec109细胞生长抑制率 |
h-R3、照射及两者联合对细胞的生长抑制率见表 2。h-R3联合照射组较h-R3组、照射组对Ec109细胞抑制效应明显(F=21.08,P<0.05),结果表明h-R3与照射联合能更有效地抑制Ec109的生长,两者具有协同效应。
|
|
表 2 药物作用48h后不同实验组Ec109细胞的生长抑制率(x±s,%) |
流式细胞仪分析结果,各实验组细胞停留在G2期的细胞比例增加,联合组G2期细胞所占比例最高(F=199.51,P<0.05),G1期细胞最少。h-R3和照射都可诱导细胞的凋亡,联合组凋亡率最高,与h-R3及照射组比较具有增加凋亡的趋势(F=28.13,P<0.05),可见h-R3与照射对Ec109细胞凋亡有协同作用,见表 3。
|
|
表 3 不同实验组Ec109细胞的细胞周期及凋亡率(x±s,%) |
表皮生长因子受体(EGFR)是原癌基因C-erB-1的表达产物,生理状态下对细胞的生长和分化起调节作用,而在癌组织中的过度表达与癌细胞获得自发性增殖和失控性生长的能力、促进侵袭和转移并诱导肿瘤组织内新生血管形成有密切关系,EGFR最先被提出作为上皮起源的恶性肿瘤的靶点[1]。EGFR抑制剂h-R3是世界上第三个被批准用于治疗实体瘤的单抗药物,也是中国第一个基因工程人源化单克隆抗体。Akashi Y[2]等证明h-R3在体外和体内均能提高某些肿瘤细胞的放疗敏感性,这个作用机制可能与EGFR表达水平有关。使用EGFR抑制剂联合放疗可提高肿瘤控制率[3, 4],单独使用EGFR抑制剂也有很明显的抑瘤作用,并且副作用明显小于传统的化疗药物[5]。h-R3作用于消化道肿瘤的效率及耐受性正在临床试验评估中[6, 7]。
本实验结果显示,尼妥珠单抗作用于体外作用于Ec109细胞,可显著抑制其生长,呈剂量及时间依赖性,并与照射有一定的协同作用。EGFR的高表达可引起下游信号传导通路异常活化的激活,异常活化的EGFR通路可以改变细胞生长的特性,以EGF等配体依赖的方式促进细胞的恶性转化及肿瘤发生; 而形成的肿瘤又能以自分泌和旁分泌形式产生EGFR特异配体,从而抑制肿瘤细胞的凋亡,促进肿瘤细胞的生长、增殖。另外,EGFR可调节肿瘤细胞免疫反应对抗放射毒性,EGFR高表达的肿瘤可抵抗放射诱导的肿瘤细胞的凋亡,从而使暴露在EGFR中的肿瘤细胞受到的辐射损伤减小,对放射线不敏感[8],单克隆抗体h-R3通过与受体结合,阻滞肿瘤细胞的EGFR信号通路被异常激活,从而抑制肿瘤的生长并增加放射敏感性,放射增敏比进一步增加,所以联合组瘤细胞生长抑制率最高。
流式细胞术表明h-R3、照射使细胞阻滞于G2期,h-R3与照射联合作用后G2期升高明显,并且细胞凋亡率增加显著。G2期为DNA合成后期,是DNA合成和修复的重要时期。细胞阻滞在这一周期,一方面难以继续增殖分化,另一方面也无法修复照射引起的DNA损伤。G2期为放射敏感的时期[9],此期给予照射,对放射敏感的细胞易出现凋亡或者坏死,细胞生长抑制率及凋亡率显著升高,从而提高肿瘤细胞的放射增敏比,起到放疗增敏的作用。另外,体外照射癌细胞可引起而EGFR表达水平暂时的提高[3, 8],h-R3通过阻断TGFɑ-EGFR-MAPK信号传导通路可减少EGFR短暂高表达引起的DNA辐射损伤修复、促进细胞增殖,从而提高放射敏感性[10],增加凋亡,所以联合组凋亡率最高。
从理论上讲,靶向治疗和放疗两者相互加强,可以取得比单一方法效果更好的抑瘤效果。鉴于肿瘤信号传导是一个多途径、多因素相互影响、交叉作用的复杂系统,因此作用于EGFR靶点药物疗效的评估研究是复杂而艰巨的。本实验的结果显示h-R3体外能抑制Ec109细胞的增殖,并能提高放射的敏感性,为下一步的动物实验及临床研究提供依据。
| [1] |
Normanno N, De Luca A, Bianco C, et al. Epidermal growth factor receptor(EGFR) signaling in cancer[J]. Gene, 2006, 366(1): 2-16. |
| [2] |
Akashi Y, Okamoto I, Iwasa T, et al. Enhancement of the antitumor activity of ionising radiation by nimotuzumab, a humanised monoclonal antibody to the epidermal growth factor receptor, in non-small cell lung cancer cell lines of differing epidermal growth factor receptor status[J]. Br J Cancer, 2008, 98(4): 749-755. DOI:10.1038/sj.bjc.6604222 |
| [3] |
Nyati MK, Morgan MA, Feng FY, et al. Integration of EGFR inhibitors with radio-chemotherapy[J]. Nat Rev Cancer, 2006, 6(11): 876-885. DOI:10.1038/nrc1953 |
| [4] |
Bentzen SM, Atasoy BM, Daley FM, et al. Epidermal growth factor receptor expression in pretreatment biopsies from head and neck squamous cell carcinoma as a predictive factor for a benefit from accelerated radiation therapy in a randomized controlled trial[J]. J clin oncol, 2005, 23(24): 5560-5567. DOI:10.1200/JCO.2005.06.411 |
| [5] |
Cohen EE, Rosen F, Stadler WM, et al. Phase Ⅱ trial of ZD1839 in recurrent or metastatic squamous cell carcinoma of the head and neck[J]. J Clin Oncol, 2003, 21(10): 1980-1987. DOI:10.1200/JCO.2003.10.051 |
| [6] |
Zhao K, Hu X, Wu X, et al. Phase Ⅰ Trial of Escalating-Dose Nimotuzumab Given Weekly with Cisplatin, 5-fluorouracil (5-FU) and Concurrent Radiotherapy in Locally Advanced Esophageal Carcinoma: An interim report[J]. I. J. Radiation Oncology Biology Physics, 2010, 78(3): 323-324. |
| [7] |
Scheithauer W, Pirker R, Grünberger T, et al. VEGF and EGFR inhibition: opening a new door to cancer treatment[J]. Eur Surg, 2010, 42(1): 24-28. DOI:10.1007/s10353-010-0515-4 |
| [8] |
Akimoto T, Hunter NR, Buchmiller L, et al. Inverse relationship between epidermal growth factor receptor expression and radiocurability of murine carcinomas[J]. Clin Cancer Res, 1999, 5(10): 2884-2890. |
| [9] |
Williams JR, Zhang Y, Zhou H, et al. Genotype-dependent radiosensitivity: clonogenic survival, apoptosis and cell-cycle redistribution[J]. Int J Radiat Biol, 2008, 84(2): 151-164. DOI:10.1080/09553000701797021 |
| [10] |
Dent P, Reardon DB, Park JS, et al. Radiation-induced release of transforming growth factor α activates the epidermal growth factor receptor and mitogen-activated protein kinase pathway in carcinoma cells, leading to increased proliferation and protection from radiation-induced cell death[J]. Mol Biol Cell, 1999, 10(8): 2493-2506. DOI:10.1091/mbc.10.8.2493 |