2. 中国医学科学院放射医学研究所, 天津市分子核医学重点实验室, 天津 300192
目前,放射治疗仍然是肿瘤治疗的重要手段之一,但如何根据每个患者的肿瘤辐射敏感性确定治疗方案,避免辐射剂量过高或过低,即实现肿瘤放射治疗的个体化,仍然是放射医学工作者面临的一个重要课题。在不同个体相同器官且相同病理类型的肿瘤往往表现出不同的辐射敏感性[1],所以,对肿瘤细胞辐射敏感性的评价在临床上显得非常重要。对原代肿瘤细胞辐射敏感性的预测可以为不同患者个体提供最优化的治疗方案[2]。肿瘤放疗个体化的关键是对肿瘤本身固有辐射敏感性的检测,虽然许多实验室以检测生物标志来预测肿瘤的辐射敏感性,但尚缺乏特异性。
肿瘤细胞受到辐射后可发生DNA双链和单链断裂,DNA断裂与细胞的辐射敏感性有密切的关系[2-7]。用来评价DNA损伤的方法包括过滤洗脱法、恒定场凝胶电泳、脉冲场凝胶电泳、彗星分析等[2, 8, 9]。彗星分析又称单细胞凝胶电泳(Single Cell Gel Electrophoresis,SCGE),可以在单个细胞水平上检测DNA损伤,而且需要的样品量少,被认为是检测细胞DNA损伤和修复比较灵敏、快速、简便而很有价值的方法[10, 11]。正因为上述诸多优点,彗星分析有望作为评价肿瘤辐射敏感性的方法而用于临床[2]。
本研究采用三种肿瘤细胞株:肝癌细胞(HepG2)、食管癌细胞(EC-9706)和乳腺癌细胞(MCF-7)为研究对象,用MTT (Methyl Thiazolyl Tetrazolium)比色法和彗星分析方法分别对三种肿瘤细胞的辐射敏感性进行评价,比较,探讨多种生物学指标结合用于肿瘤细胞辐射敏感性检测的可行性。
1 材料和方法 1.1 肿瘤细胞系肝癌细胞(HepG2)、食管癌细胞(EC - 9706)和乳腺癌细胞(MCF-7)均为放射医学研究所实验室保存。
1.2 主要试剂和仪器RPMI 1 640培养基为Gibco公司产品,正常熔点和低熔点琼脂糖凝胶购自Biowest公司。低温超速离心机为日本Hitachi公司产品,MK3酶标仪为美国Thermo公司产品,水平电泳仪为BIO-RAD公司产品,Nikon90i荧光显微镜购自日本NIKON公司,图像分析系统购自美国联合科技公司。
1.3 MTT比色实验用RPMI 1 640培养基制成单细胞悬液,调整细胞密度为1×105个/ml,分装后进行137Cs γ射线照射,剂量点为0、1、2、4和8Gy,剂量率为1.23 Gy/min。将照射与未照射的细胞分别接种于96孔培养板中,每孔均接种200μl,每个剂量组设6个复孔,在37℃含5% CO2饱和湿度的培养箱中培养。3d后于终止培养前4h,每孔加入5mg/ml MTT 20μl,孵育完毕后小心吸除孔内液体,每孔加150μl DMSO,微型振荡器振荡10min,用酶标仪在492nm波长下测定各孔光吸收值(A),计数细胞存活分数(SF)=照射组A值/对照组A值。
1.4 SCGE碱性SCGE参考Banath等[9, 12]的方法。调整细胞密度为2×105/ml,采用两层凝胶法,第一层为100μl 0.75%正常熔点凝胶,放入4℃冰箱冷却固化,第二层为75μl 0.75%低熔点凝胶和25μl肿瘤细胞的混合液,4℃冰箱冷却固化; 制好的凝胶玻片浸入新配制的细胞裂解液中,于4℃冰箱裂解2h;细胞裂解后,用双蒸水浸没漂洗3次,将玻片置于碱性电泳液中解旋20min,然后电泳20min,电压20V,电流200mA; 电泳后用溴化乙啶(2μg/ml)染色,双蒸水洗去多余染液; 荧光显微镜下观察彗星图像,每份样品随机拍摄100个彗星图像。采用波兰弗罗茨瓦夫大学(Wroclaw university)提供的CASP自动分析系统[13]对所得彗星图像进行分析,选取辐射诱导的彗星尾矩(Tail Moment,TM)和Olive尾矩(Olive Tail Moment,OTM)作为分析参数。
1.5 统计学处理每份样品均设计6个平行样,n=6。实验数据以均值±标准差(x±s)表示,采用SPSS13.0软件进行单因素方差分析比较存活分数和彗星TM、OTM。
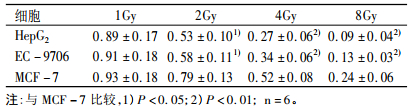
2 结果 2.1 γ射线照射后肿瘤细胞的存活分数肿瘤细胞在不同剂量照射后的存活分数,见表 1。在同一剂量HepG2的存活分数最低,MCF-7的最高,EC-9706介于二者之间。在2Gy、4Gy和8Gy照射后,HepG2和EC-9706的存活分数与MCF-7相比差异有统计学意义性(P<0.05及P<0.01),表明HepG2和EC-9706的辐射敏感性比MCF-7高,而HepG2和EC-9706的存活分数差异无统计学意义(P>0.05)。
|
|
表 1 肿瘤细胞在γ射线照射后的存活分数(x±s) |
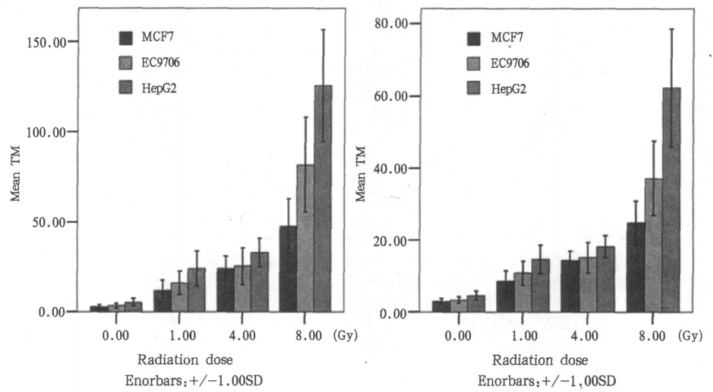
三种肿瘤细胞经0 ~ 8Gy γ射线外照射后,可引起DNA链断裂。当DNA经过解旋后,在电场的作用下,DNA断片在电泳液中离开核区域向阳极迁移,形成特征性的彗星状拖尾。三种肿瘤细胞经不同剂量照后彗星各项指标对照见图 1和图 2。由图 2可见,三种肿瘤细胞在8Gy照后表现出的辐射敏感性差别最显著。不同肿瘤细胞间各项指标的比较P值见表 2,由表 2可见,除MCF-7和EC9706细胞在4Gy照后各项指标未见统计学差异外,其余各组各项指标均表现出统计学差异。
|
图 1 三种细胞经不同剂量照后TM和OTM对照柱状图 |

|
图 2 三种细胞经不同剂量照后TM和OTM变化趋势对照图 |
|
|
表 2 不同细胞类型的彗星各项指标间两两比较P值 |
Wada[2]等观察到:对辐射敏感性肿瘤细胞和辐射不敏感性肿瘤细胞用γ射线照射,经SCGE分析后,发现二者存在显著差异,说明用该方法检测辐射引起DNA损伤的严重程度可以反映细胞对辐射的敏感性。Bacová等也发现,肿瘤细胞DNA损伤辐射敏感性之间有很好的相关性[2, 14, 15],然而,Dikomey和Olive等发现二者之间并没有相关性[8, 16],但是,值得注意的是Dikomey和Olive等采用的方法都是检测DNA双链断裂,而非单链断裂。在本研究中,采用碱性条件下的SCGE方法检测DNA单链断裂,发现肿瘤细胞经0 ~ 8Gy照射后,三种具有不同辐射敏感性的肿瘤细胞在8Gy照射后表现出的DNA断裂区别最为明显,说明该方法在较大剂量能够较大程度地反映肿瘤细胞的辐射敏感性差异。
用MTT法计算2Gy照射时的细胞存活率(SF2),被认为是比较经典可靠的判断细胞辐射敏感性的方法,只是这种方法需要细胞培养,比较耗时,所以限制了该方法在临床上的广泛应用。在本研究中,采用该方法作为对照方法。MTT方法得到的SF2越小,说明细胞对射线越敏感。本研究得出HepG2、EC-9706和MCF-7的SF2分别为0.53、0.58和0.79。HepG2的SF2最小,而MCF-7的SF2最高,表明HepG2具有较高的辐射敏感性,而MCF-7对射线的敏感性最低。同样,4Gy和8Gy照射后,HepG2和EC-9706表现出来的辐射敏感性同样比MCF-7高。SCGE方法发现,三种细胞在8Gy照射后表现出的DNA断裂区别最为明显,差别具有显著性,这说明,作为预测肿瘤细胞辐射敏感性的工具,用单个生物标志物预测辐射敏感性有一定的局限性,为了更准确地反映肿瘤内在敏感性,选取两个或多个生物标志物联合测定是明智的。这方面的工作还需要通过大量实验研究,调整照射剂量和实验条件,找到一个最佳剂量,在这个剂量点,把不同肿瘤的辐射敏感性差异在最大程度上显示出来,提高预测肿瘤细胞辐射敏感性的准确性和实用性。
| [1] |
Bergqvist M, Brattström D, Stalberg M, et al. Evaluation of radiation-induced DNA damage and DNA repair in human lung cancer cell lines with different radiosensitivity using alkaline and neutral single cell gel electrophoresis[J]. Cancer Lett, 1998, 133: 9-18. DOI:10.1016/S0304-3835(98)00178-5 |
| [2] |
Wada S, Kurahayashi H, Kobayashi Y, et al. The relationship between cellular radiosensitivity and radiation-induced DNA damage measured by the comet assay[J]. J Vet Med Sci, 2003, 65(4): 471-477. DOI:10.1292/jvms.65.471 |
| [3] |
Marcon F, Andreoli C, Rossi S, et al. Assessment of individual sensitivity to ionizing radiation and DNA repair efficiency in a healthy population[J]. Mutat Res, 2003, 541(1-2): 1-8. DOI:10.1016/S1383-5718(03)00171-2 |
| [4] |
Price ME, Mckelvey-Martin VJ, Robson T, et al. Induction and rejoining of DNA double-strand breaks in bladder tumor cells[J]. Radiat Res, 2000, 153: 788-794. DOI:10.1667/0033-7587(2000)153[0788:IARODD]2.0.CO;2 |
| [5] |
Roos WP, Binder A, Böhm L. Determination of the initial DNA damage and residual DNA damage remaining 12 hr of repair in eleven cell lines at low doses of irradiation[J]. Int J Radiat Biol, 2000, 76: 1493-1500. DOI:10.1080/09553000050176252 |
| [6] |
Ruiz de Almodóvar JM, Nú ñez MI, Mcmillan TJ, et al. Initial radiation-induced DNA damage in human tumour cell lines: a correlation with intrinsic cellular radiosensitivity[J]. Br J Cancer, 1994, 69: 457-462. DOI:10.1038/bjc.1994.83 |
| [7] |
Whitaker SJ, Ung YC, Mcmillan TJ. DNA double-strand break induction and rejoining as determinants of human tumour cell radiosensitivity[J]. Int J Radiat Biol, 1995(67): 7-18. |
| [8] |
Olive PL, Banath JP, MacPhail HS. Lack of correlation between radiosensitivity and DNA double-strand break induction or rejoining six human tumor cell lines[J]. Cancer Res, 1994, 54: 3939-3946. |
| [9] |
刘强, 姜恩海, 李进, 等. 单细胞凝胶电泳技术对离体和整体照射致细胞DNA断裂的一致性研究[J]. 中国辐射卫生, 2006, 15(2): 153-155. DOI:10.3969/j.issn.1004-714X.2006.02.012 |
| [10] |
Singh NP, Stephens RE. Microgel electrophoresis: sensitivity, mechanisms, and DNA electrostretching[J]. Mutat. Res, 1997, 387: 167-175. |
| [11] |
Schindewolf C, Lobenwein K, Trinczek K, et al. Comet assay as tool to screen for mouse model with inherited radiation sensitivity[J]. Mamm Genome, 2000, 11: 552-554. DOI:10.1007/s003350010106 |
| [12] |
Banath JP, Fushiki M, Olive PL. Rejoining of DNA single and double-strand breads in human white blood cells exposed to ionizing radiation[J]. Int J Radiat Biol, 1998, 73(6): 649-660. DOI:10.1080/095530098141906 |
| [13] |
Konca K, Lankoff A, Banasik A, et al. A cross-platform public domain PC image-analysis program for the comet assay[J]. Mutat Res, 2003, 534(1 ~ 2): 15-20. |
| [14] |
Bacová G, Hunáková L, Chorváth M, et al. Radiationinduced DNA damage and repair evaluated with 'comet assay'in human ovarian carcinoma cell lines with different radiosensitivities[J]. Neoplasma, 2000, 47: 367-374. |
| [15] |
McKelvey-Martin VJ, Ho ETS, McKeown SR, et al. Emerging applications of the single cell gel electrophoresis (comet) assay. Ⅰ. Management of invasive transitional cell human bladder carcinoma. Ⅱ. Fluorescent in situ hybridization comets for identification of damaged and repaired DNA sequence in individual cells[J]. Mutagenesis, 13, 1-8. |
| [16] |
Dikomey E and Brammer I[J]. Relationship between cellular radiosen sitivity and non-repaired double strand breaks studied for different growth states, dose rates and plating conditions in a normal human fibroblast line[J]. Int J Radiat Biol, 2000, 76: 773-781. https://www.ncbi.nlm.nih.gov/pubmed/10902731
|