2. 中国疾病预防控制中心辐射防护与核医学安全所, 北京 100088
2. National Institute for Radiological Protection, China CDC, Beijing 100088 China
目前, 国内外对颅内肿瘤的治疗多采用手术, 化疗、放疗、X刀、γ刀等。一般手术治疗后大多数脑肿瘤也难以治愈, 需要长期的其他方法的辅助治疗。同时, 生长在脑干、丘脑等重要部位的肿瘤难以手术或不能手术, 因此, 探讨其他方式的辅助治疗及其分子, 是提高肿瘤患者生存率的重要理论基础。
ErbB2(erythroblasticleukemia viral oncogene homolog 2)又称HER2或neu, 属于受体酪氨酸激酶, 编码分子量为185 kD的跨膜蛋白p185, 是一种与肿瘤发生发展密切相关的原癌基因。ErbB2定位于17q21, 具有细胞内酪氨酸激酶样活性, 与人类表皮生长因子受体具有高度的同源性, 具有很强的转化能力和致癌性[1]。ErbB2激活的方式有非配体和配体两种, 当ErbB2基因扩增和蛋白过表达时, 不需配体激活, 直接诱导ErbB2形成同二聚体或异二聚体, 活化受体酪氨酸激酶, 激活下游信号通路, 促进肿瘤细胞的增殖和侵袭转移[2]。目前干预和阻断ErbB2分子信号转导已成为一种治疗各种肿瘤的有效策略[3-5]。
本实验室前期的体内外实验研究表明:脑胶质瘤细胞ErbB2 RNAi后, 脑胶质瘤细胞的增殖能力受到显著抑制, 同时引发线粒体膜电位降低, 进而启动线粒体依赖途径凋亡[6, 7]。本研究进一步探讨ErbB2RNAi对脑胶质瘤U251细胞活性氧含量DNA损伤以及细胞周期的影响, 从而进一步揭示ErbB2 RNAi抑制脑肿瘤细胞增殖的分子机制。
1 材料与方法 1.1 试剂和材料特级胎牛血清购自元亨圣马公司; DMEM培养基购自美国Gibco公司; 转染试剂Lipofectamine2000购自美国Invitrogen公司; 活性氧测定探针2', 7'双氢-二氯乙酰乙酸盐荧光素(DCFH-DA)购自美国Sigma公司; 丙二醛(MDA)测试盒购自中国南京建成公司; 低熔点琼脂糖(LMA)和正常熔点琼脂糖(NMA)均购自美国Sigma公司。
1.2 方法 1.2.1 细胞培养人U251细胞购自协和细胞库, 用含有10%灭活胎牛血清、100U/ml青霉素、100μg/ml链霉素的DMEM培养液培养。
1.2.2 60Co γ射线照射细胞利用军事医学科学院钴源, 剂量率214.47cGy/min, 钴源距细胞生长面4 m, 均匀照射野的大小为50 cm × 50 cm, 剂量8Gy照射细胞。
1.2.3 细胞基因转染转染前1天, 将对数生长期的U251细胞2 × 105个接种于12孔培养板, 细胞融合达90%时将ErbB2 RNAi载体(pSilencer2.1-ErbB2, 简称ErbB2)或阴性对照(pSi lencer2.1-GFP, 简称GFP)进行转染, 方法参照Lipo fectamine2000产品说明书。
1.2.4 活性氧(ROS)检测基因转染一定时间后, 收集细胞, 用100μl含5μg/ml浓度DCFH-DA探针的PBS重悬细胞, 37℃、5% CO2的培养箱中避光孵育20min; 离心去除上清并用PBS洗涤两次, 用400μl PBS重悬细胞, 流式细胞仪(BD)检测。
1.2.5 丙二醛(MDA)水平检测按MDA说明书配置检测体系中的标准品、无水乙醇、测试样品; 蜗旋混匀器混匀, 试管口用保鲜膜扎紧, 用针头刺一个小孔, 95℃水浴40min, 取出后流水冷却, 然后3 500 r/min离心10 min, 取上清0.2 ml, 用荧光化学发光分析仪测定532nm处吸光值。
1.2.6 单细胞凝胶电泳(SCGE)① 收集转染或照射后的细胞, 用D-Hanks液配成1 × 105/ml悬液。②制备胶版:取100μl 1% NMA铺于60℃预热的载玻片磨沙面, 盖上盖玻片, 室温凝固10 min, 取下盖玻片; 取40μl细胞悬液与100μl 0.65% LMA溶液混匀, 取60μl滴在第一层琼脂糖上, 加盖玻片室温凝固10 min, 为第二层胶; 取下盖玻片, 在第二层胶上滴加60μl 0.65% LMA, 加盖玻片凝固。③细胞裂解与电泳:揭盖玻片后, 将胶板浸入细胞裂解液中, 4℃1h;用PBS冲洗2次; 将载玻片置于电泳槽中的碱性电泳缓冲液中裂解20 min; 4℃电泳20 min(25V, 300mA)。④中和与染色:取出载玻片, 用PBS冲洗2次, 将载有胶板的玻片浸入中和液中15 min; 每片载玻片上滴加50μlPI染色15 min, 蒸馏水洗1次, 盖上盖玻片, 荧光显微镜观察。
1.2.7 细胞周期测定于转染后不同时间点利用胰蛋白酶溶液消化U251细胞, PBS溶液洗涤3次。用0.3 ml含5% FCS的PBS悬浮细胞, 再加入0.7 ml无水乙醇, 混匀后置于-20℃固定过夜。PBS离心洗涤2次, 加入200μ1RNase A(1 mg/ml), 37℃水浴30 min; 加入50 μg/ml的PI染液400μ1, 20 min后上流式细胞仪分析。
1.2.8 统计学方法两组之间的比较采用ANOVA方差分析, 应用SPSS12.0统计软件进行数据分析, P<0.05为差异有统计学意义。
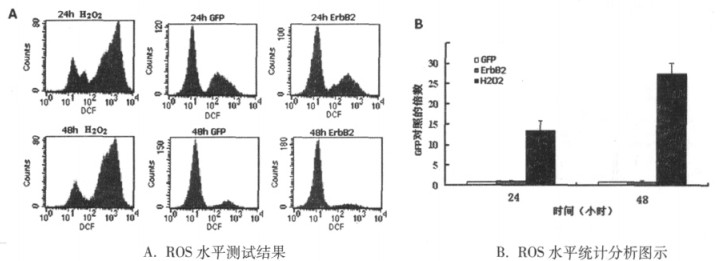
2 结果 2.1 U251细胞转染pSilencer2.1-ErbB2后不同时间点细胞内ROS水平DCFH-DA为探针, 流式细胞仪检测U251细胞转染pSilencer2.1-ErbB2和pSilencer2.1-GFP干涉载体后24 h和48 h时细胞内ROS水平; 由于H2O2可引发活性氧升高, 因此以H2O2 (100μmol/l)处理组细胞作为阳性对照。结果如图 1A所示, 统计分析(图 1B)表明, U251细胞在转染pSilenc er2.1-ErbB2后48 h内, 细胞内ROS水平无显著性变化。
|
图 1 U251细胞转染pSilencer2.1-STAT3不同时间点细胞内ROS水平 |
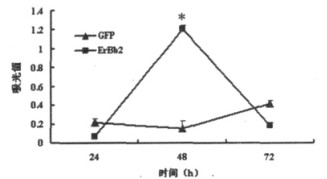
U251细胞在ErbB2 RNAi后24 h、48 h和72 h时细胞内MDA水平如图 2所示, U251细胞在转染psilencer2.1 - ErbB2后24h时, MDA水平无显著变化, 而在48h时显著性升高(P<0.05), 72h时又恢复到正常水平。
|
图 2 U251细胞转染pSilencer2.1-ErbB2不同时间点细胞内MDA水平 |
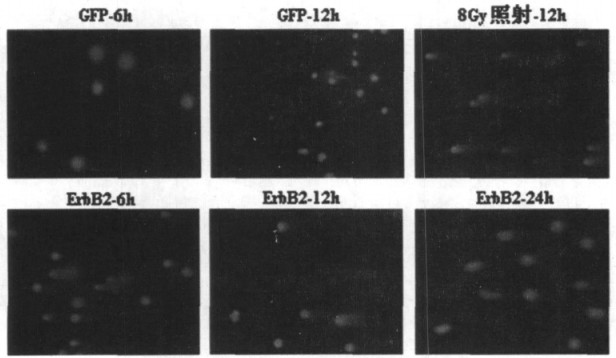
如图 3所示, 8Gy照射组为阳性对照, 可见到所有细胞均出现明显的拖尾现象。U251细胞转染pSilencer2.1-ErbB2后, 6h时可检测到有部分细胞出现拖尾现象, 即部分细胞出现基因组DNA双链断裂损伤, 12h后可见DNA损伤有所修复, 24h后基本完全修复。
|
图 3 U251细胞转染pSilencer2.1-ErbB2后不同时间点单细胞凝胶电泳结果 |
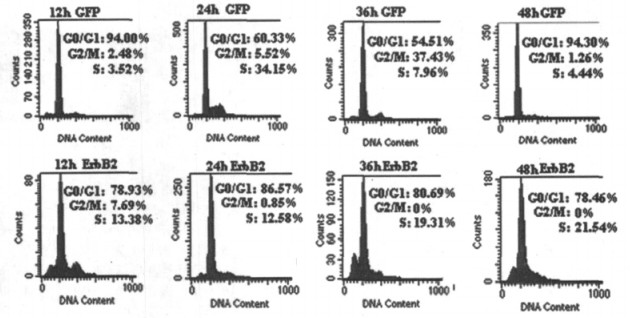
U251细胞转染pSilencer2.1-ErbB2不同时间点细胞各时相分布如图 4所示。转染12h后与对照比较, pSilencer2.1 - ErbB2转染组S期阻滞9.86%, G2/M期阻滞5.08%;转染24h时, pSilencer2.1-ErbB2 G0/G1期阻滞26.24%;转染36h时, pSilencer2.1-ErbB2 S期阻滞11.35%。
|
图 4 U251细胞转染pSilencer2.1-ErbB2细胞周期 |
在前期的研究工作中我们证明ErbB2干涉后会启动U251细胞发生线粒体依赖途径的凋亡[6]。在本研究中我们进一步发现U251细胞ErbB2表达抑制后, 细胞内MDA水平显著升高, 并诱导DNA损伤及出现修复过程。同时ErbB2 RNAi后, 细胞周期各时项发生改变, 依次出现S期和G2/M期以及G0/ G1期阻滞。
氧化还原反应是生物体内普遍存在并且十分重要的生物化学反应。氧化剂与抗氧化/还原剂各自的活性与相互间的比例决定细胞内的氧化还原状态。而细胞内氧化还原状态改变则与细胞凋亡密切相关。在本研究中, 我们观察到ErbB2表达抑制后U251细胞出现MDA水平升高。MDA是膜脂过氧化最重要的产物之一, 通常可通过测定MDA的水平了解膜脂过氧化的程度, 以间接测定膜系统受损程度。膜系统的损伤, 尤其是线粒体膜损伤是启动细胞凋亡的关键诱因。结合课题组前期研究结果, 提示MDA升高可能参与了ErbB2表达抑制诱导的U251细胞凋亡过程。
环境中一些物理的、化学的以及机体自身代谢生成的基因改变均有可能引发染色体损伤。机体长期进化中发展了一整套DNA损伤反应防御系统, 能迅速识别损伤, 激活细胞周期检查点, 引发周期阻滞来为细胞提供修复损伤的时间; 如损伤不能修复或不能正确修复, 则启动凋亡程序, 清除有损伤或病变倾向细胞[8]。本研究中, 我们观察到U251细胞ErbB2 RNAi后很快就出现细胞DNA损伤, 并进一步观察到细胞周期阻滞的出现。这可能是细胞识别到DNA损伤后开始启动DNA修复的结果。细胞周期阻滞是肿瘤细胞对电离辐射做出的一种适应性反应[9-11]。U251细胞在ErbB2干涉后, 首先出现S期阻滞, 之后出现G2/M期和G0/G1期阻滞。S期为DNA合成期, S期阻滞意味着DNA合成速度的减慢, 以便赢得时间充分修复辐射导致的DNA损伤。对于未能修复的细胞, 接下来的G2/M期阻滞, 将能对断裂的DNA双链以重组方式继续进行修复。确保细胞染色体组的完整性和稳定性, 减少突变的发生。
| [1] |
Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer:correlation of relapse and survival with amplification of the HER-2/neu oncogene[J]. Science, 1987, 235(4785): 177-182. DOI:10.1126/science.3798106 |
| [2] |
Cuiling M, Hong L, Stephen S, et al. Overexpress of ErbB2 ethanol-stimulated intr ∞ ellular signaling and invasion of human mammary epithelial and breast cancer cells in vitro[J]. Oncogene, 2003, 34(22): 5 281-5 290. |
| [3] |
Tsai M S, Shaman-Taylor L A, Mehmi I, et al. Blockage of heregulin expression inhibits tumorigenicity and metastaaia of breast cancer[J]. Oncogene, 2003, 22(5): 761-769. DOI:10.1038/sj.onc.1206130 |
| [4] |
高玲, 李峰生, 陈肖华, 等. 以ErBb2为靶标RNA干涉联合60Coγ照射对U251细胞凋亡的影响[J]. 辐射研究与辐射工艺学报, 2007, 25(5): 302-307. DOI:10.3969/j.issn.1000-3436.2007.05.011 |
| [5] |
Xiaohua Liu, Yincheng Zhang, Wenhao Ren, et al. RNAi knockdown of C-erbB2 expression inhibits salivary gland adenoid cystic carcinoma SACC-83 cell growth in vitro[J]. Journal of Biomedical Research, 2010, 24(3): 215-222. DOI:10.1016/S1674-8301(10)60031-0 |
| [6] |
Gao L, Li FS, Dong B, et al. Inhibition of STAT3 and ErbB2 suppresses tumor growth, enhances radiosensitivity and induces mitochondria-dependent apoptosis in glioma cells[J]. Int J Radiat Oncol Biol Phys, 2010, 77(4): 1 223-1 231. DOI:10.1016/j.ijrobp.2009.12.036 |
| [7] |
高玲, 李峰生, 董波, 等. STAT3 RNAi联合射线照射对U251细胞增殖的影响[J]. 中华放射医学与防护杂志, 2008, 28(1): 17-20. DOI:10.3760/cma.j.issn.0254-5098.2008.01.005 |
| [8] |
宋宜, 孙志贤. DNA双链断裂损伤反应及它的医学意义[J]. 生物化学与生物物理进展, 2007, 34(9): 929-934. DOI:10.3321/j.issn:1000-3282.2007.09.005 |
| [9] |
Forman HJ, Torres M. Reactive oxygen species and cell signaling:respiratory burst in macrophage signaling[J]. Am J Respir Crit Care Med, 2002, 166(12-2): S4-8. |
| [10] |
Calvino-Fernández M, Benito-Martínez S, Parra-Cid T. Oxidative stress by Helicobacter pylori causes apoptosis through mitochondrial pathway in gastric epithelial cells[J]. Apoptosis, 2008, 13(10): 1 267-1 280. DOI:10.1007/s10495-008-0255-0 |
| [11] |
O'Brien KA, Muscarella DE, Bloom SE. Differential induction of apoptosis and MAP kinase signaling by mitochondrial toxicants in drug-sensitive compared to drug-resistant B -lineage lymphoid cell lines[J]. Toxicol Appl Pharmacol, 2001, 174(3): 245-256. DOI:10.1006/taap.2001.9215 |




