2. 苏州大学放射医学与公共卫生学院放射生物学教研室, 江苏 苏州 215123
肝细胞癌具有手术切除后复发率高, 对化疗和放疗不敏感等特点, 提高其治疗效果一直是肿瘤研究的热点。Survivin是凋亡抑制蛋白家族中的一员, 在转化细胞系和大多数人类肿瘤组织中高表达, 而在癌旁组织和成人分化组织中不表达。Survivin能抑制细胞凋亡和调控有丝分裂, 提高肿瘤细胞放射抗性[1]。本研究在已成功构建靶向Survivin基因的RNA干扰载体, 并检测其联合X射线照射对人肝癌细胞SMMC-7721的体外抑瘤效应的基础上[2], 进一步探讨RNA干扰Survivin基因联合放射治疗对裸鼠移植人肝癌的体内抑瘤效应及机制。
1 材料与方法 1.1 实验材料人肝癌细胞株SMMC-7721为本室保存, 以含10%胎牛血清的RPMI1640培养液于37℃、5%CO2培养箱中常规培养; Survivin干扰载体pGenesil-survivin由本室构建并保存; 胎牛血清、RPMI1640培养基购自Gibco公司; 阳离子脂质体lipofectamine2000购自invitrogen公司; UltraSensitiveTMS-P(MAIXIN-Bio)免疫组化试剂盒购自福州迈新生物技术公司; 兔抗人Survivin单克隆抗体为美国Santa Cruz公司产品; 小鼠抗人PCNA单克隆抗体和TUNEL细胞凋亡原位检测试剂盒购自南京凯基生物科技发展有限公司; 兔抗鼠CD34单克隆抗体为美国eBioscience公司产品。
1.2 实验方法 1.2.1 荷瘤裸鼠模型的建立及分组Balb/c裸鼠, 雌性, 6~8周龄, 健康, 购自上海生命科学研究院实验动物中心。于每只小鼠右后肢皮下接种0.1ml浓度为5×106/ml的SMMC-7721细胞悬液, 待肿瘤生长至直径约5mm时, 将动物随机分组:①对照组(Control); ②RNA干扰组(pGenesil-survivin); ③放疗组(5Gy); ④RNA干扰联合放疗组(pGenesil-survivin+5Gy)。分组后第1天和第4天, 对照组注射0.1mlPBS, 治疗组每只裸鼠肿瘤局部注射0.1ml质粒溶液(50μg质粒+100μg阳离子脂质体), 于第3天和第6天肿瘤局部给予两次5GyX射线照射, 其他部位铅板屏蔽。观察各组小鼠治疗开始后不同时间肿瘤体积和平均存活时间。
1.2.2 照射条件德国西门子医用直线加速器, 6MVX射线, 球靶距100cm, 剂量率2Gy/min。
1.2.3 肿瘤体积测定用游标卡尺测量肿瘤最长径(L)和垂直方向最大横径(W), 每3d测量1次, 肿瘤体积V=LW2/2。
1.2.4 免疫组化检测移植瘤组织Survivin和PCNA表达治疗结束后1d杀鼠, 取肿瘤组织, 按常规方法制作病理切片, HE染色, 在光镜下检查肿瘤组织结构, 利用UltraSensitiveTM S-P(MAIXIN-Bio)试剂盒按操作说明进行免疫组化染色, 相应一抗为Survivin和PCNA抗体。每例随机观察9个高倍视野(×400), 计数每个视野中阳性细胞百分数。
1.2.5 移植瘤组织细胞凋亡检测移植瘤组织依照TUNEL细胞凋亡原位检测试剂盒说明书标记细胞, 每例随机观察9个高倍视野(×400), 计数每个视野中阳性细胞百分数。
1.2.6 移植瘤组织微血管密度检测以CD34单抗为一抗对瘤组织进行免疫组化染色, 光镜下观察肿瘤血管内皮细胞染色情况, 单个内皮细胞着色(棕黄)即作为一个计数单位, 不以是否形成血管管腔或管腔内是否有红细胞作为计数标准, 计数每例肿瘤组织单位视野内的平均血管数, 即肿瘤间质微血管密度(Intratumoral micro-vessel density, IMVD)。每例随机观察9个高倍视野(×400), 计数每个视野内100个细胞中的阳性细胞数。
1.2.7 统计学分析实验结果用SPSS14.0统计软件进行分析, 采用单因素方差分析进行检验, P < 0.05表示有统计学意义。
2 结果 2.1 沉默survivin基因联合X射线照射对裸鼠移植人肝癌的生长抑制效应治疗开始后不同时间点测量各组裸鼠肿瘤体积, 结果见图 1, 第3~21天, RNA干扰联合放疗组肿瘤体积明显低于对照组(P < 0.001)、RNA干扰组(P < 0.05或P < 0.01)和放疗组(P < 0.05或P < 0.01), 第21天, RNA干扰组、放疗组和RNA干扰联合放疗组抑瘤率分别为45.89%、41.30%和59.26%。

|
图 1 治疗后不同时间各组裸鼠肿瘤体积 |
观察各组动物存活情况, 结果见表 1, RNA干扰组、放疗组和RNA干扰联合放疗组裸鼠平均存活时间明显长于对照组(P < 0.001), RNA干扰联合放疗组裸鼠平均存活时间最长, 明显长于RNA干扰组(P < 0.001)和放疗组(P < 0.001)。
|
|
表 1 各组裸鼠平均存活时间 |
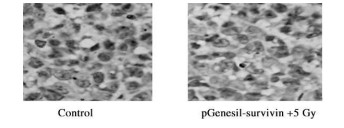
以免疫组化染色法检测各组裸鼠肿瘤组织Survivin的表达水平, 胞浆和/或胞核内含棕黄色颗粒为阳性, 结果见图 2和表 2, 各治疗组Survivin表达水平明显低于对照组(P < 0.05或P < 0.01), RNA干扰联合放疗组survivin表达水平最低, 但与RNA干扰组相比无明显统计学差异。
|
图 2 免疫组化染色法检测裸鼠肿瘤组织Survivin的表达 |
|
|
表 2 各组裸鼠肿瘤组织Survivin的表达 |
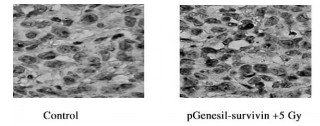
以肿瘤组织PCNA表达水平为指标检测各组裸鼠移植人肝癌的体内增殖活性, 胞核染成深棕色为阳性, 结果见图 3和表 3, 各治疗组PCNA表达水平明显低于对照组(P < 0.05, P < 0.01或P < 0.001), RNA干扰联合放疗组PCNA表达水平最低.
|
图 3 免疫组化染色法检测裸鼠肿瘤组织PCNA的表达 |
|
|
表 3 各组裸鼠肿瘤组织PCNA的表达 |
TUNEL法检测各组裸鼠移植人肝癌细胞凋亡, 胞核染成棕黄色为阳性, 结果见图 4和表 4, 各治疗组凋亡细胞百分数明显高于对照组(P < 0.001), RNA干扰联合放疗组凋亡细胞百分数最高。

|
图 4 TUNEL法检测裸鼠肝癌细胞凋亡 |
|
|
表 4 各组裸鼠移植人肝癌细胞凋亡的变化 |
各组裸鼠肿瘤组织微血管密度检测结果见图 5和表 5, 各治疗组裸鼠肿瘤组织微血管密度明显低于对照组(P < 0.05, P < 0.01或P < 0.01), RNA干扰联合放疗组肿瘤组织微血管密度最低。

|
图 5 免疫组化染色法检测裸鼠肿瘤组织微血管密度 |
|
|
表 5 各组裸鼠肿瘤组织微血管密度 |
RNA干扰技术是利用具有同源性的双链RNA诱导序列特异的目标基因转录后沉默, 抑制其蛋白表达和生物学活性, 具有特异、高效等特点, 在肿瘤基因治疗方面显示出巨大的潜力[3]。
Survivin是凋亡抑制蛋白家族分子量最小的成员, 主要通过直接抑制凋亡信号传导途径中最下游的效应分子caspase-3和caspase-7的活性而发挥抑凋亡作用, Survivin还与微管蛋白相互作用调控细胞有丝分裂以及参与血管形成[4, 5]。由于Survivin特异性表达于恶性肿瘤组织且具有强大的抑制凋亡活性, 已成为倍受关注的抗肿瘤治疗的靶点[6]。
本实验以脂质体包裹的siRNA表达质粒为基因治疗载体, 采取瘤体内多点注射方式, 探讨RNA干扰Survivin基因联合放射治疗对裸鼠移植人肝癌的抑瘤效应及其机制。结果表明, 从治疗开始后第3天起, RNA干扰联合放疗组肿瘤体积明显低于对照组、RNA干扰组和放疗组, 且RNA干扰联合放疗组裸鼠平均存活时间最长, 明显长于RNA干扰组和放疗组。治疗结束后第1天, RNA干扰联合放疗组裸鼠肿瘤增殖活性和微血管密度明显低于RNA干扰组和放疗组, 且凋亡细胞百分数明显升高, 提示靶向Survivin基因的RNA干扰治疗联合放疗体内抑瘤效应明显优于单纯RNA干扰治疗或放射治疗, 其抑瘤效应机制可能是协同发挥放疗和RNA干扰治疗两者对肿瘤细胞的抗增殖、促凋亡和抑制血管生成作用。本研究结果提示, 以Survivin基因为靶点的RNA干扰治疗联合放疗可明显提高人肝细胞癌的治疗效果, 该综合治疗模式值得深入研究。
| [1] |
Altieri DC. Survivin, cancer networks and pathway-directed drug discovery[J]. Nat Rev Cancer, 2008, 8(1): 61-70. |
| [2] |
杨巍, 李艳博, 赵敬国, 等. 沉默乏氧诱导因子-1α和生存素基因联合X射线照射对乏氧细胞的体外抑瘤效应[J]. 辐射研究与辐射工艺学报, 2009, 27(2): 120-124. DOI:10.3969/j.issn.1000-3436.2009.02.012 |
| [3] |
Aagaard L, Rossi JJ. RNA itherapeutics:principles, prospects andchallenges[J]. Adv Drug Deliv Rev, 2007, 59(2-3): 75-86. DOI:10.1016/j.addr.2007.03.005 |
| [4] |
Kappler M, Taubert H, Bartel F, et al. Radio sensitization, after acombined treatment of survivin siRNA and irradiation, is correlated with the activation of caspases 3 and 7 in a wt-p53 sarcoma cell line, but not in a mt-p53 sarcoma cell line[J]. Oncol Rep, 2005, 13(1): 167-172. |
| [5] |
Roedel F, Frey B, Leitmann W, et al. Survivin antisense oligonucleotides effectively radiosensitize colorectal cancer cells in both tissue culture and murine xenograftmodels[J]. Int J Radiat Oncol Biol Phys, 2008, 71(1): 247-255. DOI:10.1016/j.ijrobp.2008.02.011 |
| [6] |
Song H, Xin XY, Xiao F, et al. Survivin gene RNA interference inhibits proliferation, induces apoptosis, and enhances rad iosensitivity in He La cells[J]. Eur JObstet Gynecol Reprod Biol, 2008, 136(1): 83-89. |