2. 天津市商业大学, 天津市食品与生物技术重点实验室;
3. 中国医学科学院, 北京协和医学院放射医学研究所, 天津市分子核医学重点实验室;
4. 天津昂赛细胞基因工程有限公司, 细胞产品国家工程研究中心
根据国内外急性放射病救治的统计资料表明, 受照6Gy以下的患者, 绝大多数可以获得满意的治疗效果。但是, 受照≥6Gy的患者者仅有少数存活, 而受照≥8Gy的患者者无一例活存。因此, 对急性放射病临床救治, 摆在我们面前的一个重要课题, 就是要大力开展极重度骨髓型与肠型放射病的研究[1]。近年来, 间充质干细胞(Mesenchymal stem cells, MSC)以其独特的生物学特性受到学者们青睐, 它是一种成体干细胞, 具有多向分化能力。近期研究显示[2], 骨髓来源的MSC能够在移植后准确定位于损伤部位, 促进损伤部位的愈合。如果将MSCs应用于急性辐射损伤的临床治疗, MSC同样将会发挥重要作用。笔者将主要探讨脐带间充质干细胞移植对小鼠肠道辐射损伤的治疗作用, 为人急性肠型放射病的治疗寻找可靠的供体来源。
1 材料与方法 1.1 NOD-SCID鼠急性肠型放射病模型的建立雌性NOD -SCID鼠(6~8周, 16.5~19.0g, 中国医学科学院实验动物研究所)饲养于SPF级层流架中。消毒后的酸化水、鼠食喂养。参考文献[3]记载的方法建立肠型放射病的动物模型。实验组动物给予137Csγ射线(加拿大原子能公司)预先腹部照射4.5Gy, 然后给予3.5Gy全身照射。之后每天观察小鼠变化及大便情况, 每周称重并测量便潜血。在4 w后随机选1只造模鼠处死, 取肠道标本制作石蜡切片和H.E染色。
1.2 人间充质干细胞体外诱导多向分化体外诱导脂肪分化:人脐带MSC以6×104/孔接种于24孔板, 每孔体系为1 ml, 置5%CO2, 37 ℃培养箱(Thermo 8000)培养。当细胞100%融合, 吸弃培养基, 每孔添加0.5~1 ml脂肪诱导培养基, 开始记录为脂肪分化第1天, 在第7、8、15、16天更换为脂肪维持培养基, 其余时间均为脂肪诱导培养基, 诱导分化21d后, 吸弃培养基, 4%多聚甲醛固定, 1×P BS洗涤3次, 加入油红-O, 覆盖细胞, 室温孵育50 min, 吸弃油红-O, 双蒸水洗涤3次, 苏木精复染5~15 min, 双蒸水洗涤3次, 镜检。结果判定:诱导培养7d, 镜下可见胞浆内脂滴形成, 第21天油红-O染色呈强阳性。
体外诱导成骨分化:用1×PBS分别稀释vitronectin和Ⅰ型胶原, 使终浓度为12 μg /ml。24孔板每孔添加0. 5 mlvitronectin和Ⅰ型胶原(1:1)混合物, 室温孵育过夜。第2天吸弃, 用1 ×PBS洗涤一次备用。以6×104 /孔浓度将脐带MSC加入经vitronectin和Ⅰ型胶原包被的24孔板中, 每孔体系为1 ml。置5%CO2, 37 ℃培养箱培养。当细胞100%融合, 吸弃培养基, 每孔加1ml成骨诱导培养基, 开始记录为成骨分化第1天。每2~3d更换新鲜成骨诱导培养基。诱导分化14~17 d后, 吸弃培养基, 4%多聚甲醛固定, 吸弃固定液, 1×PBS洗涤3次, Von -Kossa染色(5%硝酸银浸泡细胞2h, 紫外线照射1 h, 双蒸水冲洗2 min, 5%硫代硫酸钠中和残留的硝酸银, 充分水洗), 镜检。结果判定:成骨诱导第14天实验组可见细胞间布满黑色颗粒, 颗粒大小不均一, 提示有矿化基质沉积。
1.3 细胞移植、移植细胞示踪人脐带MSC由细胞产品国家工程研究中心赠送。造模鼠移植人脐带MSC, 治疗组经尾静脉注射200 μl预先标记CM-DiI(Molecular Probes)的1×106人脐带MSC, 对照组注射等量PBS。治疗组6只, 对照组6只。之后每天观察小鼠变化及大便情况, 每周称重并测量便潜血。在细胞移植后5~6 w, 取肠道和其他脏器组织, 追踪移植细胞的去向。液氮固定后作5 μm冰冻切片, 共聚焦显微镜(Laica)观察为移植细胞是否在肠粘膜内定植。
1.4 移植后模型小鼠一般状况和肠道组织学监测模型鼠的一般状况评估:疾病活动指数(DAI)评价参考文献[4]的标准(表 1)。
|
|
表 1 模型鼠的评估鉴定DAI评价参考标准 |
肠道组织学监测评分:采集模型鼠结肠组织, 10%福尔马林固定, 乙醇脱水, 石蜡包埋, 组织切片用HE染色, 中性树脂封片。按文献[5, 6]中的标准(正常结肠粘膜0, 极轻度炎症1, 轻度炎症2, 中度炎症3, 重度炎症, 伴单核细胞浸润, 隐窝延长, 隐窝脓肿形成, 杯状细胞缺失, 肠壁增厚4分)采用单盲双人评分法评分, 确保实验结果评价准确、客观。
1.5 统计学分析用SPSS13.0软件进行统计分析, 组间统计处理用t检验或方差分析, 计数资料用Fisher's精确概率检验分析, P<0.05作为差别有统计学意义的标准。
2 结果 2.1 人间充质干细胞体外诱导的多向分化为证实人MSC多向分化能力, 在体外尝试诱导其向多种组织分化。结果显示MSC在体外能分化成和脂肪细胞(图 1)。

|
图 1 MSC体外培养分化成脂肪组织(左,油红-O染色),骨组织(右, Von-Kossa染色) |
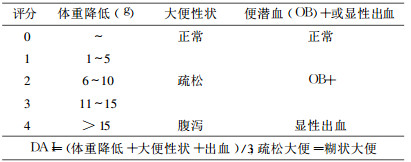
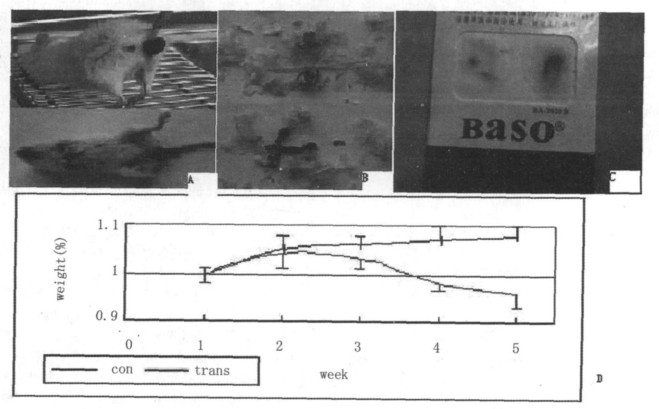
模型鼠出现食欲下降、精神萎靡、逐渐出现竖毛、弓背、腹泻、体重下降、便隐血实验阳性(图 2)。在移植MSC后, 小鼠大便性状和便潜血均有不同程度的改善, DAI积分降低。5w后虽小鼠体重有所恢复, 但与对照组比较未见显著性差异(图 3)。
|
图 2 模型鼠一般情况:肛门病变状况(A), 稀便和黑便(B), 便潜血阳性(C), 体重下降(D) |
|
图 3 移植MSCs后模型鼠DAI评分和体重变化 |
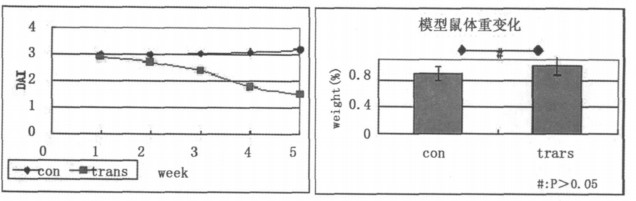
解剖观察模型鼠肠道大体标本, 肉眼可见肠壁肿胀, 发白、或充血、甚至出血。对照组肠壁光滑, 色泽正常。在移植MSCs后5~6w均有不同程度的改善(图 4)。
|
图 4 模型鼠肠道标本解剖观察 正常肠组织肠壁光搰,色泽正常(AB),模型鼠肠壁肿胀、僵硬、发白(D), 充血(C), 治疗组肠组织可见不同程度的改善(EF)。 |
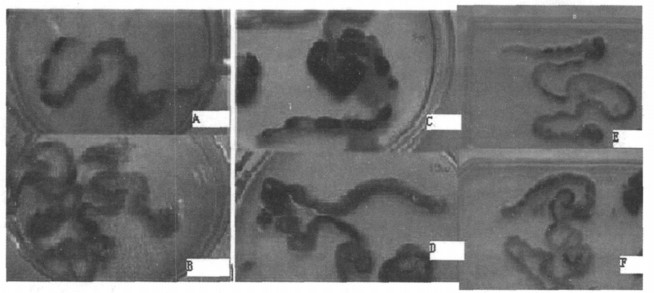
镜下观察可见对照组腺体丰富, 胞浆充盈, 细胞浸润不明显; 模型鼠粘膜呈明显的炎症反应, 表现为部分上皮脱落、粘膜下水肿、炎症细胞浸润、腺体萎缩、腺体扭曲、隐窝缺失、粘蛋白缺失、淋巴滤泡出现; 移植MSCs后炎症程度减轻。按组织学标准评分后与对照组比较有显著性差异(图 5)。
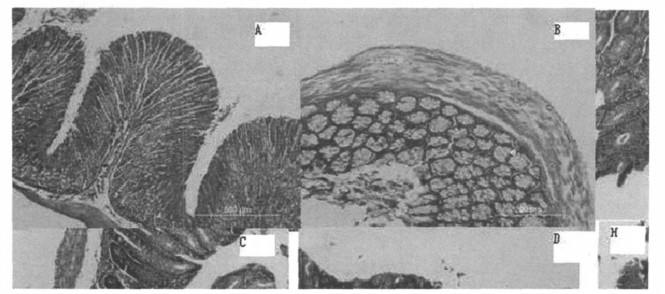
|
图 5 细胞移植前后模型鼠的肠道组织病理变化 正常小鼠肠道粘膜上皮腺体丰富,胞浆充盈(AB); 造模组粘膜层呈明显炎症反应,黏膜下水肿、炎症细胞浸润、腺体萎缩、黏蛋白缺失、淋巴滤泡出现、部分上皮脱落(CD); 部分组织出现腺上皮异性增生(GH)。移植MSCs后炎症程度减轻(EF)。治疗组组织学评分下降(I)。 |
为追踪移植细胞的去向, 移植前预先用CM-DiI标记细胞。荧光显微镜观察几乎全部细胞标记为红色, 流式细胞仪(Beckman)证实标记率在99%以上(图 6)。台盼蓝拒染试验显示移植细胞的存活率大于99%。

|
图 6 CM-DiI标记细胞后荧光显微镜和流式细胞仪观察 |
在细胞移植后5w在结肠组织内观察到标记红色荧光的人源细胞(图 7)。进一步用激光共聚焦显微镜观察在肠组织内CM-Dil标记的细胞(图 8), 显示标记的移植细胞分布在肠粘膜淋巴组织内, 在腺管内细胞间也有分布。

|
图 7 移植后5w在小鼠结肠组织内的人源细胞示踪 |

|
图 8 激光共聚焦显微镜观察在肠组织内CM-Dil标记的细胞 在SCID鼠模型上移植CM-Dil标记的MSC后, 共聚焦显微镜观察到鼠肠组织中红色的人源细胞。DAPI染细胞核呈蓝色(A2, B2);CM-Dil标记的人源细胞呈红色(A1, B1);可见光下组织结构(A3, B3);三图叠加后图像(A4, B4);A(20×), B(40×)。 |
8Gy以上照射损伤特点为造血、免疫功能严重抑制, 肠道上皮广泛损伤, 失去固有的屏障功能, 以及继发于以上各种损伤而来的各种病原微生物的严重感染乃至混合感染、致死性的多脏器衰竭等, 而目前对其治疗还多限于对症综合治疗的范畴。近年来备受人们关注的间充质干细胞具有分泌造血生长因子、重建造血微环境、低免疫原性、具有高度增殖、自我更新和多向分化潜能等优点, 有望用于急性肠道放射损伤的治疗中。
有研究显示MSC在体外能分化成多种组织包括骨、软骨、肌腱、肌肉、脂肪、可能还有骨髓基质[7, 8]。我们也证实了脐带MSC具有多向分化潜能, 在体外具有向骨、脂肪组织的分化能力。因此我们有理由相信移植MSC至少可能参与促进肠道上皮的再生过程。本研究结果显示:脐带MSCs移植确实能改善模型鼠的一般状态和肠道病变。DAI是评价实验模型一般状态的一个客观指标, 组织学评分是评价实验模型肠道组织病理学改变的客观指标, 通过对肠道组织切片HE染色后观察粘膜内的组织学变化来评价疾病活动程度。移植后5w小鼠结肠炎症状缓解, DAI积分降低, 组织学评分下降, 但体重增加不明显, 可能体重增加是反应较为缓慢的原因。实验中观察到CM-Dil标记的移植人源细胞在肠组织内的定植, 表明移植的人脐带MSC可能参与修复受损肠道粘膜过程。在应用骨髓干细胞移植的动物实验研究也有类似的结论[9]。但移植干细胞修复作用的机制究竟是一过性壁龛效应[10]还是直接替代修复还存在争论, 有待进一步研究。
我们的前期研究显示在人脐带中MSC细胞的收获量较脐带血、骨髓来源者更高, 为目前可以获得的来源最丰富的天然资源, 在有限扩增后其生物学特性保持不变[11]。作为移植供体, 人脐带MSC来源广泛、采集方便、可工业化生产、免疫源性极小, 临床应用优势明显, 预示着未来其在急性辐射损伤的临床治疗中可能会大有作为。
| [1] |
蒋本荣, 艾辉胜, 叶根耀, 等. 外照射急性放射病临床诊治中面临的一个重要课题[J]. 中华放射医学与防护杂志,, 2007, 27(1): 43-46. |
| [2] |
Wu Y, Chen L, Scott PG, et al. Mesenchymal stem cells enhance woundh ealing through differen tiation and angiogenesis[J]. Stem Cells, 2007, 25(10): 2648-2659. DOI:10.1634/stemcells.2007-0226 |
| [3] |
Mouiseddine M, Francois S, Semont A, et al. Human mesenchymalstem cells home specifically to radiation-injured tissues in a non-obese diabetes/severe combined immunodeficiency mouse model[J]. Brit J Radiol, 2007, 80(S1): S49-S55. |
| [4] |
Murano M, Maemura K, Hirata I, et al. Therapeutic effect of intracolonically administered nuclear factor kappaB(p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis[J]. Clin Exp Immunol, 2000, 120(1): 51-58. DOI:10.1046/j.1365-2249.2000.01183.x |
| [5] |
Rath HC, Herfarth HH, Ikeda JS, et al. Normal luminalbacteria, especially Bacteroides species, mediate chronic colitis, gastritis, andarthritis in HLA-B27/human beta 2 microglobulin transgenic rats[J]. J Clin Invest, 1996, 98(4): 945-953. DOI:10.1172/JCI118878 |
| [6] |
Ehrhardt RO, Lúdvíksson BR, Gray B, et al. Induction and prevention of colonic in flammation in IL-2-deficientmice[J]. J Immunol, 1997, 158(2): 566-573. |
| [7] |
Le Blanc K, Ringden O. Mesenchymal stem cells:properties and role in clinical bone marrow transplantation[J]. Curr Opin Immunol, 2006, 18(5): 586-591. DOI:10.1016/j.coi.2006.07.004 |
| [8] |
Pittenger MF, Mackay AM, Beck SC, et al. Multilineage potential of adulthuman mesenchymal stemcells[J]. Science, 1999, 284(5411): 143-147. DOI:10.1126/science.284.5411.143 |
| [9] |
Komori M, Tsuji S, Tsujii M, et al. Involvement of bonemarrow-derived cells in healing of experimental colitis in rats[J]. Wound Repair Regen, 2005, 13(1): 109-118. DOI:10.1111/j.1067-1927.2005.130114.x |
| [10] |
Yang C, Zhang ZH, Li ZJ, et al. Enhancem ent of neovascularization with cord blood CD133+ cell- derived endothelial progenitor cell transplantation[J]. Thromb Haemos, 2004, 91(6): 1202-1212. DOI:10.1160/TH03-06-0378 |
| [11] |
Lu LL, Liu YJ, Yang SG, et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J]. Haematologica, 2006, 91(8): 1017-1026. |