肿瘤的放射治疗主要是通过引起肿瘤细胞发生凋亡而发挥作用的。肿瘤细胞的凋亡同周期阻滞有着密切的关系, 因此有必要进一步研究不同剂量的射线同细胞周期之间的关系。临床肿瘤放射治疗过程中的一个难点, 就是肿瘤内部处于乏氧状态的细胞对放射线敏感性的降低, 但目前乏氧引起放疗抵抗性增加的确切机制尚不明了。近期研究表明低氧诱导因子-1α(HIF-1α)在肿瘤适应缺氧过程中起着中枢纽带作用, 它是肿瘤产生一系列缺氧行为的中心环节, 同时还是影响肿瘤细胞周期改变和凋亡的重要因素[1]。
本实验将通过模拟实体瘤内部, 处于两种不同氧供状态下的细胞模型, 观察不同剂量60Coγ射线对Hep-2细胞的作用, 并以细胞周期及凋亡为切入点, 探讨其作用机制。
1 材料与方法 1.1 试剂和仪器RPMI1640培养基(Gibco公司), 兔抗人HIF-1α多克隆抗体(武汉博士德生物工程有限公司), FACSort流式细胞仪(美国BD公司), 人喉鳞癌细胞Hep-2细胞株(白求恩国际和平医院中心实验室提供), FCC-8000型同中心回转式钴60治疗机(山东新华医疗器械股份有限公司)。
1.2 低氧条件设置低氧培养实验条件为37℃、5% CO2、2% O2、93% N2, 具体实验装置制作见参考文献[2]。
1.3 细胞分组及培养Hep-2细胞在37℃、5%CO2、20% O2环境中培养24h, 进入对数生长期后, 将细胞分为A组(常氧组)、B组(低氧组), 低氧条件下培养B组细胞24h。两组细胞分别接受1Gy, 3Gy, 5Gy, 10Gy, 20Gy, 40Gy不同剂量60Coγ射线照射, 两组细胞分别设0Gy对照组, 放疗后换新培养基继续培养24h, 收集各组细胞, 处理后进行各项指标的检测。每组实验均重复6次。
1.4 流式细胞仪(FCM)检测各组细胞周期、凋亡及HIF-1α蛋白的表达经上述处理后的细胞, 应用流式细胞仪进行检测。以488nm氩离子激光激发, 应用Expo 32 ADC软件进行免疫荧光数据分析。
1.5 细胞爬片免疫组化检测HIF-1α蛋白的表达将Hep-2细胞用RPMI1 640培养液配成1×105个/ml悬液, 加入24孔培养板内的玻璃片上, 向每孔内的玻璃片上滴加一滴上述悬液, 37℃ 5% CO2、20% O2下培养4h, 倒致显微镜下观察玻璃片上细胞大部分已贴壁, 向每孔内加RPMI1640培养液约1 ml。继续培养24h, 观察细胞达80%汇合时, 将细胞分组, 相应条件下培养各组细胞, 两组细胞分别接受上述不同剂量的60Coγ射线照射, 同时设未照射对照组。照射后换培养基继续培养24h, 吸出孔内原培养液, PBS冲洗一次, 甲醛固定10 min, PBS洗两次, 每次5 min, 取出爬片。免疫组化PV法染色。结果判断:以细胞内出现棕黄色颗粒为阳性表达, 以高倍视野(×400)下阳性细胞数量及颜色强弱作为综合判断, 采用半定量分析法, 每张切片光镜下随机选择10个视野, ①无染色记为0, 弱染色(浅黄色)记为1, 中等染色(棕黄色)记为2, 强染色(黄褐色)记为3。②.阳性细胞小于视野总细胞数的5%记为0, 阳性细胞占视野总细胞数的5%~24%记为1, 阳性细胞占视野总细胞数的25%~50%记为2, 阳性细胞大于视野总细胞数的50%记为3。①, ②两项结果相加结果为0, 代表阴性(-); 1~2, (+); 3~4, (++); 5~6, (+++)。
1.6 统计学方法应用SPSS11.0统计软件进行处理, 数据以均数±标准差(x±s)表示, 组间比较用t检验和χ2检验。
2 结果 2.1 两组Hep-2细胞HIF-1a蛋白的表达流式细胞检测结果显示:B组HIF-1a蛋白表达(1.66 ±0.53)明显高于A组(1.22±0.59), (P=0.028 < 0.05)差异有统计学意义。
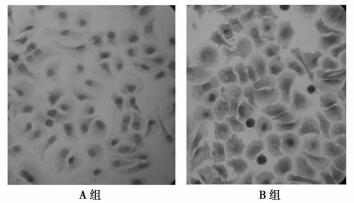
免疫组化结果显示HIF-1a表达主要位于胞浆, 胞核内亦可见其表达, B(+++)组HIF-1a的表达量明显高于A(+)组, 见图 1。
|
图 1 各组细胞HIF-1a蛋白的表达(0Gy) HIF-1a在喉鳞癌Hep-2细胞中的阳性表达, 阳性产物为棕黄色颗粒, 位于喉鳞癌细胞核内(SP×400) |
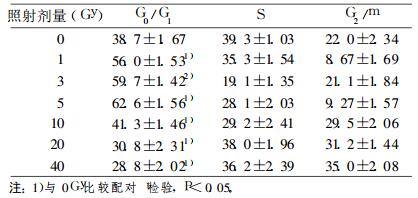
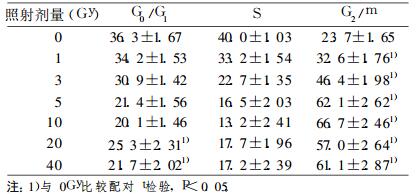
A组Hep-2细胞在接受1~5Gyγ射线照射后, 主要发生了G0/G1期阻滞, 且阻滞率呈剂量依赖性。接受10~40Gyγ射线照射后, Hep2细胞越过G20/G21期检查点, 发生了G2/M期阻滞, 且G22/M期阻滞率呈剂量依赖性, 随照射剂量的增加G22/M期阻滞率增加。见表 1。B组Hep-2细胞对照组(0Gy)发生了明显的G0/G1期阻滞, 而接受1~40Gyγ射线照射后, 主要发生了G22/M期阻滞, (见表 2)。
|
|
表 1 A组细胞周期分布 |
|
|
表 2 B组细胞周期分布 |
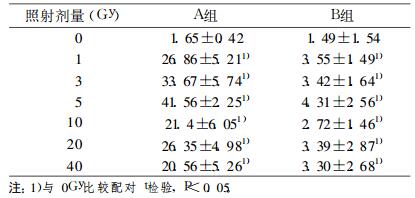
A组Hep-2细胞凋亡曲线成抛物线状, 凋亡率呈现明显的剂量依赖性。在0~5Gy照射时Hep-2细胞凋亡率随照射剂量的增大而增大, 在10~40Gy照射时Hep-2细胞凋亡率随照射剂量的增大而减小, 在5Gy处出现最大值41.56 ±2.25。
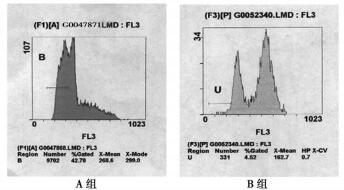
B组细胞凋亡率同A组相比总体上呈现明显的下调趋势, 不同剂放疗没有对其凋亡率产生明显的影响, 见表 3, 图 2
|
|
表 3 B组细胞周期分布 |
|
图 2 各组细胞凋亡率(5Gy) |
目前认为放射损伤的细胞部位是DNA, 经射线照射后细胞会相应采取多种途径来维持基因组的完整性, 绝大多数与细胞周期检测点相关, 细胞周期检测点能够发现放射线导致的DNA损伤, 将受损细胞阻滞在相应的检测点处进行DNA修复, 若修复成功, 细胞继续运行并进入下一周期; 否则会激活细胞的凋亡机制, 导致死亡事件的发生。近年来的研究表明, 增殖细胞与凋亡细胞在形态和生化方面有某些相似之处, 在发生上密切相关, 阻断细胞增殖周期过程可引起凋亡, 而凋亡常伴随有生长阻滞, 细胞增殖周期和细胞凋亡关系密切[3]。
但现在大多数的研究都只局限于常氧状态下体外培养的各种肿瘤细胞, 而对于在体的肿瘤来讲, 其瘤细胞却只有一部分处于正常的氧供状态之下, 由于在实体肿瘤中, 多数肿瘤细胞生长迅速, 血管的生长速度相对滞后, 加之肿瘤血管网结构和功能异常, 肿瘤组织间液压力升高, 使肿瘤血管内的血流处于波动状态, 发生间歇性血流停滞, 这些因素使得部分肿瘤的血供丰富、部分不足。也就造成了内部肿瘤细胞部分处于富氧状态、部分处于乏氧状态, 本实验围绕肿瘤内部的两种不同氧供状态, 把细胞周期阻滞和细胞凋亡结合起来研究, 将为肿瘤放射治疗的研究开辟新的领域。
实验中我们发现低剂量(1~5Gy)照射时A组Hep-2细胞主要发生G0/G1期阻滞, 且呈剂量依赖性; 而高剂量(10~40Gy)照射后细胞主要发生了G2/M期阻滞; 结果同冷彦等报道一致:不同剂量的X射线照射所引起的HL-60细胞周期改变存在差异[4]。实验中我们还发现在低氧条件下Hep-2细胞这一规律消失, 高、低不同剂量的放疗均使B组细胞发生了G2/M期阻滞。
曹亚等研究认为, G2/M期阻滞的时间长短与细胞的辐射敏感性有关, 阻滞时间长, 细胞对辐射耐受, 反之细胞对辐射敏感[5], 张孟贤等报道G2/M期阻滞的程度与细胞的放射敏感性呈负相关, 并推测其机制可能为G2/M期阻滞的发生使DNA损伤得以修复, 细胞凋亡减少, 从而使放射敏感性下降[6]。
实验中我们发现, Hep-2细胞在发生G0/G1期阻滞时出现了凋亡率的明显升高, 而在两组Hep-2细胞产生G2/M期阻滞的同时出现了细胞凋亡率的下降, 结果提示, G2/M期阻滞增强了Hep-2细胞对放疗的抵抗。
目前绝大多数研究结果表明:低氧能引起不同细胞发生G0/G1期阻滞。而叶武[7]等研究发现低氧条件下给予不同浓度阿托伐他汀干预后, HUVECs细胞周期中S期细胞显著增多, G0/G1期细胞所占比例下降。刘家国[8]等研究发现低氧条件下2-脱氧-D-葡萄糖(2-DG)干预的骨肉瘤细胞滞留于G2/M期和S期。我们的研究也发现未进行射线干预的低氧组细胞发生了明显的G0/G1期阻滞, 而在接受1-40Gy不同剂量照射后, B组细胞主要发生了G2/M期阻滞; 以上结果提示, 各种理化因素可以改变低氧细胞的细胞周期阻滞阶段, 本实验中正是由于射线使低氧条件下的Hep-2细胞周期发生了G2/M期阻滞, 使得其对放疗的敏感性降低, 产生了放疗抵抗。
以往研究表明, DNA损伤检测点的主要机制有p53依赖性机制(主导G1期检测点)[9]和p53非依赖性机制(主导G2期检测点)[10], 低氧所导致的HIF-1α蛋白表达的上调会引起p53基因的表达增加, 进而激活p53依赖性G1期检测点, 使细胞产生G1期阻滞[11], 本实验结果显示, B组细胞的HIF-1a蛋白表达明显高于A组, 且对照组未照射B组细胞G1期阻滞率明显高于A组, 此结果同文献报道一致。但B组细胞经照射之后HIF-1a蛋白表达上调的同时却发生了G2/M期阻滞。推测可能是放射线使低氧条件下表达上调的HIF-1a蛋白激活了p53非依赖性机制, 从而使Hep-2细胞产生了G2/M期阻滞, 进而导致了凋亡率的下降和放疗抵抗。但放疗情况下HIF-1a蛋白通过哪种途径启动了p53非依赖性机制还有待于进一步研究。
研究从低氧角度探讨细胞周期改变在放疗诱导Hep-2细胞凋亡中的作用, 提示寻找出一条能够使低氧条件下Hep-2细胞发生G0/G1期阻滞的有效方法, 将为肿瘤的放射治疗开辟一条新的途径。
| [1] |
Iida T, Mine S, Fujimoto H, et al. Hypoxia-inducible factor-1alpha induces cell cycle arrest of endothelial cells[J]. Genes cells, 2002, 7(2): 143-149. DOI:10.1046/j.1356-9597.2001.00512.x |
| [2] |
Comerford KM, Wallace TJ, Karhausen J, et al. Hypoxiainducible factor-1-dependent regulation of the multi drug resistance gene[J]. CancerRes, 2002, 62(12): 3387-3394. |
| [3] |
赵卫红, 陈家佩. 细胞周期与凋亡[J]. 国外医学, 放射医学与核医学分册, 1998, 22(2): 88-90. |
| [4] |
冷彦, 陶德定, 冯晓澜, 等. 流式细胞术分析不同剂量X射线对HL-60细胞周期的影响及其诱导[J]. 同济医科大学学报, 2001, 30(2): 109-115. DOI:10.3870/j.issn.1672-0741.2001.02.006 |
| [5] |
曹亚. 细胞周期与肿瘤[J]. 国外医学生理病理科学与临床分册, 2002, 22(2): 103-105. |
| [6] |
张孟贤, 于世英, 陈元. 宫颈癌细胞周期阻滞和凋亡与放射敏感性的关系[J]. 中华放射肿瘤学杂志, 2002, 11(2): 116-117. DOI:10.3760/j.issn:1004-4221.2002.02.019 |
| [7] |
叶武, 毛威, 华军益, 等. 阿托伐他汀对低氧环境下人脐静脉内皮细胞增殖与细胞周期的影响[J]. 医药导报, 2006, 25(8): 746-748. DOI:10.3870/j.issn.1004-0781.2006.08.009 |
| [8] |
刘家国, 杨述华, 何贤峰, 等. 糖酵解抑制剂对低氧骨肉瘤细胞增殖和凋亡的影响[J]. 国际骨科学杂志, 2007, 28(4): 270-272. DOI:10.3969/j.issn.1673-7083.2007.04.021 |
| [9] |
Yan P, Coindre JM, Benhattar J, et al. Telomerase activity and human telomerase reverse transcriptase mRNA expression in soft tissue tumors: correlation with grade, histology, and proliferative activity[J]. Cancer Res, 1999, 59: 316-3172. |
| [10] |
Ito H, Kyo S, Kanaya T, et al. Expression of human telomerase subunits and correlation with telomerase activity in urothelial cancer 1Clin[J]. Cancer Res, 1999, 4: 1603-1608. |
| [11] |
Alarcon R, Koumenis C, Geyer RK, et al. Hypoxia induces p53 accumulation through MDM2 down-regulation and inhibition of E6-mediated degradation[J]. Cancer Res, 1999, 59(24): 6046-6051. |