2. 天津市天津医院
Rad51蛋白是利用同源重组方式修复DNA双链断裂(DSB)过程中的一个关键蛋白[1]。由于Rad51的作用, 肿瘤细胞可明显抵抗射线的杀伤作用。因此, 如果能够使肿瘤细胞中Rad51水平下调, 将增强肿瘤细胞对射线的敏感性, 提高放疗的效果。多项实验研究已部分证实了这种观点[2]。
骨肉瘤是一种临床常见恶性骨肿瘤, 许多学者认为。对脊柱、肋骨、胸骨等处的骨肉瘤及拒绝手术的肢体部位的骨肉瘤, 放疗是目前较为可行的治疗方法。而骨肉瘤是一种辐射抗性很强的肿瘤[3]。本研究应用免疫印迹和逆转录PCR检测DNA损伤修复基因Rad51在骨肉瘤中的表达, 并进一步构建Rad51 RNA干扰载体, 探讨Rad51对人骨肉瘤细胞射线敏感性的影响, 为今后提高骨肉瘤对射线敏感性的基因治疗提供实验依据。
1 材料与方法 1.1 干扰载体的构建根据Rad51基因mRNA序列(NM 002875.3), 选择RNAi的靶序列为5'-gaaggaaaggccatgtacattg- 3'。HhaⅠ和HindⅢ(TaKaRa Bio, Shiga, Japan)双酶切质粒pGCsi-U6/neo/GFP, 回收纯化目的产物, T4连接酶连接线性质粒和模板, 转化大肠埃希菌Top10(本室保存)。PCR法初筛阳性克隆, 测序鉴定重组质粒。
1.2 细胞培养骨肉瘤细胞株HOS购于中国医学科学院基础医学院细胞库, 含10%胎牛血清(Hyclone laboratories)的Mc- COY'S 5A培养液(Invitrogen公司)在37℃、5%CO2条件下常规培养。
1.3 细胞转染转染前24h将细胞以合适浓度接种于24孔板中培养, 使细胞转染时达到90%融合度。将构建好的质粒载体和阴性对照载体分别转染人骨肉瘤细胞系HOS, 操作参照Lipofectamine 2000转染试剂说明书。转染后继续培养6h, 弃去转染液, 换不含抗生素的DMEM完全培养液。转染后36h将细胞以1:10传代至100mm2直径的培养皿中, 24h后加入600μg/mlG418筛选稳定转染的细胞, 2周后将细胞接种于96孔板中, 单克隆化, 荧光显微镜筛选稳定表达克隆, 扩大培养。
1.4 Westernblot细胞生长至亚融合状态时, 收集细胞, 以MER-Pierce裂解液裂解细胞。蛋白定量按BCA蛋白定量试剂盒说明书(TAKARA)进行。取50μg蛋白进行不连续SDS— PAGE胶电泳, 电转移至PVDF膜, 用含5%脱脂奶粉的TBST 4℃封闭过夜, 加入一抗(1:1000稀释), 室温孵育2h, 洗膜, 加入相应的HRP标记的二抗(1:3000), 室温孵育1h, ECL化学发光法检测。以β-actin作为内参。采用qualitity One version 4.6.2软件分析蛋白条带相对光密度值。
1.5 RT-PCRTrizol试剂提取细胞总RNA, 并进行逆转录及PCR反应, 操作按说明书进行。Rad51引物序列:上游为5' CGGGATCCTGGGGCAAGCGAGTAGAG3', 下游为5' CGTCTAGAAAGTCATTCCTAAGGCACC3', 扩增片段长度为1 456bp; 以GADPH作为内参。扩增产物用1%琼脂糖凝胶电泳, 紫外透视仪检测结果并摄像, 凝胶电泳图像应用qualitity One version4.6.2软件分析电泳条带灰度值, mRNA表达的相对强度=Rad51条带灰度值/GADAPH条带灰度值
1.6 MTT以每孔5000个细胞接种于96孔培养板培养24h后照射, 照射剂量为4、8、16、32、64Gy, 剂量率0.79Gy/min, 继续培养72h后加入20μl MTT, 4h后吸弃孔中的培养液, 每孔加入150μl DMSO, 震荡混匀10min, 在酶标仪592nm处测定各孔吸光度值, 存活率=照射组平均吸光度值/空白组平均吸光度值×100%。
1.7 克隆形成实验以每孔400个细胞接种于6孔培养板培养24h后照射, 照射剂量为8Gy, 37℃继续培养, 10d后终止培养, 固定细胞, 染色。实验重复2次。细胞数≥50定义为1个克隆集落。克隆形成率=克隆集落数/接种细胞数×100%。
1.8 凋亡测定三个细胞株分别经8Gyγ-射线照射后24h收集细胞, 碘化毗啶(PI)和Annexin双重染色15min后, 流式细胞仪测定细胞凋亡比例。
1.9 统计学方法所有数据以x±s表示.组间差异用单因素方差分析, 采用SPSS10.0软件进行处理。P < 0.05为差异有统计学意义。
2 结果 2.1 Rad51在骨肉瘤细胞中表达水平增高Rad51蛋白在人不同骨肉瘤细胞系(HOS、saos-2、MG-63和U-2OS)中的表达水平均显著高于人胚皮肤成纤维细胞系ccc-esf-1。RTPCR结果同western blotting相一致, 提示Rad51在骨肉瘤中的高表达可能同转录水平的升高有关, 从此水平抑制Rad51可作为降低其表达的一个有效手段。我们选择骨肉瘤细胞系HOS做后续实验。
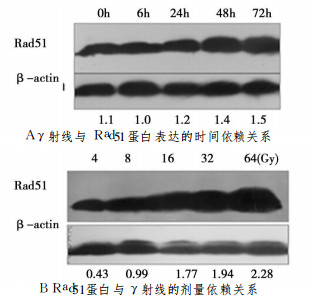
2.2 γ射线促进Rad51的表达人骨肉瘤细胞系HOS经8Gyγ-射线(剂量率0.79Gy/min)照射, 于照射后6h、24h、48h、72h提取细胞总蛋白, 检测Rad51表达的变化, 如图 2所示, Rad51表达水平在72h内随着时间的延长而逐渐升高。不同照射剂量时Rad51表达水平变化的结果也显示, 随着照射剂量的升高, Rad51的表达水平逐渐升高。

|
图 1 Rad51在骨肉瘤细胞系中的表达 |
|
图 2 γ射线与Rad51表达的时间剂量依赖关系 |
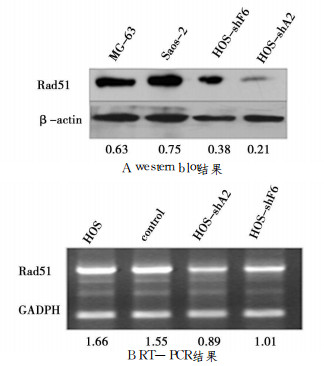
对不同的细胞克隆分别从蛋白和mRNA水平进行鉴定, 筛选出二个细胞系HOS-shA2和HOS-shF6。如图 3所示, 对比亲本HOS, HOS-shA2和HOS-shF6 Rad51蛋白表达分别降低了66.7%和39.7%, RT-PCR检测结果也发现其Rad51水平较亲本HOS分别降低46%和39%。传二代后, 再次提取细胞RNA和蛋白质做检测, Rad51水平基本没有变化, 因此Rad51基因沉默的稳定细胞系已成功建立。
|
图 3 RNA干扰对Rad51表达的影响 |
将HOS、对照细胞control和HOS-shA2、HOS-shF6细胞暴露于不同剂量的γ-射线(剂量率0.79Gy/min), 后继续培养72h。如图 4, MTT结果显示shRNA-A2、shRNA-F6细胞对射线敏感性变化很显著(P < 0.05), IC50由亲本细胞的73Gy下降为26.1Gy和40.1Gy, 且放射敏感反应与Rad51蛋白表达水平的高低呈负相关(P < 0.05), 而阴性对照细胞对射线敏感性无明显变化。克隆形成实验也证实了相同的结果。

|
图 4 Rad51基因沉默对骨肉瘤射线敏感性的影响 |
为证实Rad51基因沉默后射线敏感性提高是否与其促进细胞的凋亡有关。本实验采用Annexin V-PITC/PI双染法检测了HOS、control和HOS-shA2三株细胞系的凋亡情况。结果如图 5, 经16Gyγ-射线作用后, HOS-SHA2凋亡细胞比例(5.5%)明显高于对照细胞(1.0%)和亲本细胞(1.1%)。

|
图 5 Annexin V-PITC/PI双染法显示Rad51基因沉默促进细胞凋亡 |
骨肉瘤是最具辐射抗性的肿瘤细胞之一, 通常离体照射10000rad也难以使肿瘤细胞完全坏死。因此骨肉瘤放疗在临床应用较为局限, 但对于一些没有手术条件又不同意截肢的患者; 手术切除范围较大且肿瘤边界不清的病例[4]; 和位于特殊解剖位置的肿瘤(如颅底肉瘤)等, 放疗却也不失为一种较为可行的治疗手段。因此, 提高骨肉瘤的辐射敏感性对此类患者具有重要的意义。
DSB是肿瘤细胞经放疗后最常见的损伤, 而肿瘤细胞会对断裂的DNA进行修复以维持细胞存活, 从而造成肿瘤的辐射抵抗。参与DSB修复主要有二条途径:非同源未端连接和同源重组修复。其中Rad51蛋白是在同源重组修复中催化断裂的DNA双链与完整的同源DNA姐妹链进行链间转移置换的关键酶。肿瘤细胞内Rad5l蛋白水平的异常升高, 可造成肿瘤对放疗的抵抗[5]。
本研究中检测的骨肉瘤细胞中, Rad51表达水平均明显高于正常细胞, 且蛋白与RNA水平相一致, 因此, 引起骨肉瘤细胞Rad51蛋白异常升高的原因可能与肿瘤细胞中Rad51基因在转录水平的上调有关。该结论与Raderschall[6]等对乳腺癌SkBr3细胞、慢性髓细胞样白血病细胞及黑色素瘤研究中的结论一致。
目前关于Rad51表达是否受射线的诱导还存在争议。一般认为在哺乳动物细胞中, 射线对Rad51的表达没有影响[6]。本实验却发现, 射线可诱导骨肉瘤细胞中Rad51的表达, 并且随着照射剂量的增加而提高, 但该变化在照射后24h才检测的出, 这可能也是在以前的实验中未检测出Rad51变化的原因之一[7]。
RNAi是由小干扰RNA介导的转录后基因沉默现象[8], 产生siRNA的方法有多种, 而载体法可在细胞内持续表达siR- NAs, 利于高效抑制靶基因; 本实验中构建的pGCsi-U6/neo/ GFP-Rad51质粒, 用G418筛选获得稳定表达siRNA的细胞株, Rad51水平约为对照组的33%。
本研究显示, Rad51基因沉默可提高骨肉瘤细胞的射线敏感性, 促进细胞凋亡, 可能是由于Rad51基因沉默使骨肉瘤细胞对DSB修复能力下降, 使其对射线易感所致; 对于Rad51是否参与了凋亡的信号通路还有待进一步的研究。但本实验结果也受到以下因素的限制, 其一, Rad51基因表达的抑制率约为60%左右, 细胞中存留的Rad51蛋白仍可在修复DSB中发挥作用; 其二, 同源重组途径被抑制后, 非同源末端连接仍然能够修复部分DSB; 其三, 还有许多其他因素影响肿瘤的放疗敏感性, 这些因素可能与Rad51有协同或拮抗作用。
| [1] |
Christodoulopoulos, Areli Malapetsa, Hymen Schipper, et al. Chlorambucil induction of HsRad51 in B-cell chronic lymphocytic leukemia[J]. Clin Cancer Res, 1999, 5(8): 2178-2184. |
| [2] |
Vispe S, Cazaux C, Lesca C, et al. Overexpression of Rad51 protein stimulates homologous recombination and in- creases resistance of mammalian cells to ionizing radiation[J]. Nucleic Acids Res, 1998, 26(12): 2859-2864. DOI:10.1093/nar/26.12.2859 |
| [3] |
Sugimoto M, Utsumi H. Proficient repair of potentially lethal damage sensitive to hypertonic treatment in osteosarcoma cells[J]. Radiat Res, 2000, 154(3): 347-350. DOI:10.1667/0033-7587(2000)154[0347:PROPLD]2.0.CO;2 |
| [4] |
Quinn J.A., et al. Phase I trial of temozolomide plus O6 - benzylguanine for patients with recurrent or progressive malig-nant glioma[J]. J Clin Oncol, 2005, 23(28): 7178-7187. DOI:10.1200/JCO.2005.06.502 |
| [5] |
Valerie K, Povirk LF. Regulation and mechanisms of mammalian double-strand break repair[J]. Oncogene, 2003, 22(37): 5792-5812. DOI:10.1038/sj.onc.1206679 |
| [6] |
Raderschall E., et al. Elevated levels of Rad51 recombina-tion protein in tumor cells[J]. Cancer Res, 2002, 62(1): 219-225. |
| [7] |
Bishop, Douglas K, Uy Ear, Anamitra Bhattacharyya, et al. Xrcc3 is required for assembly of Rad51 complexes in vivo[J]. J Biol Chem, 1998, 273(34): 21482-21480. DOI:10.1074/jbc.273.34.21482 |
| [8] |
Jean-Remi Bertrand, Mireille Pottiera, Antoine Vekrisb, et al. Comparison of antisense oligonucleotides and siRNAs in cell culture and in vivo[J]. Biochem Biophys Res Commun, 2002, 296(4): 1000-1004. DOI:10.1016/S0006-291X(02)02013-2 |



