核辐射是核武器特有的杀伤破坏因素, 在使用核武器条件下卫生检疫的结构中核辐射损伤占有很大的比重。当人体受到一定剂量的核辐射作用后, 就会引起人体各器官组织的损伤和生理机能失调的一系列反应。其中, 核辐射性脑损伤较为常见。本研究旨在利用MRI弥散加权成像(diffusion weighted imaging, DWI), 通过活体测量受损脑组织的表观弥散系数(apparent diffusion coefficienct, ADC)值探讨核辐射性脑损伤的早期变化并与病理变化进行对照。
1 材料与方法 1.1 动物及分组1~3岁杂种犬25条, 13雄12雌, 体重7.5 ~15kg, 毛发光亮, 鼻头湿润, 活泼健康。将犬分为2组:照射前10条为对照组, 照射后25条为实验组, 该组又被分为第2、4、8、10、12周5个亚组各5条)。
1.2 模型制作采用后肢静脉注射戊巴比妥钠(30mg/kg)对犬麻醉后, 将犬左侧卧位于60Co机治疗床上, 对准犬脑右颞部一次性照射70Gy, 射野面积4cm×4cm, 照射距离65cm, 照射深度3cm。
1.3 MRI检查使用SiemensSymphony1.5T磁共振扫描仪检查, 将犬麻醉后左侧卧位于MRI检查床上, 使用标准头颅线圈(图 1①)。分别对照射前正常犬脑(对照组)和照射后(实验组)第2、4、8、10、12周进行MRIT1WI、T2WI和DWI检查, 分别测量正常对照组和实验组犬脑受照区域脑白质、脑灰质的ADC值。

|
图 1 ① MRI检查; ②照射野犬毛脱落; ③犬毛变白; ④皮肤反应; ⑤犬脑正常图像; ⑥ROI; ⑦照射后第12周, 脑萎缩, 两侧脑室扩大; ⑧脑室扩大, 局部皮质变薄。 |
每组MRI检查完毕后, 立即将犬处死, 断头取脑, 其中3只犬脑固定于甲醛溶液中, 石蜡包埋, HE染色, 进行光镜观察; 2只犬脑组织块固定于多聚甲醛溶液中, 0.1mmol/L磷酸缓冲液(pH7.4)漂洗, 10g/L锇酸固定2h, 酒精和丙酮先后逐级脱水, 丙酮及纯包埋剂浸透, 环氧树脂618包埋, 制成50nm超薄切片, 电镜下观察组织学改变。
1.5 统计学分析测量结果用x±s表示, 统计学处理使用Excel, 计量资料采用t检验, 计数资料采用卡方检验。
2 结果 2.1 动物照射后的反应动物照射后均有食欲减退、活动减少等, 2~7d逐渐恢复正常。1个月后射野局部犬毛开始脱落, 部分出现射野周围犬毛变白、皮肤反应和色素沉着(图 1②③ ④)。
2.2 常规MRI表现照射后第2、4周无明显变化, 第8周开始照射侧出现脑萎缩, 表现为局部皮质变薄、脑沟增宽、脑室扩大, 至第12周两侧大脑半球均萎缩, 但脑实质内未出现明显的异常信号强度改变(图 1⑤⑥⑦⑧)。
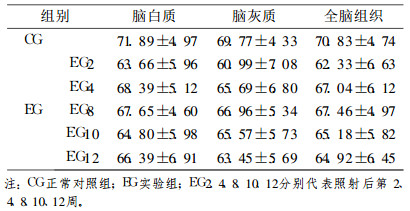
2.3 实验组犬脑受照组织和正常对照组相应区域ADC值(表1)各测量时间点ADC值变化趋势见图 2, 统计学比较见表 2。实验组EG2、EG4、EG8、EG10、EG12与正常对照组(CG)比较, 差异均有统计学意义。
|
|
表 1 照射前后犬脑ADC测值(×10-5mm2/s) |

|
图 2 犬脑受照组织ADC值随时间变化趋势 |
|
|
表 2 不同组别ADC值统计学比较 |
光镜下主要表现为神经细胞水肿、固缩, 小血管出血, 细胞水肿以照射后第2周最明显(图 3①②③); 电镜下主要表现为神经胶质细胞水肿, 细胞器肿胀(图 3④), 血管内皮细胞增生肥大甚至脱落(图 3⑤⑥), 神经纤维髓鞘疏松(图 3⑦), 微小血管周围轻度水肿(图 3⑧)。

|
图 3 ① 照射后2周, 细胞水肿明显; ②照射后8周, 细胞水肿和固缩同时存在; ③照射后12周, 细胞水肿、固缩, 小血管出血; ④放疗后2周, 神经细胞水肿, 细胞器肿胀; ⑤血管内皮细胞增生肥大; ⑥内皮细胞脱落; ⑦神经纤维髓鞘疏松, 部分呈同心圆状排列; ⑧血管内皮细胞增生, 周围水肿。 |
核辐射是核武器特有的杀伤破坏因素, 在使用核武器条件下卫生检疫的结构中核辐射损伤占有很大的比重。当人体受到一定剂量的核辐射作用后, 就会引起人体各器官组织的损伤和生理机能失调的一系列反应。其中, 核辐射性脑损伤较为常见。DWI是利用水分子扩散运动(布朗运动)的特性对水分子进行扩散测量和成像的方法, 是分子水平的磁共振成像, 能及时地提供关于机体组织微观空间组成变化的信息和病理生理状态下各组织成分之间水交换的功能状况, 从而反映出活体组织微观环境中的病理变化情况, 现已广泛应用于临床尤其脑内疾病的诊断和研究[3]。
在我国, 由于人脑放射性损伤的病理取材较难, 因而多采用大鼠模型动物实验研究放射性脑损伤的组织学改变[4]。由于本研究是通过测量受照脑组织的ADC值来探讨脑受照后微观病理改变, 为保证有足够大的兴趣区(ROI), 因而选用犬脑作为实验对象。
犬脑正常白质组织的ADC值是(71.89±4.97)×10-5 mm2/s, 灰质组织是(69.77±4.33)×10-5mm2/s, 全脑组织是(70.83±4.74)×10-5mm2/s。照射后犬脑组织的ADC值明显下降, 以照射后第2周最为明显, 第4周后有所回升, 但各测量时间点, 犬脑组织的ADC值均低于正常对照组, 差异有统计学意义。
导致ADC值下降的因素很多, 主要有①细胞毒性水肿学说; ②水分子双指数扩散学说; ③组织水状态改变学说; ④髓鞘限制性学说[5]。本实验结果和组织学观察显示, 犬脑组织照射后第2周其ADC值下降最明显, 也是细胞毒性水肿最明显的时期, 其余各时间点也均以神经细胞水肿为主要病理改变, 说明导致放射性脑损伤微观变化ADC下降的主要因素是细胞毒性水肿。细胞毒性水肿是由微血管改变引起的。组织学观察显示, 在犬脑组织受照后的早期就出现血管内皮细胞增生肥大血管壁增厚管腔狭窄, 导致脑血流量下降, 进而导致脑细胞缺氧, 能量代谢障碍导致细胞膜上依赖ATP酶的离子泵功能丧失, 钾离子大量外流, 而钙离子、氯离子和钠离子向细胞内流入和聚集, 形成细胞内高渗状态, 大量水分进入细胞内, 进入细胞内的水分子不易被排除而蓄积于细胞内, 形成细胞毒性水肿。细胞内水分子受到细胞器及细胞膜的限制, 其扩散受限而下降, 同时细胞毒性水肿引起细胞外间隙缩小, 进一步限制了细胞外水分子的扩散, 从而导致受照犬脑组织ADC值的下降[6]。
本研究结果说明, 犬脑受照早期就已经存在微观的病理变化, 这些变化可通过测量受照组织的ADC值定量地反映出来; DWI是一种极其敏感的探测水分子弥散能力改变的功能性成像技术, 能够先于解剖影像学发现放射性脑损伤镜下微观病理改变并加以定量分析, 有重要的临床应用价值。
| [1] |
Armstrong C L, Hunter J V, Hackney D, et al. MRI changes due to early-delayed conformal radio therapy and post surgical effects in patients with brain tumors[J]. Int.J.Radiation Oncology Biol.Phys, 2005, 63(1): 56-63. DOI:10.1016/j.ijrobp.2004.12.073 |
| [2] |
Llanes S, Torres I J, Roeske A, et al. Temporal lobe radiation and memory in adult brain tumor patients[J]. J Int Neuropsychol Soc, 2004, 10: 185-185. |
| [3] |
Bammer R. Basic principles of diffusion-weighted imaging[J]. European Journal of Radiology, 2003, 45: 169-184. DOI:10.1016/S0720-048X(02)00303-0 |
| [4] |
Tang Yamei, Zhang Yinyin, Li Yi, et al. Establishment of a nurine model with acute radiative brain injury[J]. Chinese journal of clinical rehebilitation, 2005, 9(13): 238-240. |
| [5] |
Bammer R, Acar B, Moseley M E. InvivoMR tractography using diffusion imaging[J]. European Journal of Radiology, 2003, 45: 223-234. DOI:10.1016/S0720-048X(02)00311-X |
| [6] |
Rutherford M, Ward P, Allsop J, et al. Magnetic resonance imaging in neonatal encephalopathy[J]. Early Human Development, 2005, 81: 13-25. DOI:10.1016/j.earlhumdev.2004.10.011 |