超重环境和微波辐射分别对机体的损伤,国内外已有不少报道[1-3], 但超重环境和微波辐射对机体的损伤机制尚不清楚。转化生长因子β(transforming growth factor beta, TGF-β)作为一种免疫调节细胞因子和重要的纤维化细胞因子以及介导的细胞信号转导途径引起了人们的广泛关注[4],但TGF-β起何种作用,尤其是在超重环境和微波辐射两种因素协同作用下对机体的影响尚未见报道[5]。如何防护超重环境和微波辐射协同作用对人体的损伤,也已成为国内外所关注的热点。我们利用长白山特产资源,研制出了一种具有防辐射、抗疲劳、抗氧化、抗衰老、提高机体免疫力的复方冲剂。通过动物实验,对其TGF-β2 mRNA表达的影响进行观察研究,探讨TGF-β细胞信号转导途径在超重环境和微波辐射中的作用机制及该复方冲剂对超重环境和微波辐射协同作用的防护效应。
1 材料与方法 1.1 实验动物健康成年雌雄各半的2级Wistar大鼠(SCXK:吉2003 - 0001)84只,由吉林大学白求恩医学部实验动物中心提供,体重(266.4 ±36.9) g。
1.2 林蛙油复方冲剂的研制采用长白山特产资源林蛙油为主要成分,以抗氧化、抗疲劳、抗衰老、提高机体免疫力的多种物质为辅助成分,加入适量淀粉和砂糖, 配制可供热水冲服的袋装颗粒剂[6]。
1.3 试剂及仪器TRIzol试剂,RT-PCR试剂盒(A027 -2), DGL2000 DNA Marker, TGF-β2和β-肌动蛋白(β- actin)引物,均购于北京鼎国生物技术服务有限公司。异丙醇,乙醇,琼脂糖,TBE电泳缓冲液,溴化乙锭等试剂均为国产分析纯。PTC-240VAC型PCR仪(美国MJR公司),3K30型低温高速离心机(美国sigma公司),EC250 - 90型电泳仪(美国EC - Appara- tas公司),DDY - Ⅲ - 34A型电泳槽(北京六一公司),756MC型紫外分光光度计(上海第三分析仪器厂)等。
1.4 实验方法 1.4.1 动物分组随机分为6组,每组14只(雌雄各半),分别为空白对照组、超重辐射实验组、复方冲剂实验组、复方冲剂防护前超重辐射组、复方冲剂防护后超重辐射组、复方冲剂防护中超重辐射组。
1.4.2 复制模型将大鼠先在6G超重环境下适应5min, 接着在6G超重环境下实施200mV/cm2的微波辐射5min, 即得超重环境和微波辐射协同损伤模型[7]。
1.4.3 给药方法各组动物用相同饲料平行饲养5d。空白对照组和超重辐射实验组给予生理盐水灌胃,每日3ml, 连续灌胃14d。林蛙油复方冲剂的用量, 按大鼠每天每1kg体重100mg林蛙油(干重)计量,配成3ml, 每天灌胃1次。复方冲剂实验组,从实验当天开始, 用复方冲剂连续灌胃14d;复方冲剂防护前超重辐射组,从接受超重辐射后当天开始,用复方冲剂连续灌胃14d;复方冲剂防护后超重辐射组,用复方冲剂连续灌胃14d后,再接受超重辐射; 复方冲剂防护中超重辐射组, 在连续灌胃7d后实施超重辐射, 然后再用复方冲剂连续灌胃7d。各组大鼠停止灌胃2d后,均用20%的乌拉坦麻醉,打开腹腔,快速取出肝脏待用。
1.5 TGF-β2 mRNA表达检测 1.5.1 总RNA的提取将肝组织放入Eppendorf管中剪碎,加入TRIzol试剂1 ml,匀浆后加入200μl氯仿,颠倒混匀,室温放置15min, 4℃ 12 000r/min离心15min, 取上清加入500μl异丙醇,室温放置12 000r/min离心15min, 弃上清; RNA沉淀中加入1 ml DEPC水配制的75%乙醇混匀, 4℃ 8 000r/min离心5min, 弃上清; 待试管完全干燥后加入DEPC水30μl。取含有RNA液1μl加100μl DEPC水稀释,用紫外分光光度计定量OD260/OD280, 此值在1.8 ~2.0, 提示得到了纯净的总RNA。
1.5.2 RT-PCR反应严格按试剂盒操作。RT反应:反转录体系(20μl)包括随机引物(RP) 1μl, dNTPs 1μl, 5×RT buffer 4μl,反转录酶混合液1μl, 总RNA 3μl, 双蒸水10.1μl。RT反应程序为37℃孵育30min,95℃反转录5min, 迅速放入-20℃冻存备用。PCR扩增反应:扩增体系(50μl)包括RT反应物3μl,10 × PCR buffer 5μl, dNTPs 1μl,TGF-β2上、下游引物各0.5μl,β- actin上、下游引物各0.5μl, Taq酶1μl, 双蒸水38.1 μl。PCR扩增反应应程序为94℃;预变性变性45s, 55℃复性45S, 72℃延伸45S, 72℃终末延伸5min, 共32个循环。TGF-β2引物序列,上游:5' -GGCAGAGTTCAGGGTCTTTCG - 3'下游:5' - CGCTGGGTT GGAGATGTTAGG - 3', 扩增产物长度为111bp[8];β- actin引物序列,上游:5'-GTGGGGCGCCCCGGCACCA-3'下游:5' - CTCCTTAATGTCACGCACGATTT -3/, 扩增产物长度为318bP。扩增结束后在1.5 %琼脂糖凝胶上进行电泳,电泳缓冲液1×TBE, 15 ~30min后在紫外灯下观察结果并拍照保存。UTHSCSA ImageTool软件对特异性条带进行测定灰度值, TGF-β2表达水平以TGF-β2灰度值/β - actin灰度值表示。
1.6 统计学处理TGF-β2表达强度为计量资料,以均数±标准差(x±s)表示,组间比较用单因素方差分析,采用SPSS11.5软件统计,P < 0.05为有统计学意义。
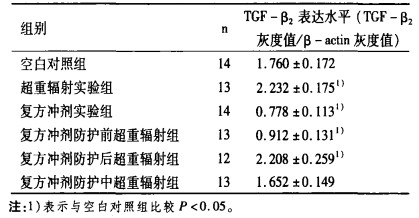
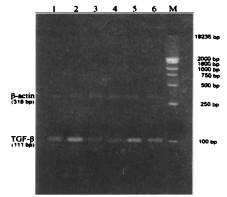
2 结果模型复制过程中,超重辐射实验组、复方冲剂防护前超重辐射组、复方冲剂防护中超重辐射组、复方冲剂防护后超重辐射组均有1只雄性大鼠死亡; 复方冲剂防护后超重辐射组有1只雌性大鼠死亡。各组大鼠肝脏总RNA纯度OD260/OD280均在1.8 ~ 2.0之间,可用于RT - PCR。各组大鼠肝脏TGF-β2 mRNA表达电泳图谱,见图 1。各组大鼠肝脏TGF-β2mRNA表达的比较,见表 1。与空白对照组比较,超重辅射实验组和复方冲剂防护后超重辐射组TGF-β2 mRNA表达显著升高(P < 0.05);复方冲剂实验组和复方冲剂防护前超重辐射组TGF-β2 mRNA表达显著降低(P < 0.05);复方冲剂防护中超重辐射组TGF-β2 mRIVA表达略有降低,但无统计学意义(P > 0.05)。与超重辐射实验组比较,复方冲剂实验组、复方冲剂防护前超重辐射组和复方冲剂防护中超重辐射组TGF-β2 mRNA表达显著降低(P < 0.05);复方冲剂防护后超重辐射组TGF - β2 mRNA表达略有降低,但无统计学意义(P > 0.05)。
|
图 1 各组大鼠肝脏TGF-β2 mRNA表达电泳图谱 1:空白对照组 2:超重辐射实验组 3:复方冲剂实验组 4:复方冲剂防护前超重辐射组 5:复方冲剂防护后超重辐射组 6:复方冲剂防护中超重辐射组 M:DGL2000 DNA Marker |
|
|
表 1 各组大鼠肝脏TGF-β2 mRNA表达的比较(x±s) |
TGF-β是一类多功能的多肽类生长因子, 参与调节胚胎发育、细胞生长和分化、细胞外基质合成、炎症、创伤修复和免疫等许多生物过程[4],是一种免疫调节细胞因子和重要的纤维化细胞因子。本实验结果表明,超重辐射实验组TGF-β2 mRNA表达较空白对照组显著升高, 说明超重环境和微波辐射协同作用可使TGF-β2 mRNA表达显著增强,可视为机体的一种损伤或损伤的代偿形式; 复方冲剂实验组TGF-β2 mRNA表达较空白对照组显著降低, 说明林蛙油复方冲剂有抑制TGF-β2 mRNA表达作用; 复方冲剂防护前超重辐射组TGF-β2 mRNA表达较空白对照组显著降低,说明林蛙油复方冲剂可以迅速降低超重环境和微波辐射协同作用后损伤大鼠的TGF-β2 mRNA表达; 复方冲剂防护后超重辐射组TGF-β2 mRNA表达较空白对照组显著升高,说明林蛙油复方冲剂不能有效的防护超重环境和微波辐射协同作用对大鼠的损伤, TGF-β2 mRNA表达依然显著增强。从复方冲剂防护前超重辐射组、复方冲剂防护后超重辐射组和复方冲剂防护中超重辐射组三组TGF-β2 mRNA表达水平来看,超重辐射后即进行干预效果最佳,超重辐射前后均进行干预, 只有一定效果,而超重辐射前进行干预,则无抑制效应,说明林蛙油复方冲剂对TGF-β2 mRNA表达的干预有时间上的效应。但超重环境和微波辐射协同作用可增强大鼠肝脏TGF-β2 mRNA表达, 林蛙油复方冲剂可降低正常大鼠和超重环境下微波辐射大鼠肝脏TGF-β2 mRNA表达,其确切机制有待进一步探讨。
课题组前期的实验发现[6], 林蛙油复方冲剂可辅助增强超重环境下微波辐射大鼠血清抑制羟自由基的能力,结合本实验与之时相变化的一致性,提示TGF-β细胞信号转导途径可能与机体发生损伤或代偿有关。从而推测林蛙油复方冲剂有明显抑制TGF-β2 mRNA表达作用, 可降低TGF - β2与其受体的结合,减轻TGF-β细胞信号转导途径产生的生物学效应对机体的损伤。当然, 这种推测仍然需要更深人的研究和大量的实验数据来证明。SMAD家族蛋白是TGF-β细胞信号通路传导过程中的重要底物[9], SMAD是Droosophila Mother against dpp(Mad)和C elegans(Sma)两个基因的名字的融合。SMAD2、3是TGF-β受体Ⅰ的惟一底物,活化的SMAD2、3形成同型复合体,并与SMAD4结合形成异型复合体,后易位于胞核,单独或(和)其他转录调节因子协同调节靶基因的表达。在TGF-β信号传导通路中SMAD6、7通过与SMAD2、3竞争相结合TGF -β受体Ⅰ, 干扰SMAD2、3和SMAD4的结合来抑制TGF-β信号的传导。SMAD4在信号转导过程中起到瓶颈作用[10]。故此课题组还将在超重环境和微波辐射协同作用对TGF-β受体和SMAD家族蛋白的影响方面作进一步的研究,完善超重环境和微波辐射协同作用对TGF-β细胞信号转导途径整体的影响。
微波辐射和和超重环境对机体的损伤是广泛和复杂的,根据其强度和时间不同,分别可使生物体致死、致伤、致残。长期接触低强度微波辐射,如长期使用手机的青少年, 可出现疲劳、乏力、记忆力降低、耳鸣、嗜睡、视力下降等症状。以长白山特产资源林蛙油为主要成分的复方冲剂, 有抑制TGF-β2 mRNA表达作用,如果适量服用,很可能具有防护微波辐射和和超重环境对机体的损伤效应。当然,这还需要进行广泛而深人的综合研究来证明。
| [1] |
Oshia M, Oshima H, Tateto M M. Hypergravity induces expression of cyclooxygenase-2 in the vessels[J]. Biochem biophy Res Commun, 2005, 330(3): 928-933. DOI:10.1016/j.bbrc.2005.03.060 |
| [2] |
Szotti-Martelli L, Peccatori I M, Maggini V, et al. Individule responsiveness to induction of micronuclri in human lymphocytes after exposure in vitro to 1800~MHZ microwave radiation[J]. Mutat Res, 2005, 582(12): 42-52. |
| [3] |
Chandrasekaran NS, Nagarajan S. Microwave-assisted synthesis and anti-bacterial activity of some 2-amino-aryl-4(2-thienyl) pyrimidines[J]. Farnaco, 2005, 60(4): 279-282. |
| [4] |
Clark DA, Coker R. Transforming growth factor-beta (TGF-beta)[J]. Int J Biochem Cell Biol, 1998, 30(3): 293. DOI:10.1016/S1357-2725(97)00128-3 |
| [5] |
Sun JR, Ye YM. Altered behaviour and expression of Fos in rats bron in hypergravity and their readaptation to the nomal gravity[J]. Sheng Li Xue Bao, 2001, 53(1): 61-65. |
| [6] |
李春卉, 雷均涛, 潘文干, 等. 林蛙油保健品对超重辐射大鼠血清抑制羟自由基能力的研究[J]. 吉林医药学院学报, 2008, 29(5): 254-256. DOI:10.3969/j.issn.1673-2995.2008.05.002 |
| [7] |
潘文干, 吕士杰, 曹慧玲, 等. 超重和低气压环境下动物微波辐射的实验方法研究[J]. 吉林医药学院学报, 2008, 29(2): 63-65. DOI:10.3969/j.issn.1673-2995.2008.02.001 |
| [8] |
彭惠, 洪苏玲, 陶永贤, 等. 糖尿病仓鼠视网膜p38MAPK和TGFβ2的表达[J]. 第三军医大学学报, 2007, 29(8): 714-716. DOI:10.3321/j.issn:1000-5404.2007.08.018 |
| [9] |
Massague J, Chen YG. Controlling TGF-beta signal-ling[J]. Genes Dev, 2000, 14(6): 627-644. |
| [10] |
Moustakas A, Souchelnytskyi S, Heldin C H. SMAD regulation in TGF-beta signal transduetion[J]. J Cell Sci, 2001, 114(Pt24): 4 359-4 369. |



 ,
,