2. 第三军医大学电磁辐射医学防护教育部重点实验室
微波技术广泛地应用于通信、导航、军事等方面, 由此产生的电磁辐射污染对人体健康的影响也日益受到人们关注, 中枢神经系统的海马是微波损伤累及的主要部位[1], 而过氧化损伤可能是微波导致中枢神经系统损伤的主要机制之一[2], 因此通过抗氧化可能对微波的中枢神经损伤效应具有一定的防护作用。微量元素硒、锌、VE、VC具有明确的抗氧化作用、因此本实验通过探索微量营养素干预措施对微波辐射致中枢神经系统损伤进行保护。
1 材料与方法 1.1 实验动物和分组健康幼年Wistar大鼠80只, 体重(100±20)g, 雌雄各半。由第三军医大学实验动物中心提供。按性别和体重随机分为10组, 每组8只, 即普通饲料喂养(normal diet, ND)共5组, 其中包括普通饲料对照组(ND)、普通饲料慢性辐照组(NDC)、普通饲料急性辐照设三个时相:3h组(NDA3h)、24h组(NDA24h)、72h组(NDA72h); 微量营养素饲料喂养(micronutrient diet, MD)共5组, 其中包括营养干预对照组(MD)、营养干预慢性辐照组(MDC)、营养干预急性辐照设三个时相3h组(MDA3h)、24h组(MDA24h)、72h组(MDA72h)。
1.2 主要仪器及试剂仪器:微波源, HP8991A脉冲功率计, RQA-1A微波漏能仪, PM20显微镜照相系统(Olympus), CM1900冰冻切片机(LEICA), 台式低温高速离心机(Heraeus), 全自动生化仪(Olypus AU640), 超低温冰箱(SANYO)。
1.3 营养干预普通饲料组以基础饲料喂养, 基础饲料按中华人民共和国国家标准“实验动物全价营养饲料”(GB14924-94)要求配制。微量营养素干预组则是根据美国国家科学院提供的实验动物微量元素供给量, 并且再参考相关文献分别确定各种微量营养素在饲料中的添加量[3], 饲料中补充VC、VE、Na2SeO3和ZnSO4·7H2O的含量分别为0.5g/kg、0.25g/kg、0.44mg/kg(以元素计含Se量为0.2mg/kg)和219.87mg/kg(以元素计含Zn量为50mg/kg)。基础饲料及微量营养素添加饲料均由第三军医大学大坪医院实验动物中心代为加工。大鼠按组雌雄分笼饲养, 自由摄食和饮水, 连续喂养8周。
1.4 辐照模型将大鼠置于反射系数近似为零的微波暗室内进行辐照, 暗室环境温度及湿度由空调器、除湿机等调节保持恒定, 温度稳定于(20±2)℃, 相对湿度稳定于60%±10%。辐照时大鼠放置于可透射微波的专用辐照盒内接受全身辐照。慢性辐照组将大鼠每天暴露于微波源下20min, 连续辐照8周。急性辐照组将大鼠暴露于微波源下一次性辐照20min, 再分别以普通饲料和微量营养素添加饲料喂养8周后, 观察3h、24h、72h三个时相点。
1.5 脂质过氧化检测将冻存的海马脑组织取出并称量, 加入预冷的匀浆介质, 制成5%匀浆, 并于4℃以4 000r/min离心10 min, 提取上清液, Lowry法测定上清液的蛋白含量。采用硫代巴比妥酸(TBA)比色法测定丙二醛(MDA), 亚硝酸盐法测定超氧化物歧化酶(SOD), Fenton法测定羟自由基(ROS), 5, 5-双硫代对硝基苯甲酸(DTNB)显色法测定谷胱甘肽过氧化物酶(GSH-Px)。
1.6 统计分析实验结果用均数±标准差(x±s)表示, 采用SPSS11.0统计软件包对实验数据进行进行方差分析和t检验, 取P<0.05为相差显著。
2 结果 2.1 微波辐照后大鼠海马组织SOD活性变化由图 1可见, 急性辐照后普通饲料组和营养干预组的大鼠海马SOD活性在3 h、24 h时下降十分显著(P<0.01), 随后有所恢复。慢性辐照后, 普通饲料组的海马组织SOD活性明显下降(P<0.05), 营养干预组无明显变化(P>0.05)。与普通饲料组比较, 营养干预组急性辐照后24h海马组织SOD活性升高, 且有统计学意义(P<0.05)
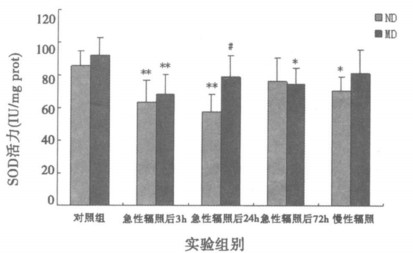
|
图 1 微波辐照后海马组织SOD活性变化 *P<0.05, **P<0.01, 与相应对照组比较; #P<0.05, 与普通饲料组比较。 |
由图 2可见, 急性辐照后24h普通饲料组和营养干预组的大鼠海马MDA含量显著增加(P<0.01), 一直持续72h(P<0.05)。慢性辐照后, 普通饲料组的海马组织MDA含量明显增多(P<0.05), 营养干预组无明显变化(P>0.05)。营养干预组急性辐照后72h和慢性辐照后海马MDA含量较普通饲料组少, 且有统计学意义(P<0.05)。
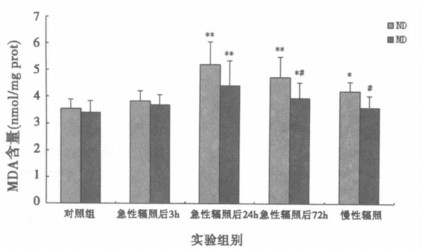
|
图 2 微波辐照后海马组织MDA含量变化 *P<0.05, **P<0.01, 与相应对照组比较; #P<0.05, 与普通饲料组比较。 |
由图 3可见急性辐照后普通饲料组大鼠海马GSH-PX活性各时相点较对照组均明显下降(P<0.01), 营养干预组在24h内显著下降(P<0.01)。慢性辐照后, 普通饲料组较对照组显著降低(P<0.01), 营养干预组与对照组相比无统计学意义(P>0.05)。营养干预组与普通饲料组比较, 急性辐照后72h和慢性辐照组较普通饲料组高, 且有统计学意义(P<0.05)。
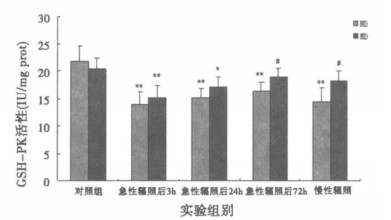
|
图 3 微波辐照后海马组织GSH-PX活性变化 *P<0.05, **P<0.01, 与相应对照组比较; #P<0.05, 与普通饲料组比较。 |
变化由图 4可见, 急性辐照后普通饲料组及营养干预组大鼠海马组织抑制RO S能力较对照组均明显下降(P<0.05)。慢性辐照后, 普通饲料组和营养干预组的海马组织抑制ROS能力较对照组均显著降低(P<0.05)。慢性辐照后营养干预组较普通饲料组高。
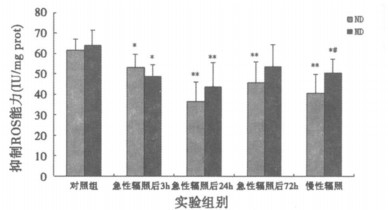
|
图 4 微波辐照后海马组织抑制ROS能力变化 *P<0.05, **P<0.01, 与相应对照组比较; #P<0.05, 与普通饲料组比较。 |
在生命正常的氧化代谢过程中, 可通过一系列化学反应生成活性氧自由基(reactive oxygen species, ROS), 当活性氧自由基得不到及时清除时, 就能攻击生物膜中的多不饱和脂肪酸(polyunsaturated fattyacid, PUFA)引发脂质过氧化作用, 从而形成脂质过氧化物, 如丙二醛(MDA)等[4]造成细胞损伤并导致疾病和机体损伤。而生物体又有一套抗氧化系统, 以维持机体的氧化与抗氧化平衡, SOD和GSH-Px就是机体重要的抗氧化酶, SOD可直接有效清除活性氧, GSH-Px可催化过氧化氢和脂质过氧化物分解[5], 是自由基清除系统的重要组成成分。实验发现, 微波急性辐照后大鼠海马组织ROS抑制能力明显下降, MDA含量明显升高, 并且SOD、GSH-Px活力都明显降低。证明微波辐照后可明显导致大鼠海马过氧化反应并且抗氧化能力明显降低。
本实验通过添加具有抗氧化作用的微量营养素硒、锌、维生素C、维生素E配制成营养饲料, 来研究微量营养素干预措施对微波致中枢神经系统损伤是否具有保护作用。实验发现营养素干预组与普通饲料组相互比较, 在急性辐照后24h、72h及慢性辐照后两组之间有明显差异, 结果提示微量营养素干预对微波辐照致中枢神经系统损伤具有保护作用, 并且这种保护作用在微波急性辐照后期或晚期以及慢性辐照中比较明显。
本实验结果表明长期摄入硒、锌、VE、VC这些微量营养素能够对抗微波辐照对大鼠的过氧化损伤, 并且这种保护作用可能是这些微量营养素共同发挥的综合作用。目前营养学研究发现还有其他的一些抗氧化作用的营养素, 如β胡萝卜素、牛磺酸, VA等, 因此在以后的研究中还需进一步摸索这些微量营养素的配伍组方, 以寻找到具有更好的抗微波所致的过氧化损伤作用的微量营养素干预方法。
| [1] |
Lai-H, Horita A, Guy Aw. Microwave irradiation affects radial-arm maze performance the rat[J]. Bioelectromagnetic, 1994, 15: 95-104. DOI:10.1002/(ISSN)1521-186X |
| [2] |
杨瑞华, 陈景元, 高双斌, 等. 高功率微波对视网膜神经节细胞脂质过氧化作用的实验研究[J]. 中华眼底病杂志, 2000, 16(3): 32-34. |
| [3] |
龚慕辛, 王蕾, 陈忻, 等. 抗氧化营养素配方对小鼠抗氧化能力的影响[J]. 营养学报, 2006, 28(3): 266-268. DOI:10.3321/j.issn:0512-7955.2006.03.021 |
| [4] |
Yamamoto M, Lidia K, Gong H, et al. Changes in manganese superoxide dismutase expression after exposure of the retina to intense light[J]. Histochem J, 1999, 31(2): 81-87. DOI:10.1023/A:1003510719302 |
| [5] |
Korac B, Buzadzic B. Selenium supplementation and GSH-Px activity in the IBAT and erythrocytes of cold-adapted rats[J]. Food Research International, 2002, 35(2): 221-224. |


