2. 吉林大学第一医院
大肠癌是常见的消化道恶性肿瘤, 治疗以手术为主, 但是大肠癌又是一种全身性疾病, 对于手术后及失去手术机会或转移性大肠癌患者均应该应用化疗、放疗等综合治疗。以提高病人生存质量, 降低复发率, 延长病人生存期, 提高治愈率[1]。但化疗的最大障碍是肿瘤细胞的多药耐药性, 特别是大肠癌细胞的多药耐药(MDR)原发性高表达及继发性高表达, 使得大肠癌细胞的多药耐药性明显高于其他肿瘤, 使化疗的效果明显低于其他肿瘤, 本研究通过检测不同剂量电离辐射对大肠癌细胞多药耐药基因MDR1的蛋白表达产物P-gp的影响, 探讨逆转肿瘤多药耐药的方法。
1 材料与方法 1.1 细胞株人大肠癌HCT-8细胞株, 由卫生部放射生物重点实验室提供。细胞培养在含10%小牛血清的RPMIl 640培养液内, 置37℃、5%C02培养箱内饱和湿度培养, 0.25%胰蛋白酶消化传代。
1.2 照射条件用国产X.S.S.250 (FZ)型固定式X射线深部治疗机照射, 电压200k V, 电流10mA, 滤板0.5mmCu+1.0 mmAl。低剂量照射(0.05 ~ 0.2Gy)全身照射, 靶皮距247.3cm, 剂量率0.0125Gy /min。较高剂量照射(2Gy)全身照射, 靶皮距56cm, 剂量率0.287Gy /min。
1.3 细胞耐药模型的制备取处于对数生长期细胞, 在无菌条件下操作。分别以35、350和3 500μg · L-1阿霉素(ADM)孵育3d, 而后恢复3d, 镜下观察细胞形态及数量, 发现350μg · L-1组细胞数量适中形态完好, 故以400μg · L-1 A DM做为HCG-8细胞耐药模型刺激浓度。取处于对数生长期细胞, 在无菌条件下操作。首先以50μg · L-1ADM孵育3d, 而后恢复3d, 倍量(100μg · L-1)孵育3d, 再次恢复3d, 如此反复至浓度增至400μg · L-1, 收取细胞待用。同时设空白对照(不加药物刺激)及一直用同一剂量刺激组做平行对照。
1.4 照射模型的制备将耐药细胞分为以下5组: A:假照射组; B :大剂量组(2Gy); C : 0.05Gy+2Gy组(先给予0.05Gy低剂量照射后再给予2Gy大剂量照射, 以下同); D: 0.1Gy+2Gy组; E : 0.2Gy+2Gy。大、小剂量间隔4h照射, 大剂量照射后24h收取细胞待测。每组设重复样品4个。
1.5 流式细胞术(FCM)检测P-gp蛋白表达本实验采用美国B-D公司生产的FACScan流式细胞仪, 激发光源为15mW氩离子激光, 波长488nm, 应用间接免疫荧光, FCM检测。将HCT-8单细胞悬液, PBS洗2次, 弃上清, 吸取细胞, 注入到75%冷乙醇中固定, 4℃放置过夜。用PBS洗HCT-8细胞, 除去乙醇, 1 200rpm离心5min, 重复2次, 每份样品加第一抗体P-gp单抗50μl (1: 100), 4℃反应45min, PBS洗2次, 1 200rpm离心5min; 加第二抗体Gootanti-mouse IgG-FITC(1: 100稀释), 4℃反应45min, PBS洗涤2次, 加PBS500μl, 进行FCM检测。
1.6 统计学方法文中结果以平均值±标准差(x±s)表示, 两两比较采用t检验。
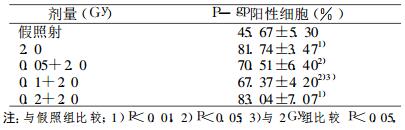
2 结果将HCT-8单细胞悬液75%冷乙醇固定后, 用间接免疫荧光技术, 采用流式细胞仪检测X射线对HCT-8细胞P-gp表达的影响。由表 1可见, 与假照组相比, 2Gy大剂量照射后Pgp阳性细胞百分率明显增加(P < 0.01), 先给予低剂量照射(0.05Gy, 0.1Gy)后, 再给予大剂量照射, P-gp阳性细胞百分率亦有明显增加(P < 0.05), 0.2Gy+2 Gy组P-gp阳性细胞百分率明显增加(P < 0.01)。与单纯2Gy大剂量照射组比较, 0.1Gy+2Gy组P-gp阳性细胞百分率明显降低(P < 0.05)。
|
|
表 1 X射线对HCT-8细胞P-gp表达的影响 |
大肠癌是常见的消化道恶性肿瘤, 在经济发达的国家北美、西欧、北欧等国占第l、2位, 我国大肠癌发病率有上升趋势。大肠癌治疗以手术为主, 但是大肠癌又是一种全身性疾病, 虽然肿瘤被完全切除, 但当原发肿瘤出现明显症状之前, 可能己发生播散性转移。对于手术后及失去手术机会或转移性大肠癌患者均应应用化疗、放疗等综合治疗。以提高病人生存质量, 降低复发率, 延长病人生存期, 提高治愈率。但化疗的最大障碍是肿瘤细胞的多药耐药性, 多药耐药(MDR)在人类肿瘤化疗过程中普遍存在, 产生MDR的一个重要机制是MDR基因MDR1过度表达。特别是大肠癌细胞的MDRl原发性高表达及继发性高表达, 使得大肠癌细胞的多药耐药性明显高于其他肿瘤, 使化疗的效果明显低于其他肿瘤。
产生多药耐药原因目前认为是一种是先天性获得, 即癌细胞在突变形成过程中, MDR-1基因被激活、转录、翻译产生P -糖蛋白(P-gp), 使癌细胞获得自我保护性, 即产生抗药性; 另一种是在化疗药物治疗过程中, 由于剂量不足或药物敏感性低, 不能直接杀死癌细胞, 而使癌细胞内MDR-1基因激活, 使癌基因产生耐药性, 称为获得性耐药性。无论先天性或获得性耐药性, 一旦产生, 将严重影响肿瘤的化疗和患者的康复。许多研究表明MDR1/P-gp与病人治疗结果密切相关, MDRl / P-gp阳性病人生存期短, 缓解率低, 复发率高, 因此, MDR1/Pgp的分析可作为癌症治疗结果的预测指标, 使化疗个体化, 临床医生可根据每个病人MDR1/P-gp的表达水平判断耐药程度, 合理地制定治疗方案, 是临床医生指定治疗方案的参考依据。因此, MDRl /P-gp的检测有其重要性[2]。
P-gp由1 280个氨基酸构成, 是一种分子量为170 kD的跨膜蛋白, 与细菌的输送蛋白十分相似。具有将抗癌药泵出细胞, 使细胞内药物浓度降低的功能。MDR1/P-gp介导的MDR是可以逆转的, 逆转剂可以同抗肿瘤药物竞争P-gp上的结合位点, 降低抗肿瘤药物的外流, 增加细胞内药物的积累, 从而恢复肿瘤细胞对抗肿瘤药物的敏感性。目前发现的逆转剂主要有维拉帕米、环孢菌素A、奎尼丁、三苯氧胺、类固醇激素、MRK-16、肿瘤坏死因子(TNF)等[3]。
本实验采用流式细胞术检测的P-gp变化, 结果显示2Gy刺激后P-gp表达明显升高, 表明大剂量辐射可明显增加肿瘤细胞的多药耐药性, 这与有关文献报导一致[4-5], 可能机制之一是大剂量辐射可使蛋白激酶C(PKC)蛋白表达明显增加, 进一步诱导MDR1基因过度表达和加速P-gp的磷酸化, 而导致MDR的发生[6]。而预先施以低剂量0.05、0.1Gy均使高表达的MDR显著降低, 表明低剂量辐射可以逆转大剂量所致的多药耐药, 考虑是由于低剂量辐射后再给予大剂量辐射可使高表达的P KC蛋白降低所致。以上研究提示在大肠癌的综合治疗中, 因放疗可致大肠癌细胞MDR发生, 影响化疗疗效, 故手术治疗后应在给予系统化疗后, 依病情再给予放疗。
| [1] |
李啸峰, 张矛, 马琳, 等. 54例直肠癌术后复发因素分析[J]. 实用肿瘤学杂志, 1995, 10(4): 61-62. |
| [2] |
Perez-Gutierrez S, Gonzalez-Campora R, Amerigo-Navarro J, et al. Expression of P-glycoprotein and metal lothione in ingastrointestinal stromal tumor and leiomyosarcomas.Clinical implications[J]. Pathol Oncol Res, 2007, 13(3): 203-208. DOI:10.1007/BF02893500 |
| [3] |
Lim S, Grassi J, Akhmedjanova V, et al. Reversal of P-glyco-protein-mediated drug effluxby eudesmin from Haplophyllum perforatum and cytotoxicity pattern versus diphyllin, podophyl-lotoxin and etoposide[J]. Planta Med, 2007, 73(15): 1563-1567. DOI:10.1055/s-2007-993754 |
| [4] |
Maier P, Fleckenstein K, Li L, et al. Over expression of MDR1 using are troviral vector differential lyregulates genesinvolved in detoxification and apoptosis and confers radiopro-tection[J]. Radiat Res, 2006, 166(3): 463-473. DOI:10.1667/RR0550.1 |
| [5] |
Bartkowiak D, Hipp PR, Mendonca MS, et al. Aradioprotective effect of imatinib in human squamous carcinom a cells[J]. Strah lenther Onkol, 2007, 183(8): 432-439. DOI:10.1007/s00066-007-1680-7 |
| [6] |
李啸峰, 马琳, 迟宝荣. 大肠癌多药耐药细胞蛋白激酶C的表达及作用[J]. 吉林大学学报(医学版), 2006, 32(3): 458-460. |



 ,
,