2. 河北医科大学第四医院;
3. 河北省疾控预防中心
临床上对胸部、头颈部等恶性肿瘤患者进行放射治疗时, 当照射剂量达(10 ~ 20Gy)/(1 ~ 2W)时, 照射野中的正常食管粘膜常发生充血、水肿, 患者表现为吞咽困难; 当照射剂量达30Gy~ 40Gy时, 患者表现为局部疼痛、胸骨后烧灼感, 重者疼痛难以忍受, 进食时更为显著, 临床上称为放射性食管炎[1]。放射性射线对正常食管组织的破坏, 原理上被认为是由电离所产生的氧自由基所引起的[2]。复方芍根口服液是一种在临床上对放射性食管炎治疗效果良好的中药复方提取的口服液, 但是, 其作用机理不清。本研究通过检测放射性食管炎大鼠经复方芍根口服液治疗后, 食管组织和血清中氧自由基-羟自由基(OH·)和一氧化氮(NO)含量及其抗氧化酶-过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-PX)活力的变化, 从氧化及抗氧化指标的观察分析了复方芍根口服液治疗放射性食管炎的药理作用。
1 材料和方法 1.1 实验动物96只清洁级Wistar大鼠, 180 ~ 220g, 雌雄各半, 由河北省实验动物中心提供(动物合格证号为603067)。
1.2 药物复方芍根口服液采用中药验方制备, 主要成分为白芍、山豆根、白芨等14味中药。首先用单提法, 后采用少量分次蒸发浓缩法制备中药口服液—复方芍根口服液(compound white peony root oral liquids, cWPROL), 该制剂含生药浓度为2.88g/ml, 相对密度约为1.18, 采用理化鉴别法及薄层色谱法控制其内在质量。实验中应用西药对照治疗药物为盐酸利多卡因注射液(2%, 上海复星朝晖药业公司)、地塞米松磷酸钠注射液(5mg/支, 浙江仙琚制药股份有限公司)、硫酸庆大霉素注射液(4万U/ml, 华北制药集团制剂有限公司)和生理盐水(250ml, 石家庄四药有限公司)。
1.3 主要试剂考马斯亮兰蛋白测定试剂盒, 羟自由基(HO)试剂盒, NO试剂盒, GSH-PX试剂盒, CAT试剂盒均由南京建成生物工程研究所提供。
1.4 急性放射性食管炎动物模型的制作[3]将实验大鼠置于特制的有机玻璃固定器内, 清醒状态下应用60Co治疗机(山东新华厂生产, FCC-8000C型, SSD=80cm, 剂量率111cGy/min)对胸部进行单次照射, 照射总量为43Gy, 照射野为3cm×30cm, 中心剂量点为大鼠背部体表下1cm处, 照射范围为食管上段3cm, 其余部位遮蔽。
1.5 实验动物的分组及给药方法将方法4制备的放射性食管炎大鼠模型随机分为预防组、治疗组、单纯照射组, 以正常大鼠(不做任何处理)作为对照。每组12只大鼠, 雌雄各半。预防组大鼠连续用药14d, 治疗组连续用药8d。预防组分为复方芍根口服液正常剂量及大剂量预防组(从放射结束开始给药, 2ml×3/d复方芍根口服液, 连续给药14d)。治疗组分为复方芍根口服液正常剂量及大剂量治疗组(从放射结束后第7天给药, 2ml×3/d复方芍根口服液, 连续给药8d)和西药治疗对照组(从放射结束后第7天给药, 2ml×3/d庆大霉素、利多卡因、地塞米松合剂)。单纯照射组分为单纯照射一组(从被放射结束后, 不经任何处理第7天处死大鼠)、单纯照射二组(从被放射结束后, 不经任何处理第15天处死大鼠)。所有用药组大鼠, 均采用灌注法将药物缓慢灌入大鼠食管, 使食管粘膜表面接触到药物。复方芍根口服液正常给药量由人的给药量换算而来[4], 其生药浓度为0.475g/ml。复方芍根口服液大剂量组药物浓度是正常剂量组浓度的3倍, 其生药浓度为1.425 g/ml。大鼠口服的治疗用西药是临床上常用的药物, 根据药物学用量标准, 调整用药量[5-8]。西药口服液配方为NS250ml, 2%利多卡因20 ml, 地塞米松10mg, 硫酸庆大霉素32万单位。大鼠口服西药浓度为人的0.16倍。大鼠中、西医灌药量均为2ml/次, 3次/日, 间隔6h给药。大鼠服药后, 禁食禁水30min。
1.6 标本的采集及组织匀浆液的制备将实验用大鼠于各实验结束点, 用2%戊巴比妥钠经腹腔麻醉给药后(45mg/kg), 剪开腹股沟处皮肤, 从股静脉采血3ml, 3 000r/min离心10min, 留取血清, 用于NO测定。取全长食管, 经冷生理盐水漂洗, 除去血液, 滤纸拭干, 称重, 加入组织块重量9倍体积的预冷匀浆介质(pH7.4, 0.01mol/L Tris-HCl, 0.1μmol/LEDTA-2Na, 0.01mol/L蔗糖, 0.8%氯化钠溶液), 用眼科剪尽快剪碎组织块, 用组织捣碎机(江苏江阴科研器械厂)研磨制成10%的组织匀浆液(10 000 ~ 15 000r/min, 10s/次, 间隙30s, 连续3 ~ 5次), 所有操作均在冰水中进行。将制备好的10%匀浆液3 000 r/min低温离心(Labofuge 400r低温高速离心机, 德国生产)10 ~ 15min, 留取食管组织匀浆液上清备用。
1.7 实验方法血清和组织匀浆液中蛋白质含量用考马斯亮兰法测定, NO含量采用NO3-/NO2-法, OH·、CAT及GSHPX应用比色法测定。组织匀浆液最佳测定浓度为NO (10%), OH· (0.5%), CAT(1%), GSH-PX(2%)。
1.8 数据的统计学处理数据均采用SPSS13.0软件包进行统计学分析。数据比较用OneWayANOV分析, 方差齐时, 均数的两两比较方差相同时采用Student-Newman-Keuls检验, 方差不齐时采用Kruskal-WallisH检验, 两两比较应用Nemenyi法。数据结果均以x±s表示, P < 0.05有统计学意义。
2 结果 2.1 各组大鼠食管组织中一氧化氮(NO)含量的变化43Gy 60Coγ射线局部照射后第7天可诱导大鼠放射性食管炎发生, 照射后14d时, 大鼠食管炎持续存在[3]。大鼠经43Gy60Coγ射线照射后7d时如图 1结果所示, 经43Gy60Coγ射线照射后7d时, 大鼠食管组织中的NO含量与正常组大鼠相比明显升高(P < 0.05);照射后14d时, 显著升高(P < 0.01)。复方芍根口服液正常剂量预防组、大剂量预防组、正常剂量治疗组、大剂量治疗组大鼠, 其食管组织中的NO含量与单纯放射二组相比明显下降(P < 0.01), 各中药预防和治疗组食管组织中的NO水平与正常组大鼠无明显差异(P>0.05)。西药治疗组大鼠, 其食管组织中的NO含量与单纯放射二组相比也均显著下降(P < 0.01)。各用药组之间相比, 以大剂量复方芍根治疗组和西药治疗组大鼠食管组织中NO含量的下降水平更为明显。
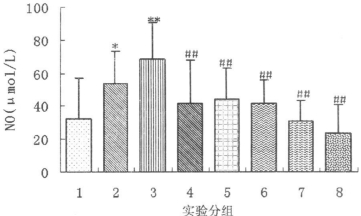
|
图 1 各组大鼠食管组织中NO含量测定结果 注:与正常组比较, *P<0.05;**P<0.01。与单纯照射二组比较, ## P<0.01。1:正常对照大鼠; 2:单纯照射一组; 3:单纯照射二组; 4:中药正常剂量预防组; 5:中药大剂量预防组; 6:中药正常剂量治疗组; 7:中药大剂量治疗组; 8:西药对照组。 |
如图 2结果所示, 各组大鼠的血清中, NO水平差异无显著性(P>0.05)
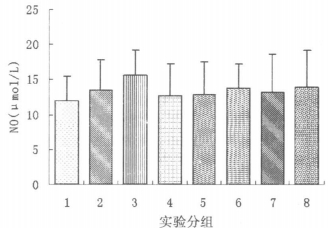
|
图 2 各组大鼠血清中NO含量(μmol/L)(图中的实验分组同图 1) |
如图 3结果所示, 经43Gy60Coγ射线照射后14d时, 大鼠食管组织中羟自由基(OH·)含量与正常大鼠相比明显升高(P < 0.05)。复方芍根口服液正常剂量预防组、正常剂量治疗组大鼠, 其食管组织中羟自由基(OH·)含量与单纯放射二组大鼠相比明显下降(P < 0.05), 大剂量治疗组大鼠食管组织中的羟自由基(OH·)含量则显著下降(P < 0.01), 与正常组大鼠食管组织中的羟自由基(OH·)水平无明显差异(P>0.05)。西药治疗组大鼠, 其食管组织中的羟自由基(OH·)含量与单纯放射二组相比差异无显著性(P>0.05)。各用药组大鼠之间相比, 以大剂量复方芍根口服液治疗组大鼠食管组织中的羟自由基(OH·)含量下降最为明显。
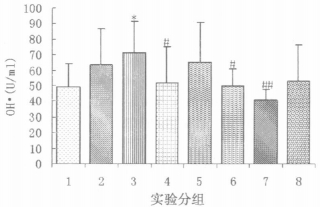
|
图 3 各组大鼠食管组织中羟自由基(OH·)含量测定结果(图中的实验分组同图 1) 注:与正常大鼠比较, *P<0.05。与单纯照射二组大鼠比较, #P< 0.05, ##P<0.01。 |
如图 4结果所示, 经43Gy60Coγ射线照射后7d和14d时, 大鼠组织食管组织中GSH-PX活力与正常组大鼠相比显著升高(P < 0.01)。复方芍根口服液正常剂量预防组、大剂量预防组、正常剂量治疗组、大剂量治疗组大鼠, 其食管组织中的GSH-PX活力与单纯放射二组相比明显下降(P < 0.05)。中药用药后, 食管组织中的GSH-PX活力与正常组大鼠差异无显著性(P>0.05)。西药治疗组大鼠, 其食管组织中的GSHPX活力与单纯放射二组相比也有明显降低(P < 0.05)。
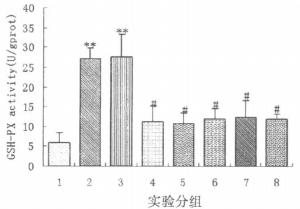
|
图 4 各组大鼠食管组织中GSH-PX活力(图中的实验分组同图 1) 注:与正常组比较, **P<0.01。与单纯照射二组比较, #P<0.05。 |
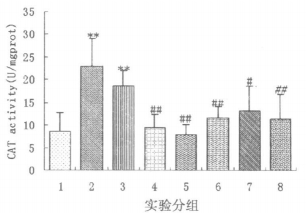
如图 5结果所示, 经43Gy60Coγ射线照射后7d和14d时, 大鼠食管组织中CAT的活力与正常组大鼠相比显著升高(P < 0.01)。复方芍根口服液正常剂量预防组、大剂量预防组、正常剂量治疗组、大剂量治疗组大鼠, 其食管组织中的CAT活力与单纯放射二组大鼠相比明显下降(P < 0.05), 与正常组大鼠食管组织中的CAT活力差异无显著性(P>0.05)。西药治疗组大鼠食管组织中CAT活力与单纯放射二组相比显著下降(P < 0.01)。
|
图 5 各组大鼠食管组织中CAT活力(图中的实验分组同图 1) 注:与正常组比较, **P<0.01。与单纯照射二组比较, #P<0.05, ## P<0.01。 |
自由基是指在外层电子轨道含有一个或者多个不配对电子的原子、原子团或分子。氧分子衍生的自由基称为氧自由基, 体内如有过多的氧自由基, 可攻击细胞膜的脂肪酸、蛋白质、核酸, 引起膜流动性降低、通透性增高、线粒体肿胀、溶酶体破坏和溶酶体酶释放, 导致组织损伤, 引起和加剧炎症反应[9]。γ射线可使食管组织中的H2O大量分解成羟自由基(OH·), OH·化学性质活跃, 损伤能力很强[2]。Templeton等的实验结果证实[10], 低LET射线-γ射线诱导的组织损伤, 大约90%是由OH·引起的。羟自由基(OH·可导致组织严重损伤, 一方面是由于OH·在体内的扩散距离可达215nm, 对靶分子的危害性较大, 另一方面也与体内尚无专一清除OH·的物质有关[11]。NO是一种无色、微溶于水、脂溶性较强的气体分子, 其性质极不稳定, 很快被氧化成NO3-或NO2-。不同浓度的NO可能对粘膜组织产生不同的影响, 低浓度时有较强的血管扩张作用, 对粘膜有保护作用, 而高浓度时, 对粘膜组织可能是有害的[12]。高浓度的NO可与超氧阴离子O2-结合, 形成超氧亚硝酸根离子(ONOO-), 继续分解成OH·和NO2, 该两种自由基具有很大的毒性, 也可引起核酸的亚硝酰化, 导致DNA链断裂, 还可与一些酶分子的铁-硫中心结合, 发生一系列生化改变, 可介导谷氨酸的细胞毒性, 损伤组织细胞[13]。大量实验表明, γ射线照射可使小鼠体内器官产生NO增加[14], 进而可造成低氧仓鼠肺的辐射敏感性增加, 加重肺损伤[15]。食管炎患者, 其食管壁内含NO的细胞密度及含量明显增多, 并且NO的浓度与食管炎程度呈正相关[12]。电离辐射造成的自由基堆积可使DNA分子单链或双链结构断裂, 蛋白质肽链断裂或二硫键结构改变, 细胞膜结构中的不饱和脂肪酸氧化, 产生过多的过氧化脂质, 造成细胞的破坏和组织损伤。
然而, 体内存在有抗氧化系统, 其内源性酶类具有中和与减轻活性氧毒性反应的功能。机体内自身抗氧化酶系清除系统主要包括CAT, GSH-PX等。它们能清除OH·, H2O2, O2-等活性氧及其脂质过氧化物, 阻断活性氧自由基对机体的进一步损伤, 是生物体内重要的活性氧自由基清除剂, 可最大限度地保护食管粘膜免受辐射损伤[16]。但是, 人工合成的抗氧化剂往往具有毒副作用, 并且价格较高, 因此, 国内外学者普遍关注中医药, 试图从天然物质中寻找高效低毒的抗氧化剂。
本研究中, 大鼠的食管部位经43Gy60Coγ射线照射后7d和14d时, 食管组织匀浆液中OH·和NO含量明显上升; 相应的内源性抗氧化酶-CAT和GSH-PX也明显升高。辐射使抗氧化酶升高的原因可能是由于自由基对细胞膜的攻击, 导致膜结构破坏和功能损害, 细胞膜通透性增高, 使细胞内酶溢出; 也可能由于大量的自由基诱导机体的抗氧化酶系统产生抗氧化应激反应。放射性食管炎大鼠, 经复方芍根口服液治疗后, 食管组织匀浆液中羟自由基(OH·)和NO含量均较单纯放射组明显下降。提示复方芍根口服液可明显降低放射性食管炎氧自由基水平, 从而保护食管组织, 减轻氧自由基对其造成的损伤。这可能是由于复方芍根口服液中含有多种黄酮类和皂甙类物质, 这些物质本身具有抗氧化活性作用, 可直接与氧自由基反应清除自由基[17]。经复方芍根口服液治疗后, 大鼠食管组织中NO含量明显下降, 该结果也说明复方芍根口服液具有促进大鼠放射性食管炎创口愈合的能力。因为, 在创口愈合晚期, 诱导型一氧化氮合酶(iNOS)活性下降, 创口分泌液抑制中性粒细胞、嗜酸性粒细胞、巨噬细胞内iNOS的表达及分泌液中精氨酸酶活性升高, 使iNOS合成的NO减少[18]。用药后, 大鼠食管组织中的CAT和GSH-PX活力也由于氧自由基水平的显著下降而相应降低。各组大鼠间血清中NO含量差异无显著性, 可能是由于血清中NO在γ射线照射后早期增加[19], 照射后7d和14d已恢复正常。放射性食管炎大鼠食管组织匀浆液NO含量明显升高, 而各组血清中NO水平无明显变化, 也可能是由于放射性食管炎是局部炎症, 病变范围局限, 不能导致血清NO含量的显著性增高。
食管表面有许多正常菌群, 可将分泌液中的硝酸盐降解为亚硝酸盐, 在酸性条件下, 可不断释放NO。抗生素可通过减少这类NO的产生, 发挥抗菌作用。所以, 西药治疗组大鼠食管组织中NO含量明显下降。NO的降低也可能是由于激素类药物通过抑制炎细胞的趋化作用, 降低炎细胞(中性粒细胞、嗜酸性粒细胞、单核细胞、巨噬细胞)的呼吸爆发或者降低诱导型一氧化氮合酶(iNOS)的活性, 从而减少其产物所引起的。但是, 西药治疗无明显降低大鼠食管组织中羟自由基(OH·)含量的能力。西药可降低部分氧自由基含量, 也可引起内源性CAT和GSH-PX活力下降, 所以在临床上大量应用后, 可起到治疗放射性食管炎的作用。
复方芍根口服液可能通过减少食管组织中NO、羟自由基(OH)含量, 降低氧自由基的含量, 从而引起内源性CAT和GSH-PX活力下降, 进而抵抗放射性射线对大鼠食管组织的损伤, 起到保护正常食管组织的作用。从降低氧自由基的角度观察到, 中药优于西药。复方芍根口服液疗效好, 临床应用后无任何毒副作用, 对颈、胸部癌症患者放射治疗后, 预防及治疗其放射性食管炎, 有在临床上推广的价值。
| [1] |
徐燮渊, 俞受程, 曾逖闻, 等. 现代肿瘤放射治疗学[M]. 北京: 人民军医出版社, 2000: 727.
|
| [2] |
夏寿萱主编.放射生物学[M].北京: 军事医学科学出版社, 1998: 22-45.
|
| [3] |
单保恩, 沈莉, 张莉, 等. 放射性食管炎动物模型的构建[J]. 中华肿瘤防治, 2007, 14(1): 13-16. |
| [4] |
陈奇主编.中药药理研究方法学[M].北京: 人民卫生出版社, 1993: 30-33.
|
| [5] |
姚卫华. 沙参麦门冬汤加味防治放射性食管炎疗效观察[J]. 中华放射医学与防护杂志, 2004, 24(4): 376. DOI:10.3760/cma.j.issn.0254-5098.2004.04.044 |
| [6] |
祝爱峰, 闫向远, 任军华, 等. 中西医结合治疗放射性食管炎的体会[J]. 中华放射肿瘤学杂志, 2003, 12: 58. |
| [7] |
陈新谦, 金有豫, 汤光. 新编药物学[M]. 北京: 人民卫生出版社, 2003: 27.
|
| [8] |
施新猷, 王四旺, 顾为望, 等. 比较医学[M]. 西安: 陕西科学技术出版社, 2003: 695.
|
| [9] |
DJORDJEVIC VB. Free radicals in cell biology[J]. Int Rev Cytol, 2004, 237: 57-89. DOI:10.1016/S0074-7696(04)37002-6 |
| [10] |
TEMPLETON P M, CHERIAN M G. Toxicological significance of metallothionein[J]. Methods Enzymol, 1991, 205: 11-24. DOI:10.1016/0076-6879(91)05079-B |
| [11] |
王崇道, 强亦忠. 电离辐射所致自由基对机体的损伤与自由基清除剂的研究[J]. 中华放射医学与防护杂志, 2002, 22(6): 461-463. DOI:10.3760/cma.j.issn.0254-5098.2002.06.034 |
| [12] |
王虹, 刘宾. 一氧化氮与胃食管疾病关系的研究进展[J]. 中华内科杂志, 2003, 43(12): 882-883. DOI:10.3760/j.issn:0578-1426.2003.12.029 |
| [13] |
WINK D A, MITCHELL J B. Chemical biology of NO: Insights into regulatory, cytotoxic and cytoprotective mechanisms of NO[J]. Free Radic Biol Med, 1998, 25: 434-456. |
| [14] |
龚守良. 一氧化氮与电离辐射[J]. 国外医学.放射医学核医学分册, 2000, 24(4): 170-173. |
| [15] |
MITCHELL J B, DEGRAFF, KIM S, et al. Redos generation of nitric oxide to radiosensitize hypoxic cells[J]. Int J Radiat Oncol Biol Phys, 1998, 42: 795-798. DOI:10.1016/S0360-3016(98)00327-7 |
| [16] |
NAKAMURA Y, FENG Q, KUMAGAI T, et al. Ebselena glutathione peroxidase mimetic seleno-organic compound as a multifunctional antioxidant.Implication for inflammation-associated arcinogenesis[J]. J Biol Chem, 2002, 277: 2687. DOI:10.1074/jbc.M109641200 |
| [17] |
先宏, 吴可, 先存普. 中药抗氧化活性的主要成分及其自由基清除作用[J]. 国外医学.中医中药分册, 2003, 25(3): 150-153. |
| [18] |
REICHNER J S, MESZAROS A J, LOUIS CA, et al. Molecular and metabolic evidence for the restricted expression of incucible nitric oxide synthase in healing wounds[J]. AM J Pathol, 1999, 154(4): 1097-1104. |
| [19] |
CLARENCON D, LESTAEVEL P, LAVAL J D, et al. Valtametric measurement of blood nitric oxide in irradiated rats[J]. Int J Radiat Biol, 1999, 75: 201-208. DOI:10.1080/095530099140654 |




