随着微波日益广泛的应用, 电磁辐射已成为影响人类健康的四大环境污染之一, 有关电磁辐射生物效应的研究已成为现代卫生学工作者亟待解决的重要课题。目前研究表明, 一定剂量的电磁辐射具有明显的中枢神经损伤效应, 其中尤其以海马脑区最为敏感[1、2], 电磁辐射不仅能影响学习记忆功能等神经行为功能, 还能引发脑内神经元凋亡等多种病理反应[3]。但电磁辐射对小胶质细胞是否有影响, 以及有哪些细胞信号转导系统参与, 目前相关研究报道还较少。JAK/STAT(janus activated kinase/signal transducers and activators of transcription)信号通路是近年来研究发现的广泛参与脑内许多重要病理生理过程的信号转导系统[4]。本实验室前期研究也发现, 电磁辐射后神经细胞Jak家族基因出现差异表达[5]。因此本研究通过观察电磁辐射后海马脑区小胶质细胞活化状态以及JAK家族蛋白活化水平的变化, 探讨该信号通路在电磁辐射所致海马脑区小胶质细胞活化过程中可能发挥的作用。
1 材料与方法 1.1 主要试剂山羊来源的抗磷酸化Jak1, Jak2, Jak3多克隆抗体购自美国SantaCruz公司, 小鼠来源的抗β-actin单克隆抗体、GSA-IB4、PMSF、Leupeptin、Apotinnin购自美国Sigma公司; HRP标记的兔抗山羊抗体, HRP标记的山羊抗小鼠抗体, DAB显色试剂等购自中杉公司。
1.2 实验方法 1.2.1 实验分组SPF雄性SD大鼠, 体重180~220g, 由第三军医大学实验动物中心提供。实验动物随机分为两组, 对照组(0 mW/cm2, 20 min)和辐照组(90 mW/cm2, 20 min), 辐照组观察电磁辐射辐照后0 h、3 h、12 h、24 h、72 h 5个时相点, 对照组和实验组每个时相点均观察4只动物。
1.2.2 动物电磁辐射暴露电磁辐射暴露在反射近似零的微波暗室内进行, 辐照环境温、湿度保持恒定。动物置于可透射电磁波的专用辐照盒内, 在H、E场强均匀分布的平台上接受20 min一次全身辐照。
1.2.3 免疫组化检测海马脑区小胶质细胞GSA-IB4的表达据实验要求, 于各时相点将大鼠麻醉, 4%多聚甲醛经左心室灌注, 取全脑于4%的多聚甲醛中固定, 石蜡包埋, 常规切片5μm。石蜡切片脱蜡、水化; 3%H2O2甲醇溶液处理20min,; 正常兔血清封闭30min; 倾去多余血清, 滴加1:200稀释的GSA-IB4一抗, 湿盒内4℃孵育过夜; PBS洗3次, 每次10min; 滴加HRP标记的抗GSA-IB4二抗, 室温孵育2h, PBS洗3次, 每次10 min, DAB显色。
1.2.4 Westernblot检测大鼠海马脑区磷酸化Jak1、Jak2、Jak3表达大鼠经电磁辐射暴露后, 在各时相点断头, 分离双侧海马, 加入1 ml预冷总蛋白裂解液(RIPA含蛋白酶抑制剂与磷酸化酶抑制剂), 匀浆后, 提取大鼠海马脑组织总蛋白, Lowry法测蛋白质含量。采用8%分离胶, 5%的浓缩胶, 以100 μg总蛋白上样进行聚丙烯酰胺凝胶电泳, 将凝胶中的蛋白转印于PVDF膜, 在含5%脱脂奶粉的TTBS液中封闭3 h.然后膜再置于山羊抗磷酸化的Jak1、Jak2、Jak3多克隆抗体(1:200)中4℃过夜, 取出以TTBS洗4次, 每次10min。TTBS稀释的HRP标记的抗山羊二抗(1:300)室温1 h, TTBS洗4次, 每次10 min, DAB显色.β-actin检测方法与JAKs检测方法相一致。显色条带在QuantityOne分析软件上测定灰度值, 并进行定量分析。每次实验重复四次, 选取有代表性的Western-blot电泳结果作图示。
1.3 统计分析实验数据采用SPSS13.0软件进行统计分析, 取P<0.05为相差显著, 实验结果用均数±标准差(x±s)表示。
2 结果 2.1 辐照对肛温和比吸收率的影响用热电偶点温计测定大鼠在辐照前后即刻肛温, 计算各组大鼠比吸收率(SAR值), 计算公式如下:
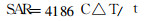
|
公式中C:组织比热, 取0.83kcal/kg℃; ΔT:大鼠在辐射前后肛温变化值; t:辐照时间(s)。由表 1可知, 对照组假性辐照20 min后大鼠辐照前后肛温无明显改变(P<0.05), 而电磁波辐照20 min后大鼠肛温较辐照前升高2.76℃, 其SAR值为11.21 W/kg, 提示90 mW/cm2电磁辐射对动物存在明显热效应。
|
|
表 1 电磁辐射后大鼠肛温及SAR值变化(x±s) |
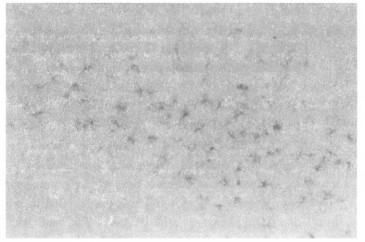
以凝集素GSA-IB4进行免疫组化染色, 观察电磁辐射后大鼠中枢神经系统海马脑区小胶质细胞活化状态。正常对照组也有少数GSA-IB4阳性染色细胞, 颜色也较浅, 细胞形态不够清晰, 胞体较小, 周围有细小的分支。辐照后即刻阳性染色细胞开始增多, 胞体较大。辐照后3h阳性染色细胞明显增多, 颜色深染, 形态清楚, 胞体增大, 有明显突起和树枝样分支。12h后仍有较多的阳性染色细胞。24h后阳性染色细胞进一步增多, 突起减少, 部分细胞呈杆状。72h后阳性染色细胞数量及细胞形态恢复至对照组水平。见图 1至图 4。

|
图 1 对照组大鼠海马脑区小胶质细胞GSA-IB4免疫组化染色(×200) |

|
图 2 电磁辐射后0 h大鼠海马脑区小胶质细胞GSA-IB4免疫组化染色(×400) |
|
图 3 电磁辐射后3 h大鼠海马脑区小胶质细胞GSA-IB4免疫组化染色(×400) |

|
图 4 电磁辐射后24 h电磁辐射后海马脑区小胶质细胞GSA-IB4免疫组化染色(×200) |
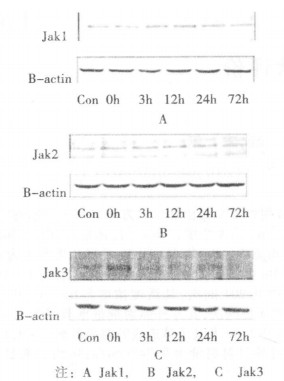
Jaks蛋白质磷酸化水平的影响电磁波辐照后大鼠海马Jak1、Jak2、Jak3蛋白质磷酸化的Western-blot结果见图 5。
|
图 5 电磁波辐照对大鼠海马Jaks磷酸化水平的影响 |
对Jaks蛋白质磷酸化的Western-blot结果进行统计学分析, 见图 6。电磁辐射能够上调大鼠海马脑区Jak1、Jak2、Jak3的蛋白磷酸化水平, 但三者磷酸化水平的变化形式又互不相同。海马脑区磷酸化Jak1在辐照后0h即可检测到明显升高, 且在24h以内均高于对照组, 12 h达到峰值, 与对照组相比, 升高了约41%(P<0.01), 72h基本恢复至正常水平。海马脑区Jak2磷酸化水平在辐照后0h即到达峰值, 与对照组相比, 升高了约36%(P<0.01), 此后逐渐降低, 但一直维持在较高水平, 且与对照组相比有显著性差异(P<0.05), 至72h恢复到正常水平。而Jak3磷酸化水平在辐照后0h和3h明显高于对照组(P<0.05), 12h后与对照组相比差异无显著性。

|
图 6 电磁辐照后大鼠海马Jak1磷酸化水平变化 |
实验发现电磁辐射能够明显诱导小胶质细胞活化, 并且在辐照后3h、24h出现活化高峰。小胶质细胞是中枢神经系统(CNS)内潜在的吞噬细胞, 当CNS出现各种病理变化如脑缺血或脑损伤后, 细胞内外离子失衡、神经递质紊乱、多种可溶性炎性细胞因子表达、氧自由基的生成均可导致小胶质细胞激活。小胶质细胞的激活被认为是CNS微环境变化最敏感的标志[6]。小胶质细胞的活化对中枢神经系统来说是一把双刃剑, 它既可以吞噬受损伤的神经元, 减轻脑内炎性反应的程度, 具有一定保护作用[7]; 然而异常活化的小胶质细胞又可释放多种细胞毒素和炎症介质, 分泌细胞因子, 从而加重炎性反应的程度, 并引起神经元凋亡、坏死[8]。课题组前期的实验发现, 电磁辐射后3h到24h海马神经元出现比较明显的细胞凋亡[3], 结合两者时相变化的一致性, 提示电磁辐射诱导海马神经元出现凋亡等病理损伤可能与小胶质细胞的活化导致的继发损伤有关。
JAK/STAT上游分子JAKs是胞浆内一类非受体酪氨酸激酶家族, 主要包括Jak1, Jak2, Jak3, Tyk2四个成员。最近的许多研究表明, JAK/STAT信号传导通路在中枢神经系统中也发挥着许多重要作用, 一些研究者在脑内的神经元和胶质细胞中检测到Jak1、Jak2、Jak3不同程度的表达[9]。并且在中枢神经损伤过程中, 如脑缺血、脑外伤以及脑内炎性反应等情况下, JAKs家族蛋白质及其下游分子STATs蛋白质表达以及磷酸化水平都出现明显变化, 特别是在活化的胶质细胞里某些JAKs和STATs有高表达, 且这种高表达与胶质细胞活化的程度表现为明显正相关[10]。更多实验证实, JAK/STAT信号通路参与调节了脑内小胶质细胞的活化过程和小胶质细胞活化后的功能。如神经节苷脂可激活脑内Jak1、Jak2, 进而激活Stat1、Stat3而使小胶质细胞活化[11]; 而IL-3可激活脑内Jak2、Stat5进而诱导小胶质细胞活化[12]。
本研究发现电磁辐射后海马脑区Jak家族成员出现差别激活, 结果表明Jak1、Jak2、Jak3在电磁辐射诱导的小胶质细胞活化中可能具有不同的作用。Jak1在辐照后即刻开始活化, 于12h达峰值, 并持续到24 h, 而Jak2在辐照后即刻即出现显著活化, 且一直维持在较高水平, 说明两者在诱导小胶质细胞活化过程中所发挥的作用并不完全一致, Jak2可能主要参与诱导了急性期的反应, 而Jak1可能主要与小胶质细胞的继发性激活关系密切。而Jak3的变化趋势与Jak1、Jak2均不一样, 只在0h、3h有显著变化, 这与小胶质细胞活化时相点不完全一致。Jak3在成年鼠脑内表达量极少, 但在机体受到电离辐射等一些刺激后, 表达量会很快增高[13], 这与本次实验的结果基本相符, 其升高后所发挥的具体功能不明, 但并不排除Jak3也可能参加了急性期小胶质细胞的活化过程, 这有待以后的实验进一步验证。
| [1] |
JOHN A, ANDREA D, CHOU C K, Sheila A Johnston, et al. Microwave effects on nervous system[J]. Bioelectromagnetics Supplement, 2003, 6: S107-S147. |
| [2] |
ZAGHLOUL Ahmed, ANDRZEI Wieraszko. Modulation of learning and hippocampal, neuronal plasticity by repetitive transcranial magnetic stimulation (rTMS)[J]. Bioelectro magnetics, 2006, 27: 288-294. DOI:10.1002/(ISSN)1521-186X |
| [3] |
杨学森, 龚茜芬, 张广斌, 等. 电磁辐射对大鼠学习记忆和海马神经元的影响[J]. 解剖学研究, 2004, 26(2): 124-126. DOI:10.3969/j.issn.1671-0770.2004.02.014 |
| [4] |
JASON S Ravings, KRISTIN M, ROSTER, et al. The JAK/STAT signaling pathway[J]. Journal of cell science, 2004, 117: 1 281-1 283. DOI:10.1242/jcs.00963 |
| [5] |
杨学森, 余争平, 张广斌, 等. 电磁辐射致小鼠海马神经细胞基因表达谱差异[J]. 中国公共卫生, 2005, 2: 35-36. |
| [6] |
KREUTZBER G G W. Microglia:a sensor for pathological events in the CNS[J]. TrendsNeurosci, 1996, 19: 312-318. |
| [7] |
STOLZING A, WENGNER A, GRUNE T. Degradation of oxidized extracellular proteins by microglia[J]. Arch Biochem Biophys, 2002, 400(2): 171-179. |
| [8] |
MIN K J, JOU I, JOE E. Plasminogen-induced IL-l beat and TNF-alpha production in microglia is regulated by reactive oxygen species[J]. Biochem Biophys Res Commun, 2003, 312(4): 969-974. DOI:10.1016/j.bbrc.2003.11.010 |
| [9] |
CLAU DIO De-Fraja, LUCIANO Conti, LORENZO Magrassi, et al. Members of the JAK/STAT Proteins Are Expressed and Regulated During Development in the Mammalian Forebrain[J]. Jour nal of Neuro science Research, 1998, 54: 320-330. |
| [10] |
IRAWAN Satriotomo, KELLIE K Bowen. RAGHU Vemu gant, JAK2 and STAT3 activation contributes to neuronal damage following transient focal cerebral ischemia[J]. Journal of Neuro chemistry, 2006, 98: 1 353-1 368. |
| [11] |
OHN Soon Kim, EUN Jung, Park EUN-hyeJoe, et al. JAK-STAT Signaling Mediates Gangliosides-induced Inflammatory Responses in Brain Microglial Cells[J]. The Journal of Biological Chemistry, 2002, 277(43): 40 594-40 601. |
| [12] |
BRIGHT John J, CHANDRAMOHAN Natarajan, SUBRAMANLAM Sriram, et al. Signaling Through JAK2-STAT5 Path way Is Essential for IL-3-Induced Activation of Microglia[J]. GLIA, 2004, 45: 188-196. DOI:10.1002/(ISSN)1098-1136 |
| [13] |
ASHRAF S MAHMOUD, SHELLEY Atkinson, et al. Early Gene Expression Profile in Mouse Brain after Exposure to Ionizing Radiation[J]. Radiation Res, 2006, 165: 142-154. |



 ,
, 