心肌显像能直接判断在急性心肌梗死等病理情况下, 心肌损伤的部位、面积与程度。而抗人心肌肌球蛋白重链(human cardiac myosin heavy chain, HCMHC)抗体被认为是最有前途的放射免疫显像剂之一[1, 2]。在正常情况下肌球蛋白存在于心肌细胞质内。当心肌细胞坏死时, 细胞膜受损, 肌球蛋白重链暴露, 并能较长时间停留在坏死细胞内。用放射性核素标记的抗HCMHC抗体能特异地与HCMHC结合, 浓集于坏死心肌细胞处而显像, 并据此作出诊断。它的优点是显像时间长、特异性好和能早期诊断。抗HCMHC抗体能探测膜完整性的早期破坏, 能特异地区分死亡和存活的心肌细胞, 并可测定细胞活力大小。为了进一步改进抗HCMHC抗体的显像效果, 需要研制抗HCMHC单链可变区抗体[3, 4]。为此, 作为基础, 我们首先进行HCM和HCMHC的研制、特性鉴定和制备抗HCMHC的杂交瘤细胞株。
1 材料与方法 1.1 材料 1.1.1 主要试剂5-腺苷三磷酸二钠盐(ATPNa2·2H2O), 华美生物工程公司; DEAE-Sephadex A-50凝胶, 高、低分子量标准蛋白HMW-SDS, Phast Gel Gradient 8-25和Phast Gel SDS Buffer Strips, 瑞典pharmacia公司; 盐酸胍, 美国Promega公司; 十二烷基硫酸钠(SDS), 上海化学试剂采购站; 不完全福氏佐剂和完全福氏佐剂, 美国GIBCO公司; DMEM培养基, HAT选择培养基, 美国Life technologies公司。
1.1.2 主要仪器1/100000精密电子天平, 德国Sartorius公司; 低温高速离心机(SCR20BA型), 日本Hitachi公司; 超速低温离心机(L7-80型和J2-MC型), 美国Beckman公司; UV-3000紫外分光光谱仪, 日本岛津公司; Phast System水平电泳系统, 瑞典Pharmacia公司; 垂直板电泳系统和DOC1000图像分析系统, 美国Bio-Rad公司。
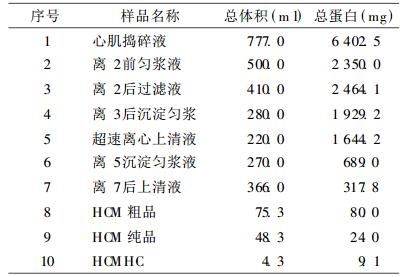
1.2 方法 1.2.1 HCM的提取和纯化取健康人意外死亡者心肌(经死者家属同意)127g, 经过捣碎、先后三次匀浆、七次低温高速离心(其中一次超速离心, 且每步离心后都留样, 共留7个样品)、冰浴、多次不同离子浓度缓冲液溶解、二次饱和硫酸胺盐析等步骤, 得到HCM粗品。用DEAE-Sephadex A-50凝胶柱层析, 纯化HCM粗品。每次上样体积41ml, 含约1%粗品, 上样速度为10ml/h, 约为洗脱速度的一半。上样后, 停30min, 以便吸附。然后用线性盐梯度(0.05mol/L~1.0mol/LKCl)洗脱液洗脱, 洗脱速度4ml·12min-1管-1。测定收集的各管样品在280nm处光密度(OD280nm)值, 绘制柱层析图谱, 据此收集蛋白峰。把收集的各蛋白峰溶液透析40h, 除盐。最后, 用PEG-20000进行浓缩。
1.2.2 HCM及HCMHC的特性鉴定 1.2.2.1 蛋白浓度测定用考马斯亮蓝法测定蛋白浓度。在试管(均为双管)中分别加入0、10、20、30、40、50、60μl标准蛋白溶液, 用双蒸水补足到60μl。每管加3ml考马斯亮蓝染色溶液, 混匀, 室温下保温15min测定OD595nm, 作标准曲线。同法配制各待测样品并测定OD595nm值。从标准曲线上求出待测值, 此法测定蛋白质量浓度范围为0.01~1.0g/L。
1.2.2.2 SDS-PAGE(梯度)凝胶电泳测定相对分子质量[5, 6]在一瓶标准蛋白中加入100μl标准蛋白溶解液溶解, 即标准蛋白工作液, 4℃保存。在20μl待测样品中加入20μl样品溶解液和60%蔗糖溶液10μl。但终浓度应在20~30ng·每种蛋白-1·μl-1。将不同浓度的标准蛋白工作液10μl、加入了溶解液的样品分别混匀, 100℃加热5min。在PhastGel梯度8~25%凝胶片上样1μl。电泳条件参照说明书并改进。染色和脱色各2h, 其间更换脱色液4次。加保护液保存。
1.2.2.3 HCM的ATPase活力测定先制作无机磷校正曲线, 每个待测样品均为平行双管。每管中加反应液100μl, 加入待测样品(先稀释至约1g/L蛋白)80μl, 再加入5mmol/LATP溶液20μl, 37℃水浴保温15min, 然后向每管加入50μl15%三氯醋酸, 冰浴10min, 再向每管加入0.75ml双蒸水, 将全部试管在1000rpm离心10min, 小心吸取上清液, 用于待测磷。对各管的上清液分别加入下列各种试剂:0.5ml15%三氯醋酸、0.4ml酸性钼酸钠溶液(0.1mol/L钼酸钠和24%硫酸)工作液, 摇匀后15s, 再加入0.3ml0.0185%孔雀绿溶液, 反应2min后, 加入2ml7.8%硫酸, 室温放置1h, 用同上方法测定OD625nm值。从校正曲线上查出对应的磷值, 算出酶活力。
1.2.2.4 HCM游离巯基的测定把半胱氨酸系列标准溶液50μl分别加入不同的试管中, 每管分别加入50μl Ellmans溶液和900μl 0.1mol/L磷酸盐缓冲液, 混匀, 室温放置15min, 测定OD412nm, 制作标准曲线。取各样品50μl(蛋白质浓度约1g/L), 分别加入试管。每管再加入冰乙酸13μl、Ellmans溶液50μl和0.1mol/L磷酸盐缓冲液900μl。室温放置15min, 测定OD412nm。
1.2.3 HCM重链的制备[7]纯化后的HCM经PEG-20000浓缩至8ml, 边搅拌边缓慢加入固体盐酸胍至浓度为5mol/L, 再加入巯基乙醇至质量浓度为0.01mol/L。在冷柜内冰浴下静置3h。加入等体积冰预冷的双蒸水, 再缓慢滴加4倍体积冰乙醇, 沉淀, 冰浴20min, 10000rpm离心20min, 收集沉淀, 用0.6mol/L KCl溶液充分溶解, 然后加二巯基苏糖醇(DTT)和苯甲基磺酰氟(PMSF)使终质量浓度分别为1mmol/L和0.1mmol/L。加50%甘油, 分装, -20℃保存, 此为HCMHC; 同时, 离心后的上清透析除盐, 用PEG-20000浓缩, 制备HCMLC, 此HCMLC可用于制备抗HCMLC抗体[8]。
1.2.4 抗HCM HC杂交瘤细胞的制备采用经典杂交瘤技术原理, 用HCMHC抗原免疫BALB/C小鼠, 取出脾细胞与体外培养SD2/O的骨髓瘤细胞相融合。通过克隆化使阳性杂交瘤细胞成为纯一的单克隆系, 进而获得单克隆抗体。
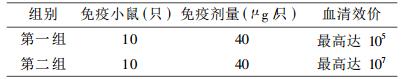
1.2.4.1 HCMHC免疫小鼠和EL ISA检测其血清抗体效价水平选择6~8周龄的纯系BALB/C小鼠(雌雄不限)20只, 随机平分为两组。用HCMHC作为免疫原。免疫前用0.025mol/L Tris-HCl缓冲液, pH7.6(含0.03mol/L KCl, 0.01mol/L巯基乙醇), 透析HCMHC 24h, 除去盐和甘油。初次免疫每只小鼠腹腔注射40μg HCMHC抗原量, 注射体积为500μl。3~4周后第一次加强免疫, 2周后进行第二次加强免疫, 均为20μg/只HCMHC, 融合前3d进行冲击免疫, 40μg/只HCMHC。用ELISA(Enzyme-Linked Immunosorbent Assay, 酶联免疫吸附试验)检测血清抗体效价。
1.2.4.2 细胞融合制备饲养细胞、脾细胞和SP2/0骨髓瘤细胞。将1×108脾细胞与2×107~3×107骨髓瘤细胞在离心管中混匀, 1000rpm离心5min, 弃上清, 在37℃水浴中, 均匀转动离心管, 并轻轻加入0.7ml 50% PEG-4000, 进行细胞融合。静置30s后, 缓慢加入无血清培养液, 终止融合。离心弃上清, 弹散细胞并重悬于HAT(hypoxanthine次黄嘌呤、aminopterin氨基喋呤、thymidine胸腺嘧啶核苷)培养液中, 混匀, 接种于铺有饲养细胞的96孔板中, 37℃、5% CO2及饱和湿度下孵箱培养观察。
1.2.4.3 杂交瘤细胞的选择性培养及筛选用HAT培养液培养3~5d后, 融合的杂交瘤细胞成簇生长, 成为小的细胞集落, 此时非杂交瘤细胞几乎全部死亡。7~10d后改用次黄嘌呤及胸腺嘧啶核苷(HT)培养液培养。14d后改用普通培养液培养, 此时杂交细胞可布满培养孔底部约1/2或1/3。即可用ELISA方法对培养液作特异性抗体检测, 确定抗体阳性孔并对抗体阳性高滴度细胞立刻进行单个细胞培养。
1.2.5 单克隆抗体制备及HCMHC免疫学活性检测应用有限稀释法对杂交瘤细胞进行克隆化。把克隆化后仍分泌高滴度抗体的杂交瘤细胞用体外法进行大量繁殖。在液氮内冻存。用ELISA方法对HCMHC进行免疫学活性检测。对抗HCMHC杂交瘤细胞, 经复苏、培养和传至培养瓶中扩大培养, 再经4~5d后, 取培养液待用。用样品缓冲液把HCMHC稀释成不同浓度(40mg/L, 20mg/L, 10mg/L), 以0.1ml/孔的量分别包被在96孔板上, 4℃下过夜。弃去孔内液体并用洗涤液(KH2PO4 0.2g, Na2HPO4 2.9g, NaCl 8g, TWeen-20 0.5ml, 定容至1000ml, 调pH至7.4)洗板3次, 然后按ELISA法对培养液进行检测。
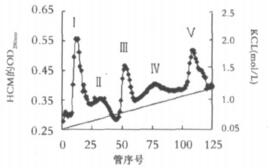
2 结果 2.1 HCM和HCMHC的研制从127g人心肌组织中提取了约24mg HCM纯品, 制备了9.1mg HCMHC。图 1为纯化HCM的柱层析图谱, 图中蛋白峰清晰, 第Ⅰ和Ⅱ峰为杂蛋白峰, Ⅲ峰为HCM, 而Ⅴ峰可能为聚合蛋白峰。
|
图 1 HCM的DEAE-Sephadex A-50柱层析图 |
用考马斯亮蓝法测得了提取过程中各步留样、HCM和HCMHC等的蛋白浓度并计算了总蛋白量。从表 1中可见, 随着提取过程的进行, 在杂蛋白逐渐去除的同时也伴随着HCM的损失, 总蛋白量逐渐减少。
|
|
表 1 HCM提取过程各步骤留样的蛋白测定结果 |
用SDS—PAGE(梯度)凝胶电泳测定了各留样蛋白的浓度, 结果见图 2。图中可见:蛋白质高分子质量和低分子质量标准的各蛋白位置合理、清晰, 说明本电泳方法可靠; 1、2、3、5、6和8号样品, 正是从提取开始到结束顺序的留样, 可见随提取过程的进行, 各样品的杂蛋白成分越来越少, 而目标蛋白HCMHC带越来越明显, 所占含量比越来越大, 说明提取方法合理可行; HCMHC分子质量为200×103, HCMLC分为两条, LC1和LC2分子质量分别为24×103和20×103, 结果正确; 这里要强调指出, HCM整分子质量为470×103, 但在SDS—PAGE(梯度)凝胶电泳中, 在SDS作用下, 本身分解为HCMHC和HCMLC, 所以本电泳图中的HCMHC就反映了HCM, 所以在1、2、3、5、6和8号样品中的电泳图中都有HCMHC和HCMLC蛋白带出现; 样品8中只有HCMHC蛋白带, 但伴有少量HCMLC, 可能与分离HCMLC不完全有关。用电泳图像分析系统对电泳图进行了分析, 结果显示, 从最初捣碎液到最后的第7次离心的上清液, HCMHC由16.48%增至63.42%, 而HCMHC样品中的HCMHC纯度大于80%。

|
图 2 提取过程留样电泳图 |
实验测得无机磷的校正曲线, 其直线回归方程为y=-0.7156+34.4871x, r=0.9956。据此测定了HCM提纯过程全部留样的ATP酶活力, 结果显示随提取过程的进行, ATP酶的比活力总体上是逐渐增加的, 并随HCM纯度增加而增加, 而总活力随提纯步骤逐渐降低, 这与HCM也在逐步减少是一致的。
2.2.4 HCM游离巯基的测定HCM游离巯基测定结果为105g HCM有4个游离巯基, 表明所提纯的HCM分子的二硫键未破坏, 基本保持了完整性。
2.3 HCMHC杂交瘤细胞的制备 2.3.1 用ELISA方法测定免疫小鼠血清中抗HCMHC抗体的效价实验结果见表 2。由表可见, 第二组免疫小鼠血清中抗HCMHC抗体效价最高, 为107, 一月后重测此组血清效价, 无明显区别, 这说明所提纯的HCMHC具有较好的免疫原性。
|
|
表 2 ELISA法测定抗体效价结果 |
参考经典的细胞融合技术, 把体外培养的SP2/0骨髓瘤细胞与免疫小鼠的脾细胞进行融合, 经过多次实验, 融合率达80%左右。
2.3.3 用ELISA法检测HCMHC免疫学活性表 3的实验结果表明:所制备的HCMHC样品的OD值已达到或超过阳性对照(+)的OD值, 远高于阴性对照(-)和空白对照的OD值, 差异均非常显著; 三种不同包被浓度样品的OD值无明显差异, 包被浓度可控制在5~10mg/L, 最大不宜超过10mg/L; 从表 3测定结果与相应的电泳图谱综合分析证实所研制的HCMHC可满足实验要求, 并具有良好的免疫学活性; 实验结果还表明, 样品中加入50%甘油保护, 对包被及测定结果无明显影响, 使用时可不必透析。
|
|
表 3 ELISA法检测HCMHC免疫学活性的结果(OD280nm) |
人死后随着时间的推移, 心肌细胞中的肌球蛋白分子会不断与肌动蛋白结合成肌动球蛋白。在肌球蛋白的提取过程中, 虽然理论上肌动球蛋白分子可以被加入的ATP和Mg2+逆转成肌动蛋白和肌球蛋白, 但是在实际中有相当大的比例不能逆转。所以, 最好是人死后短时间内取材, 并-18℃下保存。提取的全过程必须保持在4℃环境下, 否则, 肌球蛋白的聚合作用极其显著。肌球蛋白分子随温度升高, 分子间聚合率会明显增加, 而且聚合一旦形成, 极少有被逆转的可能。在提取中我们用缓冲液匀浆、补加KCl等方法, 增加蛋白溶解度, 防止聚合。在HCM纯化中, 我们选择了磷酸钾缓冲液系统加KCl的线性梯度(0.05~1mol/L)洗脱液, 这样不仅能充分溶解肌球蛋白, 而且能有效地防止肌球蛋白的聚合。
在肌球蛋白提取的全过程中, 肌球蛋白ATP酶经历进行性的变性, 并且有可能水解生成两个片段。为防止或减少这种影响, 我们在提取过程中的大多数溶液中加入PMSF、DTT和EDTA。其中, PMSF是丝氨酸蛋白酶抑制剂, 能有效阻止肌球蛋白的水解作用。DTT是还原蛋白质二硫键的试剂, 在反应中DTT形成一个含分子内二硫键的稳定六元环, 用作巯基保护剂。EDTA作为络合剂和金属掩蔽剂, 与金属离子结合, 保护肌球蛋白的活性。
3.2 特性鉴定近年来, 有应用MADI-TOF质谱仪进行HCMHC的鉴定, 这是一种相对和绝对定量蛋白异构体的特殊方法[8]。本实验在对HCM和HCMHC鉴定中, 首先进行SDS-PAGE不连续电泳, 但由于HCM及其亚基分子质量较大, 分离效果不好。考虑到PAGE(梯度)凝胶电泳具有浓缩作用, 可以直接测定天然状态蛋白质的分子质量。于是改用垂直板SDS-PAGE(梯度)凝胶电泳, 但因需时较长, 温度升高, 导致凝胶变性等原因, 未获理想效果。又经过反复筛选认为水平电泳的凝胶可在冷却板上得到充分的冷却, 又可在凝胶上加高压, 使电泳时间大大缩短和分辨率明显提高。因此选用了Pharmacia公司的Phast System自动水平电泳系统。先进行了PAGE(梯度)为8~25%的电泳, 未获得理想结果, 可能是由于HCM分子质量较大的原因。据此又进行了SDS-PAGE(梯度)凝胶(8~25%)电泳, 一方面利用梯度凝胶的分子筛作用, 另一方面利用SDS将大分子HCM解离成重链和轻链亚基测定其分子质量, 最终获得较为理想的结果, 如图3所示。表明我们改进的电泳方法是非常有效的。
3.3 HCMHC的制备在HCMHC的制备中, 由于盐酸胍的作用, 使HCM次级键被破坏, 引起其天然构象解体, 但不涉及HCM共价键(肽键和二硫键等)的破裂, 其一级结构HCMHC、HCMLC保持完好。盐酸胍变性剂存在时, 变性的HCM保持溶解状态。为防止在溶液中加入乙醇时产生放热反应引起蛋白质变性, 我们把乙醇进行了充分预冷, 而且整个操作在4℃冰柜中进行。加入乙醇是为了使重链沉淀, 再经离心将其分离出来。
3.4 HCMHC杂交瘤细胞的制备为了使产生的杂交瘤细胞稳定, 使用的SP2/0骨髓瘤细胞来自与被免疫动物同一个品系的BALB/C小鼠品系。一般认为, 在最后一次加强免疫后第三日取脾进行融合为好。我们选用PEG作为融合剂。处于50%PEG浓度的的高渗环境中, 细胞呈现交融和皱缩的状态, 所以在用预温的无血清培养液稀释时, 开始要缓慢, 边加边轻轻地震荡, 使细胞的渗透压与外环境逐步平衡, 否则会由于突然处于低渗状态中, 大量水分涌入细胞膜中而使细胞崩解。在融合过程中, 必须选择合适的PEG分子质量、温度以及作用时间, 以免影响融合效果。
4 结论本实验取得了良好的结果, 为下一步抗HCMHC单链可变区抗体及其放射性核素受体显像的研究打下了基础。
| [1] |
Laroche-Traineau J, Clofent-Sanchez G, Santarelli X, et al. Three-step purification of becterially expressed human single-chain Fv antibodies for clinical applications[J]. J Chromatogr B Biomed Sci Appl, 2000, 737(1-2): 107-117. DOI:10.1016/S0378-4347(99)00441-7 |
| [2] |
Neddlman MA, David JS, Baymond B, et al. Rapid infarct imaging with a technetium-99m-labeled antimyosin recombinant single-chain Fv: evaluation in a canine model of acute myocardial infarction[J]. J Nucl Med, 1993, 34(2): 234-241. |
| [3] |
Morner S, Richard P, Kazzam E, et al. Identification of the genotypes causing hypertrophie cardiomyopathy in northern Sweden[J]. J Mol Cell Cardiol, 2003, 35(7): 841-849. DOI:10.1016/S0022-2828(03)00146-9 |
| [4] |
惠海鹏, 李小鹰, 刘秀华, 等. 腺相关病毒介导心肌肌浆网Ca2+-ATPase 2a基因转导治疗大鼠慢性心力衰竭[J]. 中华心血管病杂志, 2006, 34(4): 357-362. DOI:10.3760/j:issn:0253-3758.2006.04.021 |
| [5] |
Warren CM, Greaser ML. Method for cardiac myosin heavy chain separation by sodium dodecyl sulfate gel electrophoresis[J]. Anal Biochem, 2003, 320(1): 149-151. |
| [6] |
Piac S, Yu F, Mihm MJ, et al. A simplified method for identification of human cardiac myosin heavy chain isoforms[J]. Biotechnol Appl Biochem, 2003, 37(1): 27-30. DOI:10.1042/BA20020076 |
| [7] |
黄人健, 彭宝珍, 周国瑛, 等. 人心肌肌球蛋白轻链1与重链和肌动蛋白的结合[J]. 生物化学与生物物理学报, 2000, 33(1): 41-45. |
| [8] |
Steve MH, Chia-Y, Krzysztof JC, et al. Simultaneous quantification of human cardiac α-and β-myosin heavy chain proteins by MALDI-TOF mass spectrometry[J]. Anal Chem, 2004, 76(6): 1683-1689. DOI:10.1021/ac035144l |