2. 江苏省肿瘤医院;
3. 第三军医大学
近年来, 电离辐射的旁效应受到人们的普遍关注[1]。医疗照射是辐射防护的重点、难点。肿瘤放射治疗等局部照射条件下, 射线除了对照射部位肿瘤组织产生直接杀伤作用, 同时还导致机体处于应激状态, 使体内出现氧自由基升高、细胞因子网络激活等改变, 导致非照射区域组织、细胞功能损害。为进一步探讨局部电离辐射对非照射区骨髓造血细胞DNA损伤, 我们建立了小鼠左半身照射模型, 应用单细胞凝胶电泳(SCGE)和嗜多染红细胞微核形成率(fMPCE)等检测DNA损伤的方法, 观察局部照射对小鼠非照射区骨髓造血细胞的影响。
1 材料与方法 1.1 实验动物6~8周龄SPF级雄性昆明小鼠180只, 体质量(20±2)g, 由第三军医大学实验动物中心提供, 动物(饲料)许可证号SCXK-(军)2002007, 动物实验设施许可证号SCXK-(军)2002-032。小鼠在昼夜交替、室温20~23℃的环境中饲养, 自由饮水、进食。
1.2 实验分组、照射、给药处理小鼠适应环境3d后, 随机分4组:正常对照组(normal control, NC):不作其他处理; 全身照射组(total-body irradiation, TBI):小鼠固定于照射架内; 左半身照射组(left-half-body irradiation, LHBI, 左侧, LHBI-L, 右侧, LHBI-R):动物3%戊巴比妥钠溶液腹腔麻醉后固定体位, 用5cm×8cm×16cm两块铅砖重叠屏蔽右半身; 全身屏蔽照射组(total-body-shield irradiation, TBSI):动物麻醉固定, 用5cm×8cm×16cm两块铅砖重叠屏蔽全身。
照射:用第三军医大学辐照中心60Co γ射线一次性照射, 源距100cm, 剂量率68.46cGy/min, 吸收剂量8.0Gy, 室温下进行。
观察小鼠的活动、进食情况、体重变化、动物存活率等。
1.3 检测方法 1.3.1 小鼠外周血白细胞计数尾静脉采血, 用白细胞稀释液稀释, 在血球分析仪(MEDONIC CA570)上计数。
1.3.2 血浆MDA、SOD含量测定经小鼠眼球静脉丛取血后立即将标本在4℃, 1500r/min下离心5min, 吸取上层血清, -20℃保存。SOD采用黄嘌呤氧化酶法, MDA采用硫代巴比妥法, 药盒均由南京建成生物工程研究所提供。
1.3.3 血浆TNF-α含量测定采用ELISA法测定。按TNF-α测定试剂盒(晶美生物工程有限公司)试剂说明书进行。
1.3.4 彗星试验(comet assay, CA)[2]照射后24、48h颈椎脱臼处死小鼠, 分离双侧股骨。用适量HBSS冲洗骨髓, 过5#针头得单细胞悬液。根据Singh方法略加改动:用60μl加热熔化后的1%正常熔点琼脂糖(不含Ca2+, Mg2+)在载玻片磨砂端铺片, 盖上盖玻片, 置4℃冰箱10min凝固; 移去盖玻片, 在37℃下, 将细胞悬液与1%低熔点琼脂糖按1:1混合, 共60μl作为第二层, 盖上盖玻片, 4℃冰箱放置10min, 移开盖玻片; 37℃下, 将60μl0.5%LMA作为第三层, 4℃冰箱放置10min, 移去盖玻片。将载玻片浸泡在4℃预冷的裂解液中(2.5mol/L NaCl, 100mmol/L Na2EDTA, 10mmol/L Tris缓冲液, 1%十二烷基肌氨酸钠, pH10, 用前加终浓度为1% Triton-100和10% DMSO), 1h后将载玻片从裂解液中移出。继续在盛有新鲜配制的预冷的解旋液(1mmol/L Na2EDTA, 300mmol/LNaOH)的电泳槽中放置20min, 使DNA解螺旋。水平浸入电泳槽内的电泳液(40mmol/LTris, 5mmol/L EDTA, 20mmol/L乙酸, pH8.3)中, 室温下电泳20min(电压1V/cm, 电流200mA)。电泳后用0.4mol/LTris(pH7.5)浸洗3次, 每次10min。用50μg/ml PI 20μl染色, 染色后在激发波长515~560nm, 阻断波长>590nm条件下, 用OLYMPUSIX70倒置荧光显微镜进行观察、照相。每组100个细胞, 计数拖尾细胞数, 以彗尾样细胞出现率作为评价NDA损伤的指标。
1.3.5 骨髓嗜多染红细胞微核试验[3]颈椎脱臼处死小鼠, 按常规方法制片:取小鼠股骨骨髓制片, 固定、Giemsa染色、镜检, 嗜多染红细胞呈灰蓝色, 成熟红细胞呈粉红色。典型的微核多为单个的、圆形、边缘光滑整齐, 嗜色性与核质一致, 呈紫红色或蓝紫色, 直径通常为红细胞的1/20~1/5。选择细胞分散、形态完整、染色良好、背景清晰的细胞在光镜下观察并统计细胞总数和微核细胞数。每只动物计数1000个嗜多染红细胞中微核细胞数, 油镜下双盲法观察, 微核率以千分率(‰)表示。
1.4 统计方法用SPSS10软件对实验数据进行统计处理。
2 结果 2.1 小鼠电离照射后的反应全身照射组小鼠在照射后12~24h内出现烦燥不安、食欲减退, 3~5d表现为呆滞无神或静卧不动, 拒绝进食, 毛发散乱、无光泽, 部分出现呕吐、腹泻, 体重明显减轻, 呼吸急促, 7~9d开始死亡; 半身照射组仅表现为精神欠佳, 食量有所减少, 无呕吐、腹泻症状, 无死亡; 全身屏蔽照射组与正常对照组小鼠精神、饮食状况表现差异不大。
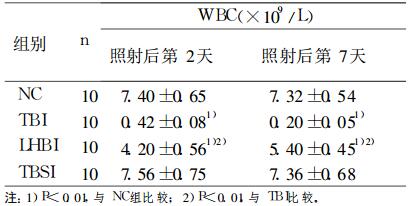
2.2 电离辐射后小鼠外周血白细胞的影响(表 1)|
|
表 1 照射后不同时间小鼠外周血白细胞数(×109/L) |
全身照射组小鼠在照射后2天外周血白细胞明显下降, 一直到照射后第7天无恢复迹象; 半身照射组小鼠在照射后2天外周血白细胞有一定程度下降, 照射后第7天开始恢复(与正常对照组相比P < 0.01);全身屏蔽照射组与正常对照组无明显差异(表 1)。
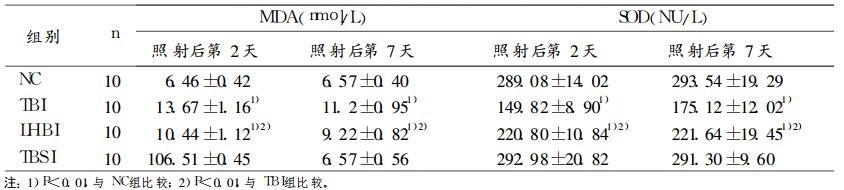
2.3 电离辐射后小鼠血清MDA和SOD变化(表 2)|
|
表 2 照射后不同时间小鼠血清MDA和SOD水平 |
照射后第2、7天检测血清MDA(见表 2), 半身照射组与全身照射组小鼠血清MDA均明显升高(与正常对照组相比P < 0.01);但低于全身照射组(P < 0.01)。全身屏蔽组与正常对照组差异无显著性。
照射后第2、7天检测血清SOD含量(见表 2), 半身照射组与全身照射组小鼠血清SOD均明显降低(与正常对照组相比P < 0.01);但高于全身照射组(P < 0.01)。全身屏蔽照射组与正常对照组差异无显著性。
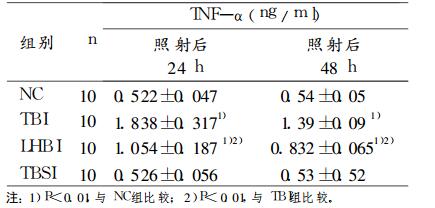
照射后24h、48h检测血清TNF-α(见表 3), 半身照射组与全身照射组小鼠血清TNF-α均明显升高(与正常对照组相比P < 0.01);但低于全身照射组(P < 0.01)。全身屏蔽照射组与正常对照组差异无显著性。
|
|
表 3 电离辐射后小鼠血清TNF-α的变化 |
|
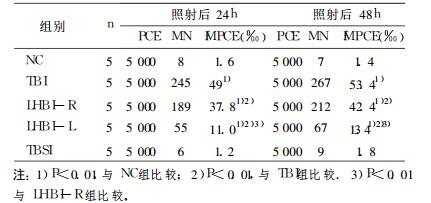
|
表 4 电离辐射后小鼠骨髓嗜多染红细胞微核率(fMPCE) |
在照射后24h、48h fMPCE检测显示(见表 4), 全身照射组小鼠骨髓fMPCE明显增高(与正常对照组相比P < 0.01);左半身照射组小鼠照射侧与非照射侧股骨骨髓fMPCE较全身照射组低(P < 0.01), 但都明显高于正常对照组(P < 0.01)。全身屏蔽照射组与正常对照组差异无显著性。
2.6 电离辐射后小鼠骨髓有核细胞慧星电泳(表 5)|
|
表 5 电离辐射后小鼠骨髓有核细胞慧星电泳 |
在照射后24、48h骨髓单细胞电泳显示(见表 5), 全身照射组小鼠骨髓彗星样细胞明显增高(与正常对照组相比P < 0.01);左半身照射组小鼠照射侧与非照射侧股骨骨髓彗星样细胞较全身照射组低(P < 0.01), 但都明显高于正常对照组(P < 0.01)。全身屏蔽照射组与正常对照组差异无显著性。
3 讨论“靶学说”是辐射生物学的经典学说[4]。该假说认为, 电离辐射对细胞产生的生物效应在于其对DNA等靶分子“直接”电离作用。然而, 近年来, 人们逐渐认识到“非靶性”作用的存在, 旁效应就是辐射生物效应中的一种。辐射旁效应是指通过细胞接触或细胞间通讯, 将直接受辐射细胞的应答传递给周围未受辐射的细胞, 后者也表现出与辐射细胞类似的生物学效应, 包括细胞凋亡或延迟死亡、基因不稳定性、基因突变以及细胞生长异常等[5]。其发生与辐射细胞分泌的细胞因子或各种氧化因子通过培养液或是缝隙连接等方式影响了临近非照射细胞有关[6]。
本研究应用彗星电泳和嗜多染红细胞微核形成率方法来检测骨髓细胞DNA损伤。单细胞凝胶电泳(single cell gel electrophoresis, 简称SCGE)技术[2], 又称彗星试验(comet assay)。其基本原理是DNA超螺旋经高盐及去污剂裂解后, 在碱性(pH>12.3)环境中解旋、电泳, 断裂的DNA碎片被释放并向阳极泳动, 染色后荧光显微镜观察呈“彗星”状。它是一种测定单个细胞DNA链断裂的电泳技术, 具有快速、灵敏、所须样品量少、无需放射性标记等特点, 被广泛地应用于各种有核细胞经受试物诱导的DNA损伤和修复的研究。微核是在细胞的有丝分裂后期染色体有规律地进入子细胞形成细胞核时, 仍然留在细胞质中的染色单体或染色体的无着丝粒断片或环。一般认为, 微核的产生和染色体损伤有关。本实验观察嗜多染红细胞的微核, 其直径通常为红细胞的1/20~1/5[3]。
本研究结果表明, 在左半身照射后, 小鼠右侧(未照射侧)股骨骨髓细胞彗星电泳后出现彗星样细胞[24h为(22.33±3.33)%, 48h为(25.33±3.33)%], 检查发现嗜多染红细胞微核形成(24h为11.0‰, 48h为13.4‰), 其发生率均远高于正常对照组(P < 0.01)。表明未照射侧股骨骨髓细胞DNA损害是存在的。全身照射小鼠一般状况极差, 出现神经系统、消化系统症状; 血象上表现外周白细胞早期显著下降, 第7天时无恢复迹象(WBC 0.20×109/L); 血清MDA、TNF-α升高, SOD下降; 骨髓细胞彗星电泳以及fMPCE均显著增高, 符合急性骨髓型放射病损害表现[7]。全身屏蔽照射组小鼠外周血白细胞、血清TNF-α、MDA、SOD与正常对照组无显著差异(P>0.05), 表明所采用的屏蔽措施是有效的、可行的。动物模型制作是成功的, 可以排除半身照射小鼠未照射侧骨髓细胞DNA损害因屏蔽措施不当导致的结果偏差。
机体内的自由基由正常代谢、机体应激等状态产生, 可导致细胞DNA和其他生物大分子的损伤, 产生单链(SSB)断裂或双链断裂(DSB)。目前已经证实了电离辐射可导致机体产生大量的自由基, 造成造血细胞等的损害。我们的研究结果表明, 除了全身照射, 局部照射也可引起机体产生大量自由基, 表现为血清内MDA升高、SOD含量降低。这与临床肿瘤放射治疗情况相符:肿瘤放射治疗被认为是局部治疗, 所采用的照射野都相对有限, 但部分病人全身反应却很严重, 原因在于电离辐射对机体内环境稳态的干扰。自由基激活参与了辐射损伤的发生、发展过程, 局部电离辐射对机体的作用与辐射的旁效应密切相关[8]。
TNF-α主要由单核细胞和巨噬细胞产生, 其具有广泛的生物学活性, 一方面参与机体的免疫防御机能, 另一方面介导休克、炎症反应、组织损伤等病理生理反应。作用包括:①介导脂类和其他多肽介质的产生。②诱导自由基的产生及脂质过氧化。③活化中性粒细胞。而这些炎症介质、自由基及活化中性粒细胞均可作用于内皮细胞, 增加毛细血管通透性, 并导致局部缺血和血栓形成; 通过激活炎性细胞, 上调粘附分子和氧自由基等损害组织, 导致造血微环境、造血组织的损伤, 参与SIRS、MODS等病理过程[9]。电离辐射可能作为应激源, 刺激机体细胞因子网络激活, 导致造血组织等损伤。我们的研究表明, 除全身照射外, 半身照射也可引起血清中TNF-α水平的增高, 可能与未照射部位损害表现相关。
因此我们推测, 局部照射后, 一方面, 电离辐射可引起受照局部组织产生直接损害, 同时形成大量自由基, 激活细胞因子网络, 通过血液循环, 导致未受照部位组织细胞的继发损伤; 另一方面, 在一定程度上影响造血干/祖细胞的动员、再分布、定植、存活等环节, 抑制骨髓造血细胞功能。电离辐射的旁效应, 为辐射防护提出了新的研究思路和方向[10]。
| [1] |
Lorimore SA, Coates PJ, Wright EG. Radiation-induced genomic instability and bystander effects: inter-related nontargeted effects of exposure to ionizing radiation[J]. Oncogene, 2003, 22(45): 7058-69. DOI:10.1038/sj.onc.1207044 |
| [2] |
Singh NP, Stephens RE. Micro gel eletrophoresis: Sensitivity, mechanisms, and DNA electrostretching[J]. Mutat Res, 1997, 383: 167-175. DOI:10.1016/S0921-8777(96)00056-0 |
| [3] |
GB15193.5-94骨髓微核试验[S]
|
| [4] |
夏寿萱主编.放射生物学[M].军事医学科学出版社. 1998, 46-64
|
| [5] |
Waldren CA. Classical radiation biology dogma, bystander effects and paradigm shifts[J]. Hum Exp Toxicol, 2004, 23(2): 95-100. DOI:10.1191/0960327104ht425oa |
| [6] |
Chen J, Lipovsky K, Ellison FM, et al. Bystander destruction of hematopoietic progenitor and stem cells in a mouse model of infusion-induced bone marrow failure[J]. Blood, 2004, 104(6): 1671-1678. DOI:10.1182/blood-2004-03-1115 |
| [7] |
程天民主编.军事预防医学概论[M].北京: 人民军医出版社, 1999, 41-66
|
| [8] |
Spitz DR, Azzam EI, Li JJ, Gius D. Metabolic oxidation/reduction reactions and cellular responses to ionizing radiation:a unifying concept in stress response biology[J]. Cancer Metastasis Rev, 2004, 23(4): 311-322. |
| [9] |
陈兵, 王洪霞, 刘健, 等. 危重病患者SIRS早期细胞因子水平动态变化的研究[J]. 中国急救医学, 2001, 21(12): 707. DOI:10.3969/j.issn.1002-1949.2001.12.012 |
| [10] |
Azzam EI, de Toledo SM, Little JB. Stress signaling from irradiated to non-irradiated cells[J]. Curr Cancer Drug Targets, 2004, 4(1): 53-64. DOI:10.2174/1568009043481641 |