2. 复旦大学放射医学研究所
目前, 临床核医学、放射诊断、放射治疗中涉及肾脏照射的情况很多, 而肾脏是对电离辐射比较敏感的器官, 因此在实际工作中应加强对肾脏的防护。动物研究[1]表明, γ射线可导致肾脏进行性病理损害和功能障碍, 肾小管上皮细胞在此病理改变过程中起着至关重要的作用。本研究采取原代培养肾小管上皮细胞方法, 以不同剂量γ射线直接照射培养细胞来进一步研究γ射线对肾小管上皮细胞损伤的特点, 为肾脏的辐射防护提供实验基础和理论依据。
1 材料与方法 1.1 原代肾小管上皮细胞培养、鉴定和生长曲线绘制肾小管节段的分离:Sprague-Dawley大鼠体重(100±13) g, 复旦大学放射医学研究所实验动物部供应, 合格证:SCXK 2003-0004。实验前12 h禁食, 自由进水。将大鼠放入75%酒精浸泡15 min, 处死, 无菌取肾, 去肾包膜, 将肾脏纵切开, 剪刀剔除肾髓质, 肾皮质置37 ℃生理盐水培养皿中, 剪成约1 mm3小块, PBS冲洗3遍, 置80目筛网上轻轻研磨, 100目筛网过滤, 收集网上物, 1 000 rpm离心10 min。取离心沉淀, 加0.25%胰酶2 ml, 37 ℃水浴消化20 min, 1 500 rpm离心10 min, 沉淀用RPMI1640培养液(含10%FCS, 并添加胰岛素5 μg/ml, 转铁蛋白5 μg/ml, 亚硒酸钠5 ng/ml, 氢化可的松36 ng/ml, 三碘甲腺原氨酸4 pg/ml, 表皮生长因子10 ng/ml, 青霉素1 000 U/ml, 链霉素1 mg/ml)稀释至1×104/ml后接种于培养瓶内, 置37 ℃、5%CO2细胞培养箱培养。肾小管上皮细胞鉴定:培养第5天, 2.5%戊二醛4℃固定10 min, 蒸馏水冲洗作碱性磷酸酶染色。应用偶氮偶联法对细胞进行染色。底物、显色剂与缓冲液按1:1:50比例混合配制孵育液。将固定后的细胞浸入孵育液, 37 ℃条件下孵育1 h, 蒸馏水冲洗, 晾干, 中性树胶封片, 光镜观察、摄片。取1瓶长满的肾小管上皮细胞。0.25%胰酶消化, 用培养液稀释到1.5×104个/ml。以200 μl每孔接种于96孔细胞培养板, 在第1天、第4天、第7天、第10天分别取一板细胞作MMT测定。方法:弃培养上清, 每孔加无血清RPMI1640培养液100 μl, MTT (二甲基噻唑二苯基四唑溴盐) 10 μl, 37 ℃孵育4 h, 加入20%的SDS (十二烷基硫酸钠) 150 μl, 37 ℃温育2 h, 酶标仪570 nm波长检测吸光度值。以培养天数为横坐标, 以MTT值为纵坐标绘制细胞生长曲线。重复实验3次。
1.2 照射条件照射源为137Cs射线, 剂量率0.91 Gy/min。分别以0、1、5、10 Gy γ射线照射接种于96孔板和25 cm2培养瓶的肾小管上皮细胞。
1.3 观察指标 1.3.1 增殖率取1瓶长满的肾小管上皮细胞。0.25%胰酶消化, 用培养液稀释到1.5×104个/ml。以200 μl每孔接种于96孔细胞培养板, 培养24 h, 分别以0、1、5、10Gy γ射线照射细胞, 照射后继续入细胞培养箱培养。在照射后第1天、第4天、第7天、第10天分别取一板细胞作MMT测定。方法同上。重复实验3次。
1.3.2 酶、细胞因子mRNA表达取8瓶85%长满的肾小管上皮细胞, 分别以0Gy、1Gy、5Gy、10Gy137Cs-γ射线照射, 每个剂量2瓶。照射后培养48 min。每瓶细胞各加Trizol 1 ml, 提取细胞总RNA, 取1 μl, 加DEPC水至100 μl, 紫外分光光度计测定OD260和OD280值, 使OD260/OD280值在1.8~2.0之间, 计算总RNA浓度=OD260×4 (μg/μl), 将RNA稀释到1μg/μl。RT-PCR法检测肾小管上皮细胞Na+, K+-ATP酶、TGF-β、OPN、IGF-I、1α羟化酶、24羟化酶的mRNA表达改变。Na+, K+-ATP酶基因退火温度54 ℃, GAPDH、OPN基因的退火温度56 ℃, TGF-β、IGF-I、24羟化酶基因的退火温度58 ℃, 1α羟化酶基因的退火温度64 ℃。重复实验3次。
|
|
表 1 肾脏基因PCR引物序列 |
取8瓶85%长满的肾小管上皮细胞, 分别以0Gy、1Gy、5Gy、10Gy137Cs-γ射线照射, 每个剂量2瓶。照射后培养48 h。0.25%胰酶消化细胞, 将细胞收集于1 ml离心管内, PBS洗涤2次, 各加细胞裂解液100 μl, 提取细胞总蛋白, 采用Piece公司的BCA蛋白浓度试剂盒测定各组细胞的蛋白量。Western blot法测定肾小管上皮细胞TGF-β、IGF-I、OPN的蛋白表达改变。重复实验3次。
1.4 统计学处理实验数据以x±s表示, 各组之间的差异用SPSS10.0统计软件进行方差分析, P < 0.05为差异有统计学意义。
2 结果 2.1 原代肾小管上皮细胞的鉴定培养第2天, 在倒置相差显微镜下可见上皮细胞由贴壁的肾小管节段周围长出, 细胞岛逐渐增大, 5~7 d内细胞呈指数增长, 1周左右细胞汇合。细胞形态以长梭形、多边形为主。培养第2天, 可见比较多的悬浮细胞, 以后悬浮细胞数减少, 但总有小部分细胞不能贴壁生长。由生长曲线看出, 培养第2~3天细胞生长缓慢, 第3~5天生长速度加快, 第5~7天进入对数生长起, 第7~10天细胞增殖减慢。碱性磷酸酶染色可见, 大部分肾小管上皮细胞染色呈阳性, 表现为胞浆呈紫色颗粒状, 细胞核染色阴性。

|
图 1 原代培养肾小管上皮细胞生长曲线 |
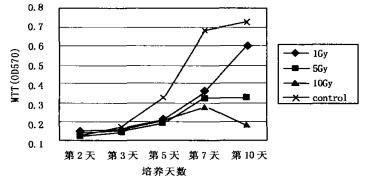
肾小管上皮细胞受1Gy γ射线照射后, 增殖较正常对照细胞降低, 对数生长期延迟2~3d, 细胞数减少。5Gy、10Gyγ射线照射后, 肾小管上皮细胞增殖力明显降低, 基本不出现对数生长期, 第3~7天期间有一定增殖, 第5天、第7天和第10天, 细胞增殖分别较0Gy组降低34.0% (P < 0.05)、49.2 % (P < 0.05)、54.3% (P < 0.05)和29.4% (P < 0.05)、55.3% (P < 0.05)、74.2% (P < 0.05)。
|
图 2 不同剂量射线照射对肾小管上皮细胞增殖的影响 |
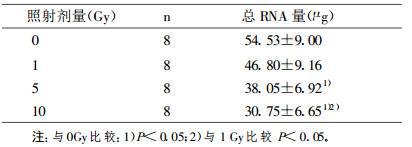
与对照细胞比较, 受1 Gy、5 Gy、10 Gy γ射线照射的肾小管上皮细胞总RNA量分别降低14.2%、30.2% (P < 0.05)和43.6% (P < 0.05)。RT-PCR结果显示, 1 Gy、5 Gy、10 Gy γ射线照射分别使肾小管上皮细胞Na+, K+-ATP酶mRNA表达较对照降低28.9% (P < 0.05)、39.4% (P < 0.05)和62.6% (P < 0.05);使1α羟化酶mRNA表达降低21.2% (P < 0.05)、64.0% (P < 0.05)和77.5% (P < 0.05);使24羟化酶mRNA表达降低23.1% (P < 0.05)、60.5% (P < 0.05)和77.8% (P < 0.05);使TGF-βmRNA表达升高42.6% (P < 0.05)、72.4% (P < 0.05)和76.2% (P < 0.05)。与对照细胞比较, 受各剂量照射的肾小管上皮细胞OPN和IGF mRNA表达无显著改变。
|
|
表 2 不同剂量γ射线照射后肾小管细胞的总RNA量(x±s) |
|
|
表 3 不同剂量γ射线照射肾小管细胞后相关基因mRNA表达量(x±s) |
与对照细胞比较, 受1Gy、5Gy、10Gy γ射线照射的肾小管上皮细胞总蛋白量分别降低14.3% (P < 0.05)、19.2% (P < 0.05)和32.7% (P < 0.05)。Western blot结果显示, 受1Gy、5Gy、10Gy γ射线照射的肾小管上皮细胞TGF-β蛋白量明显提高。受1Gy射线照射后OPN蛋白量提高, 而受5Gy、10Gy照射后OPN蛋白量降低。
|
|
表 4 不同剂量γ射线照射后肾小管细胞总蛋白量(x±s) |
显微分离法是获得肾小管上皮细胞的良好方法, 但获得的细胞数量有限, 且需要具备特定的实验设备和条件。参考现有文献, 经过多次摸索, 本实验所建立的分离培养方法可获得相对较纯的近端肾小管上皮细胞, 足以满足本实验的需要。目前存在多种永生化的肾小管上皮细胞株, 如LLC-PK1、MDCK、OK等, 这些细胞已被用于各种实验研究。但这些细胞经过改造, 其对某一影响因素的反应并不一定与原来状态的细胞一致。因此, 本研究采用原代分离培养的肾小管上皮细胞作为研究对象。肾小管上皮细胞对电离辐射较敏感, 其损伤效应与照射剂量明显相关。本研究表明, 1Gy γ射线照射后, 肾小管上皮细胞增殖延缓, 对数生长期出现晚, 而受较高剂量的γ射线射线后肾小管上皮细胞的增殖与蛋白质合成显著受抑, 不出现对数生长期。根据照射后细胞死亡发生的时间和增殖与否可将电离辐射致细胞死亡分为增殖死亡(reproductive death)和间期死亡(interphase death), 前者是指照射细胞丧失了持续增殖的能力, 在经过一个或几个有丝分裂周期后丧失代谢活动和细胞功能而死亡; 后者是指照射细胞未经分裂就死亡。根据形态学特征和发生机制又可将电离辐射致细胞死亡分为凋亡和坏死。本研究显示, 各剂量照射后3至7d, 细胞数量均较未处理细胞少, 但仍具有一定的增殖能力, 所以这期间细胞数量的减少主要原因是间期死亡, 当然坏死和凋亡均有发生。在实验第7至10d, 1Gy射线照射细胞处于对数生长期, 5Gy射线照射细胞数量变化不大, 而10Gy射线照射细胞数量明显减少。这个时期的细胞死亡, 以增殖死亡为主, 且受照剂量越大, 增殖死亡比例也越大。电离辐射致肾小管上皮细胞间期死亡的主要机制是代谢障碍, 如氧化磷酸化解偶联、糖酵解增强与乳酸量增加等导致细胞内ATP含量显著降低, 以及细胞膜系统的破坏。电离辐射致肾小管上皮细胞增殖死亡的主要机制是DNA双链断裂, 这可导致染色体缺失和互换等畸变, 在分裂时子代细胞不能得到完整的染色体, 以致子代细胞不能进入下一次分裂而死亡。Na+, K+-ATP酶是成熟肾小管上皮细胞表型标志之一。本研究表明, 137Cs γ射线照射后, 肾小管上皮细胞Na+, K+-ATP酶mRNA表达降低, 至少在RNA水平说明照射后肾小管上皮细胞有向其它种类细胞(成纤维细胞)转化的趋势, 这与动物实验的结果相一致。1α羟化酶是肾小管细胞合成1, 25 (OH) 2D3的功能酶, γ射线照射后1α羟化酶mRNA表达降低, 说明肾小管上皮细胞D-激素合成功能降低。肾小管上皮细胞受照射后, 虽然OPN mRNA表达无显著改变, 但受1Gy射线照射后其蛋白质表达量显著提高, 受5 Gy和10 Gy射线照射后蛋白表达降低, 说明存在转录后修饰。OPN是一种具有细胞外基质蛋白结构和功能特点的分泌性糖蛋白, 富含的天冬氨酸、丝氨酸和苏氨酸残基常被磷酸化[2]。正常情况下, OPN主要分布于骨骼和肾脏, 同时在多数上皮细胞及尿、唾液、奶和胆汁中也可检出。在炎症和组织重建时, OPN则可高表达。Ophascharoensuk等[3]发现在野生型大鼠, 肾脏OPN表达升高, 野生型组细胞外Ⅰ型和Ⅳ型胶原的量也是OPN缺陷型组的2-4倍。与野生型组比较, OPN缺陷型组肾小管上皮细胞和间质细胞的凋亡数较多。在离体条件下, 抗OPN中和抗体可提高无血清培养时肾小管上皮细胞的凋亡发生率, 说明OPN对肾小管上皮细胞有保护作用。在急性缺血再灌注损伤后, 与OPN缺陷型比较, 野生型鼠能更好地保持血肌酐和尿素氮水平, 且肾OPN表达提高2.7倍[4]。OPN缺陷型鼠的肾病理改变较野生型显著, 且一氧化氮合酶表达提高。在体外缺氧条件下, OPN对肾小管上皮细胞有保护作用, 而缺乏RGD结构的不完整OPN则不具有细胞保护作用。说明在急性缺血时, OPN具有肾脏保护作用。因此, 肾小管上皮细胞受1Gy射线照射时, OPN蛋白的升高对肾小管上皮细胞可能起一种反应性保护作用, 从而减少增殖性死亡。而受到5Gy和10Gy射线照射后, 翻译后修饰机制受损, OPN蛋白量减少, 对肾小管上皮细胞保护作用降低, 增殖性死亡增多。
本研究结果证实, 受不同剂量射线照射后肾小管上皮细胞TGF-βmRNA和蛋白质表达升高, 尤以5Gy和10Gy照射后显著。TGF-β是一种促凋亡因子, 其表达的升高, 可促进相邻细胞或细胞自身的凋亡。一氧化氮合成酶抑制剂或血管紧张素Ⅲ型受体阻断剂可抑制一氧化氮和TGF-β1的表达。TGF-β1可抑制iNOS蛋白和一氧化氮, 而抗TGF-β1抗体可促进iNOS。说明一氧化氮是血管紧张素Ⅱ促进TGF-β1表达的介质, 而TGF-β1是一氧化氮的负性调节因素[5]。最近有研究表明, 抗TGF-β抗体可减弱血管紧张素Ⅱ的促肾小管上皮细胞凋亡作用[6]。此外, TGF-β也是组织纤维化的重要始动因子, 并抑制纤溶酶原的活性, 可导致纤维蛋白等基质蛋白在细胞外的堆积[7]。因此, 在受射线照射后, 肾小管上皮细胞合成分泌的TGF-β增加, 一方面促进细胞的凋亡, 另一方面促进细胞外基质蛋白的合成, 最终导致组织纤维化的发生。总之, 不同剂量γ射线可明显抑制肾小管上皮细胞的增殖, 促使肾小管上皮细胞向成纤维细胞转化, 并通过增加TGF-β的分泌促进纤维蛋白等基质蛋白在细胞外的堆积, 这种作用存在明显的剂量依赖关系。
| [1] |
高林峰, 王洪复, 朱飞鹏. 电离辐射肾损伤病理特点及其机理研究[J]. 中华放射医学与防护杂志, 2004, 24(5): 430-432. DOI:10.3760/cma.j.issn.0254-5098.2004.05.016 |
| [2] |
Cecilia M, Giachelli U, Susan Steitz. Osteopontin:a versatileregulator of inflammation and Biomineralization[J]. Matrix Biolo-gy, 2000, 19: 615-622. DOI:10.1016/S0945-053X(00)00108-6 |
| [3] |
Ophascharoensuk V, Giachelli CM, Gordon K, et al. Obstructiveuropathy in the mouse:role of osteopontin in interstitial fibrosisand apoptosis[J]. Kidney Int, 1999, 56(2): 571-580. DOI:10.1046/j.1523-1755.1999.00580.x |
| [4] |
Noiri E, Dickman K, Miller F, et al. Reduced tolerance to acuterenal ischemia in mice with a targeted disruption of the osteopontingene[J]. Kidney Int, 1999, 56(1): 74-82. DOI:10.1046/j.1523-1755.1999.00526.x |
| [5] |
Miyajima A, Chen J, Kirman I, et al. Interaction of nitric oxideand transforming growth factor-beta1 induced by angiotensin Ⅱand mechanical stretch in rat renal tubular epithelial cells[J]. JUrol, 2000, 164(5): 1729-1734. |
| [6] |
Bhaskaran M, Reddy K, Radhakrishanan N, et al. Angiotensin Ⅱinduces apoptosis in renal proximal tubular cells[J]. Am J PhysiolRenal Physiol, 2003, 284(5): F955-965. DOI:10.1152/ajprenal.00246.2002 |
| [7] |
Zhao W, O'Malley Y, Wei S, et al. Irradiation of rat tubule epi-thelial cells alters the expression of gene products associated withthe synthesis and degradation of extracellular matrix[J]. Int J Ra-diat Biol, 2000, 76(3): 391-402. DOI:10.1080/095530000138736 |