碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)和脑源性神经营养因子(brain -derived neurotrophic factor, BDNF)在神经系统发生、发育过程中促进细胞的增殖、生长、分化及功能表达; 当神经系统损伤, 如脑缺血、电离辐射、机械性损伤、癫痫发作以及神经系统退行性疾病, bFGF和BDNF具有神经保护与修复的作用, 防止神经元变性、坏死或凋亡, 促进神经组织结构和功能的恢复[1~3]。内源性的褪黑激素是主要由松果体分泌的吲哚类神经内分泌激素, 具有广泛的生理作用[4, 5]。近年来对褪黑激素的药理作用的研究越来越多, 尤其是其抗脑损伤的作用受到重视[6~8]。本研究通过免疫组织化学染色法观察电离辐射损伤大鼠前脑和室管膜下层细胞bFGF、BDNF的表达以及室管膜下层神经干细胞增殖、分裂和迁移, 探讨褪黑激素对电离辐射脑损伤后的神经保护作用及其机制[9~11]。
1 材料与方法 1.1 动物分组处理由本院实验动物中心提供的SD大鼠60只, 雄性, 体重为225~ 385 g之间, 室温条件饲养, 光照为12 h: 12 h(明:暗), 随机抽取, 分为3组:用药实验组褪黑激素+辐射处理, 36只, 于每日20时腹腔注射褪黑激素1 mg·kg-1、5 mg·ml-1、10 mg·kg-1 3种剂量(以用药实验组Ⅰ-Ⅲ表示), 连续10d。褪黑激素(melatonin)为Sigma公司产品, 使用前先用无水乙醇溶解, 然后加生理盐水稀释, 褪黑激素浓度为3 mg·L-1, 无水乙醇浓度小于0.5 %(V: V); 照射对照组生理盐水+辐射处理, 12只, 与用药实验组相同时间腹腔注射1 ml生理盐水; 空白对照组12只, 不作处理, 其他条件同上述二组。
1.2 照射方法用药实验组和照射对照组动物在清醒状态下固定于特制的固定装置上, 用Varian-600直线加速器(美国Varian公司产品)产生的6MVX射线, 一次性照射, 照射剂量为600cGy。
1.3 切片制备各组动物分别于照射后存活1d和5d用10%水合氯醛麻醉, 用0.9%生理盐水250 ml经心脏快速灌注冲洗, 再用4%多聚甲醛(用0.1MPB配置, pH 7.2~7.4)200 ml灌注, 取脑, 10%甲醛固定48 h以上。以松果体为标志, 向头侧水平切取3段, 每段厚2 mm。石蜡包埋, 连续切片, 片厚10 μm。
1.4 免疫组织化学染色采用ABC法, 切片入1% H2O2(甲醇配置), 室温30 min消除内源性过氧化物酶; 蛋白酶K消化, 37 ℃30 min; 10%正常羊血清封闭, 37 ℃30 min; 切片分别兔抗大鼠bFGF(1: 800, Santa Cruz)、兔抗大鼠BDNF(1: 100, Santa Cruz)孵育, 4 ℃过夜。S-A HRP工作液(ZYM ED)37 ℃ 2 h; DAB显色(0.05 %DAB 0.01% H2O2, 0.01MPBS)5 min, 常规脱水、透明、封片。除用10%正常羊血清封闭后直接入一抗外, 其余各步骤间均用0.01MPBS(pH 7.2)漂洗3次, 每次5 min。
1.5 图像分析及统计学处理各组连续切片, 相同层面选取3张切片, 每张切选取3个视野, 用CMIAS 98彩色病理图像分析系统进行分析, 0.5×0.5计数器计数bFGF和BDNF染色阳性细胞。实验数据以均数±标准差(x±s)表示, 组间比较用单因素方差分析, 两两比较用t检验。
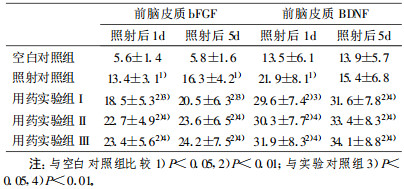
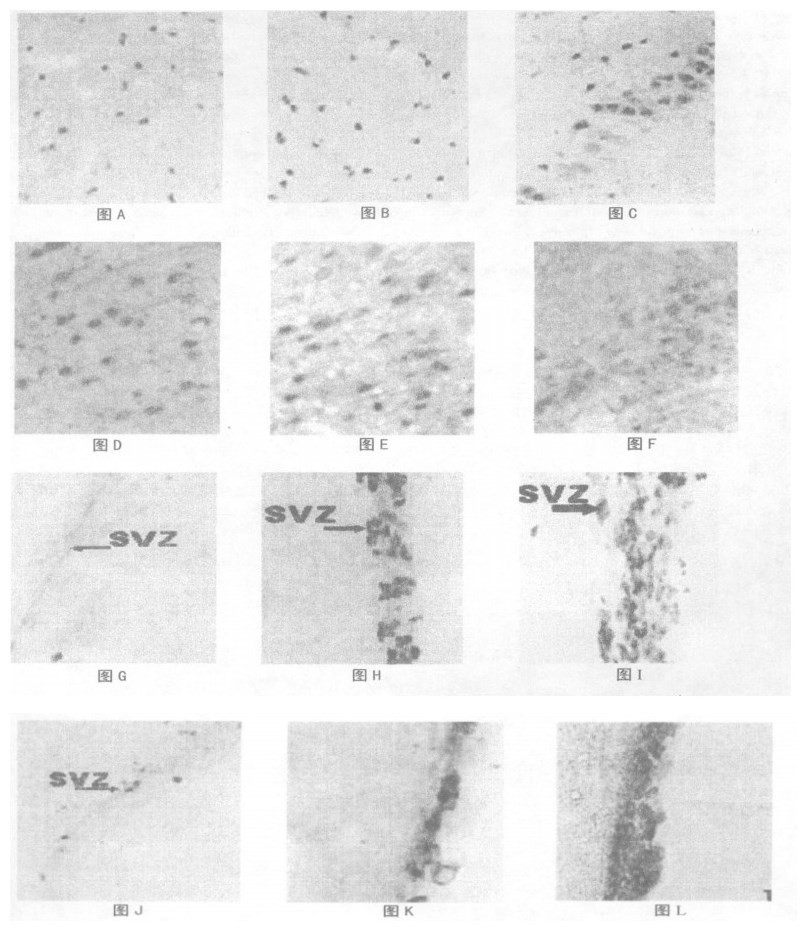
2 结果 2.1 bFGF和BDNF在前脑皮质的表达空白对照组皮质有少量bFGF和BDNF染色阳性细胞, 阳性细胞有神经元和胶质细胞。X射线照射后1dbFGF和BDNF表达增多, 5d时表达减弱。给予褪黑激素, 用药实验组皮质内bFGF和BDNF阳性细胞与空白和照射对照组比较数量明显增多、反应明显增强。bFGF阳性胶质细胞反应部位在胞核, 细胞核有明显的形态改变, 表现为椭圆或杆状, 在皮质Ⅰ-Ⅵ层都有广泛分布, bFGF阳性神经细胞数量和反应强度以Ⅲ -Ⅵ层最为明显。经图像分析和统计处理, 用药实验组阳性细胞数较空白对照组和照射对照组之间差异有显著性(P<0.01), 具有统计学意义(表 1; 图A, B, C)。BDNF阳性神经元分布于皮层的Ⅱ-Ⅵ层, Ⅲ层和Ⅴ层锥体细胞可见阳性反应, 阳性部位主要在胞浆, 许多神经元胞核也呈阳性反应。经图像分析和统计处理, 用药实验组阳性细胞数较空白对照组和照射对照组均增高(P<0.01或P<0.05), 具有统计学意义(表 1; 图D, E, F)。
|
|
表 1 前脑皮质bFGF和BDNF染色阳性细胞(x±s) |
|
插图说明:
图A 空白对照组, 前脑皮质bFGF染色(×400) 图B 照射对照组, 前脑皮质bFGF染色(×400) 图C 用药实验组, 前脑皮质bFGF染色(×400) 图D 空白对照组, 前脑皮质BDNF染色(×400) 图E 照射对照组, 前脑皮质BDNF染色(×400) 图F 用药实验组, 前脑皮质BDNF染色(×400) 图G 空白对照组, 室管膜下层bFGF染色(×400) 图H 照射对照组, 室管膜下层bFGF染色(×400) 图I 用药实验组, 室管膜下层bFGF染色(×400) 图J 空白对照组, 室管膜下层BDNF染色(×400) 图K 照射对照组, 室管膜下层BDNF染色(×400) 图L 用药实验组, 室管膜下层BDNF染色(×400) |
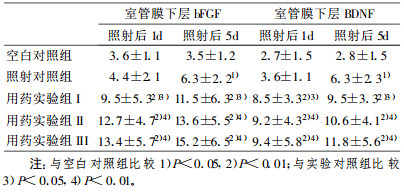
正常情况下室管膜下层仅1-2细胞, bFGF和BDNF阳性细胞数量很少, 反应较弱。电离辐射后1 d bFGF和BDNF在室管膜下层细胞的表达增加不明显; 电离辐射后5 d bFGF和BDNF在室管膜下层细胞的表达已明显增多、增强, 阳性反应部位在细胞核, 核染色呈深棕色, 阳性细胞扩增为多层, 形态改变显著, 大部分阳性细胞核呈椭圆或杆状。褪黑激素用药实验组与照射对照组比较, 室管膜下层的bFGF和BDNF阳性细胞数目明显增多, 反应明显增强, bFGF和BDNF阳性细胞扩增更加显著(3~5层细胞), 差异有显著性(P<0.01)。(图G~ L, 表 2)。
|
|
表 2 室管膜下层bFGF和BDNF染色阳性细胞(x±s) |
大量离体和在体研究报道[1~3] bFGF和BDNF不仅对神经组织正常功能维持起着重要作用, 而且在损伤情况下能够促进神经元的存活及受损神经组织的修复。外源性bFGF和BDNF注入体内可以减轻损伤神经元的受损程度, 促进损伤神经元的存活和修复[6~8]。
本实验结果显示, 在电离辐射损伤模型大鼠前脑皮质和室管膜下层细胞bFGF和BDNF有广泛表达, 但二者对损伤的反应形式不尽相同。损伤早期bFGF在前脑皮层的表达以神经元表达为主, 损伤后期主要在胶质细胞表达; 可能是损伤早期神经元表达bFGF与其自我保护机制有关, 而脑内非神经元广泛持久的表达bFGF与脑内神经组织修复和神经组织再生有关, 尤其与星形胶质细胞的功能有关。bFGF可促进神经元的存活, 突起生长及受损神经组织的修复。bFGF还可作为星形胶质细胞的有丝分裂原促进受损星形胶质细胞的增殖、分裂和迁移, 增强星形胶质细胞对损伤的反应性[1]。电离辐射损伤后BDNF在皮质细胞表达上调50%以上, 从表达的细胞类型看BDNF以神经元表达为主, 从表达的时间顺序看BDNF表达较为持久, 说明BDNF和bFGF对在电离辐射损伤的保护和修复作用存在不同机制[5~7]。电离辐射损伤bFGF和BDNF在室管膜下层细胞表达也增多、增强, 但表达的时间较迟, 较为持久[7, 9]。有研究证明[4, 5], 脑细胞有褪黑激素的受体, 褪黑激素与细胞膜上的受体结合, 通过第二信使钙离子转导信号发挥作用。本实验给予褪黑激素, bFGF和BDNF在受损大鼠前脑皮质神经元和胶质细胞以及管膜下层细胞的表达明显增多增强, 持续时间增长。外源性褪黑激素可以上调内源性bFGF和BDNF的表达水平, 表达水平与褪黑激素的剂量相关。褪黑激素通过促进室管膜下层神经干细胞增殖、分裂和向损伤部位迁移[9~11]。说明褪黑激素具有较好的抗电离辐射性损伤作用。
| [1] |
Abe K, Saito H. Effects of basic fibroblast growth factor on central nervous system functions[J]. Pharmacol Res, 2001, 43(4): 307-312. |
| [2] |
LeMaster AM, Krimm RF, Davis BM, et al. Overexpression of brain-derived neurotrophic factor enhances sensory innervation and selectively increases neuron number[J]. J Neurosci, 1999, 19(14): 5919-5931. |
| [3] |
Carter AR, Chen C, Schwartz PM, et al. Brain-derived neurotrophic factor modulates cerebellar plasticity and synaptic ultrastructure[J]. J Neurosci, 2002, 22(4): 1316-1327. |
| [4] |
Pei z, Pang SF, Cheung RT. Pretreatment with melatonin reduces volume of cerebral infarction in rat middle cerebral artery occlusion stroke modal[J]. J Pineal Res, 2002, 32(3): 168-172. |
| [5] |
Morgan PJ, Barrett p, Howell HE, et al. Melatonin receptors : Localization, molecular pharmacology and physiological significance[J]. Neurochem Int, 1994, 24(2): 101-146. |
| [6] |
Tsukahara T, Yonekawa Y, Tanaka K. The role of brain- derived neurotrophic factor in transient forebrain ischemia in the rat brain[J]. Neurosurgery, 1994, 43(2): 323-331. |
| [7] |
Kiprianova I, Freiman TM, Desiderato S, et al. Brain-derived neurotrophic factor prevents neuronal death and glial activation after global ischemia in the rat[J]. J Neurosci Res, 1999, 56(1): 21-27. |
| [8] |
Tong L, Perez-Polo R. Brain-derived neurotrophic factor (BDNF) protects cultured rat cerebellar granule neurons against glucose deprivation-induced apoptosis[J]. J Neural Transm, 1998, 105(8-9): 905-914. |
| [9] |
Jin K, et al. Neurogenesis in dentate subgranular zone and rostral subventricular zone after local cerebral ischemia in the rat[J]. Proc Natl Acad Sci, 2001, 8: 4710-4715. |
| [10] |
Nathalie picard-Riera. Experemental autoimmue encephalomy -elitis mobilizes neural progenitors to undergo oligodendrocytes in adult mice[J]. Proc Natl Acad Sci, 2002, 20: 13211-13216. |
| [11] |
Parent JM, Valentin VV, Lowenstein DH. Prolonged seizures increase proliferating neuroblasts in the adult Rat Subventricular zone-olfactory bulb pathway[J]. The Journal of Neuroscience, 2002, 22(8): 3174-3188. |