辐射是已知的环境致癌因素, 其损伤的终点是基因组DNA的结构和功能[1]。而DNA损伤修复可以对抗辐射的危害, 在基因组稳定性方面起着重要作用。X射线修复交叉互补基因(X ray repair cross complementing genes, XRCC)是参与DNA损伤修复的一组重要基因, 目前已鉴定出11种不同的遗传族群。其中, XRCC1和XRCC5基因分别为参与DNA单链断裂(SSB)和双链断裂(DSB)重接的两个关键基因, 其表达直接影响对DNA损伤的修复能力, 也反应了对电离辐射的敏感性。IRM-2小鼠是我所培育的近交系小鼠品系, 该小鼠突出的生物学特性是具有较强的辐射抗性[2]及较低的染色体畸变率[3]。我们通过观察电离辐射后XRCC1及XRCC5修复基因mRNA表达水平, 对IRM-2小鼠及其亲本ICR/JCL及615小鼠进行对比研究, 分析DNA修复基因在IRM-2小鼠辐射抗性中发挥的作用。
1 材料和方法 1.1 材料 1.1.1 动物IRM-2小鼠、ICR/JCL及615小鼠, 6~8周龄, 体质量(20±2) g, 雄性, 随机分组, 每组6只。常规喂养, 由本所国家二级动物室培育[2], 级别为清洁实验动物。
1.1.2 主要试剂琼脂糖凝胶为Roche公司产品。TRizol试剂为美国Invitrogen公司产品。Rediprime Ⅱ Random Prime Labelling System和杂交液为美国Amersham Biosciences公司产品。
1.1.3 主要仪器137Cs γ射线照射源为加拿大产(型号USD), 紫外分光光度计为美国Beckman公司产品(型号DU800), 真空印迹装置和Doc1000凝胶成像系统为美国Bio-Rad公司产品。
1.2 方法 1.2.1 动物照射IRM-2、ICR/JCL及615小鼠接受1、2和4Gy 137Cs γ射线照射, 分别于照射后0.25、1、2h断颈处死(每个时间点6只动物), 提取脾细胞总RNA。对照组小鼠(6只)不照射。剂量率为0.99Gy/min。
1.2.2 小鼠脾细胞总RNA的提取:按TRizol试剂的说明书提取总RNA, 紫外分光光度计进行鉴定, OD260/OD280为1.8~2.0。
1.2.3 总RNA甲醛变性琼脂糖凝胶电泳总RNA变性30μg, 进行1%甲醛变性琼脂糖凝胶电泳, 90V (3~4V/cm)电泳2h。
1.2.4 真空印迹真空压力调至5in Hg (12.7cm Hg), 在凝胶上倒入1000~1500ml 10×SSC, 转膜2.5h。转膜结束后进行紫外交联。
1.2.5 Northern杂交按Rediprime Ⅱ Random Prime Labelling System的说明书, 用1.85×106 Bq (50μCi) [32P]dCTP标记XRCC1和XRCC5探针各17ng, β-actin探针8ng (为内参)。将尼龙膜放入杂交杯中, 加入5ml杂交液和沸水浴变性后的32P标记的探针, 65℃摇动温育2.5h。
1.2.6 放射自显影室温下用2×SSC, 0.1% SDS摇床洗膜20min两次, 然后用0.2×SSC, 0.1% SDS 65℃摇床洗膜一次。将膜封在保鲜膜中, 压上胶片, 将增感屏固定在暗盒盖上, -20℃冰箱过夜, 在暗室进行洗片。
1.2.7 图像分析Doc1000凝胶成像系统采集图像, 用Molecular AnalysisTM软件分析DNA条带分布及灰度关系。修复基因mRNA表达以修复基因条带黑度占对照基因条带黑度比例表示。
1.3 统计学处理实验数据以x±s表示, 采用t检验。以P < 0.05为有统计学意义。
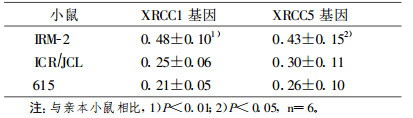
2 结果 2.1 对照组小鼠XRCC基因mRNA水平对照组IRM-2小鼠XRCC1及XRCC5基因mRNA水平明显高于其亲本对照组小鼠(P < 0.01及P < 0.05), 说明IRM-2小鼠的这两种修复基因基础表达即处于高水平, 见表 1。
|
|
表 1 对照组小鼠XRCC基因mRNA水平(x±s) |
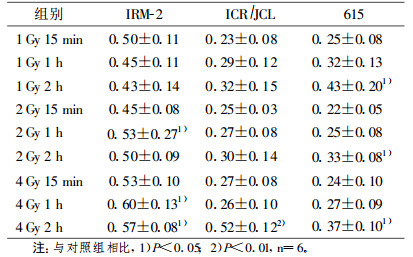
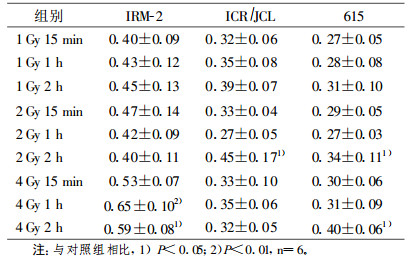
当分别接受1, 2及4Gy γ射线照射后, 亲本615及ICR/JCL小鼠XRCC1及XRCC5基因mRNA水平均有不同程度升高, 但显著变化出现在照射后2h (P < 0.05)。IRM-2小鼠在较低剂量1, 2Gy时变化不明显, 只在相对较高的4Gy剂量组照射后1h, XRCC1及XRCC5基因mRNA水平显著升高(P < 0.05及P < 0.01), 见表 2, 表 3。
|
|
表 2 γ射线照射后小鼠XRCC1基因mRNA表达(x±s) |
|
|
表 3 γ射线照射后小鼠XRCC5基因mRNA表达(x±s) |
众所周知, DNA是辐射杀伤的主要靶分子, 其效应表现为SSB、DSB及DNA-蛋白质交联。早在1968年Alexander提出了细胞辐射敏感性取决于其DNA链断裂修复能力的概念。近年来越来越多的证据表明, 有些细胞是由于SSB修复能力缺陷而对辐射敏感, 但大多数辐射敏感的细胞是由于内在缺乏或缺陷DSB修复能力所致[4], DSB的损伤和修复与辐射敏感性密切相关。
XRCC1基因是影响细胞对离子辐射敏感性被分离的第一个基因, 该基因能纠正EM9细胞SSB损伤修复的缺陷, 在SSB和碱基损伤修复中起重要作用。对XRCC1基因缺陷细胞系辐射诱发SSB的修复研究表明, 其快速修复期的损伤修复速率仅是亲本细胞系的1/3~1/2, 与慢速修复期修复速率相当。
XRCC5基因产物是Ku80蛋白(Ku家族), 能结合DSB的游离端, 在DSB修复和V (D) J重组中起重要作用[5]。研究表明, xr-5和xr-6中国仓鼠突变株由于缺乏编码Ku80的XRCC5基因, DSB的修复能力缺陷, 因此对射线敏感。而当把Ku80 cDNA转染到xr-5和xr-6细胞株后, xr-5细胞原来缺乏的对V (D) J重组修复的能力得到纠正, xr-6细胞对辐射的耐受性明显增加[6]。
由于辐射抗性在很大程度上取决于DNA损伤的最终修复结果, 因此我们主要考虑动物本身的修复功能来探讨IRM-2小鼠辐射抗性产生的可能机理。本研究结果表明, IRM-2小鼠XRCC1及XRCC5基因mRNA的基础表达水平较高, 当出现DNA链断裂时, 能够及时进行修复, 这可能对IRM-2小鼠辐射抗性具有一定的贡献。4Gy剂量照射后1h, IRM-2小鼠修复基因快速高表达, 可能是由于较高剂量照射后DNA双链断裂比例增加, 因此需要提高XRCC5基因的表达参与双链断裂修复, 这可能对IRM-2小鼠辐射抗性的贡献更大。
由于辐射引起DNA损伤上的多样性, 仅靠修复系统来解释辐射抗性是不完善的, 因为修复本身也是不完全的, 所以联合国辐射效应科学委员会的专家们推测, 除了修复系统外, 参入决定辐射抗性的大量人类基因尚未被发现[7], 需要提供辐射抗性动物或细胞系进行相关研究, 以便克隆辐射抗性基因。我们已经开展以IRM-2小鼠为材料的辐射抗性相关基因克隆工作[8], 相信可以从分子机理上对此小鼠辐射抗性进行更深入的解释。
| [1] |
Jenner TJ, Fulford J O, Neill P. Contribution of base lesions to radiation induced clustered DNA damage:implication for models of radiation response[J]. Radiat Res, 2001, 156(5Pt2): 590-593. |
| [2] |
周继文, 吴红英, 王月英, 等. IRM-2近交系小鼠对电离辐射抗性的研究[J]. 中国实验动物学报, 2001, 9(2): 73-77. DOI:10.3969/j.issn.1005-4847.2001.02.002 |
| [3] |
李进, 周继文, 吴红英, 等. IRM-2近交系小鼠的G-显带核型和自发畸变率的研究[J]. 中国实验动物学报, 2001, 9(3): 178-181. DOI:10.3969/j.issn.1005-4847.2001.03.013 |
| [4] |
Maity A, Kao GD, Muschel RJ, et al. Potential molecular targets for manipulating the radiation response[J]. Int J Radiation Oncol Biol Phys, 1997, 37(3): 639-653. DOI:10.1016/S0360-3016(96)00598-6 |
| [5] |
Bryntesson F, Regan JC, Jeggo PA, et al. Analysis of gene transcription in cell slacking DNA-PK activity[J]. Radiat Res, 2001, 156(2): 167-176. DOI:10.1667/0033-7587(2001)156[0167:AOGTIC]2.0.CO;2 |
| [6] |
Evans JW, Liu XF, Kirchgessner CU, et al. Induction and repair of chromosome aberrations in scid cells measured by premature[J]. Radiat Res, 1996, 145(1): 39-46. |
| [7] |
UNSCEAR.DNA repair and mutagenesis, in sources and effects of ionizing radiation[R].2000, 10
|
| [8] |
岳井银, 王芹, 穆传杰. IRM-2及其亲本小鼠mRNA差异显示分析[J]. 中国医学研究与临床, 2004, 2(12): 5-7. |