2. 广东医学院分析中心
琼枝麒麟菜(Eucheuma gelatinae)是一类海洋植物, 属红藻门, 红翎菜科, 广泛的分布在我国南海海域。琼枝麒麟菜中含有丰富的多糖, 主要由半乳糖组成, 同时还含有少量的葡萄糖、木糖、塔罗糖和艾杜糖。近年来研究表明麒麟菜多糖具有抗病毒、抗菌作用[1, 2], 但其抗辐射作用的机理未见报道。本实验采用2 Gy γ射线照射小鼠为模型, 观察琼枝麒麟菜多糖(Eucheuma gelatinae polysaccharide, EGP)对照射小鼠胸腺细胞细胞周期及细胞增殖影响, 以探讨EGP在细胞水平上的抗辐射作用, 为麒麟菜多糖成为临床抗辐射药物提供证据。
1 材料和方法 1.1 实验动物昆明小鼠50只, 雄性, 6 ~ 8周龄, 体重(20 ±2) g, 由广东医学院实验动物中心提供。
1.2 材料来源海藻多糖从海南产琼枝麒麟菜中提取, 藻体经95 ℃水浴提取、醇沉淀及流水透析后真空干燥制得, 由红外光谱鉴定呈β-糖苷键型特征吸收峰, 醋酸纤维薄膜电泳检测为电泳纯, 硫酸-酚法测得总糖含量为83 %。
1.3 主要试剂及仪器RPMI-1640培养液(Gibco, 美国), 小牛血清(Hyclone, 美国), ConA和LPS(Sigma, 美国), 3H-TdR(中科院上海原子核研究所); 流式细胞仪(Coulter, 美国), CO2培养箱(150, 丹麦), 标准架液体闪烁系统(LS-6000SC, 美国)。
1.4 照射条件60Co γ射线一次性全身均匀照射, 照射距离为80 cm, 剂量率为0.673 Gy/min, 吸收剂量为2 Gy。
1.5 分组处理昆明小鼠随机分为5组, 每组10只。EGP实验组以3个不同剂量(100, 200和400 mg·kg-1· d-1)分别给予, 按0.1 ml·(10 g)-1灌胃, 连续10 d; 正常对照组和模型组均用等量生理盐水灌胃; 停止灌胃20 h后行一次性γ射线全身照射(正常对照组不照射)。
1.6 细胞悬液制备照射后20 h小鼠断头处死, 无菌条件下取出脾脏和胸腺分别置于盛有RPMI-1640培养液的培养皿中, 毛玻片研磨后, 用200目不锈钢网滤出单细胞悬液, 经Hanks液洗2次(1 000r/min, 5min)后用RPMI-1640培养液调细胞浓度至5 ×106/ml (脾细胞)和1 ×107/ml(胸腺细胞)。将70 %冷乙醇固定的单个脾(胸腺)细胞悬液以1 000 r/min离心5 min, 弃乙醇, 用PBS洗细胞2次, 用震荡器震散细胞, 加入1 ml碘化丙锭(PI)染液(501 μg/ml), 混匀, 30 min后上机测定。
1.7 胸腺细胞3H-TdR掺入取96孔培养板, 每孔加入1 ×107/ml昆明小鼠胸腺细胞悬液200 μl, 同时每孔加入1.85 ×104 Bq/30μl 3H-TdR, 在恒温37 ℃、5 %CO2的培养箱中培养, 4 h后收获细胞, 应用标准架液体闪烁系统测3H-TdR掺入量。
1.8 脾细胞对ConA及LPS的增殖反应取96孔培养板, 每孔加入5 ×106/ml昆明小鼠脾细胞悬液100 μl, 同时加入100 μlConA (5 μg/ml)或LPS (20 μg/ml), 在恒温37 ℃、5 %CO2的培养箱中培养72 h, 终止前6 h每孔加入1.85 ×104 Bq/30 μl 3H-TdR, 多头细胞收集器收获细胞, 测其3H-TdR掺入量。
1.9 统计处理用SAS8.2软件进行单因素方差分析, 组间差异的显著性用q检验。
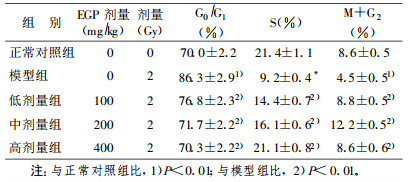
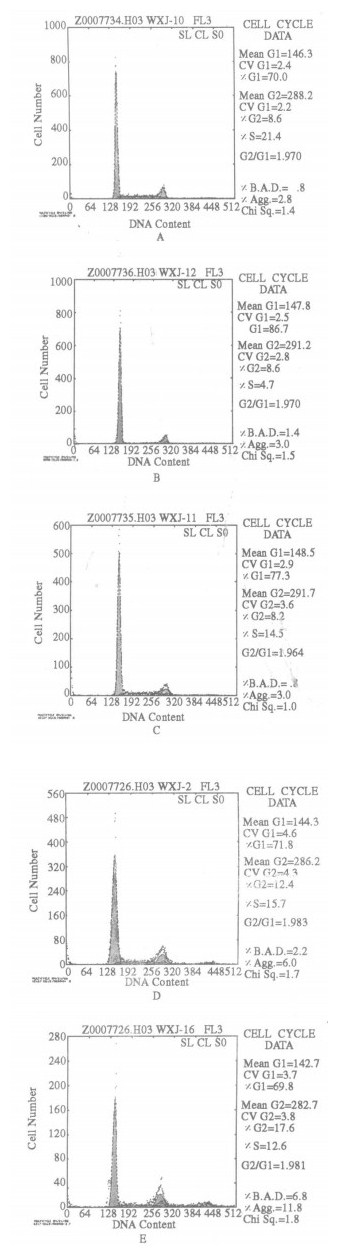
2 结果 2.1 琼枝麒麟菜多糖对脾细胞周期的影响(表 1, 图 1)|
|
表 1 琼枝麒麟菜多糖对脾细胞周期的影响(x ±s, n =10) |
|
图 1 琼枝麒麟菜多糖对辐射损伤小鼠脾细胞周期的影响 A正常对照组B模型组C 100 mg/kg EGP+辐射D 200 mg/kg EGP+辐射E 400 mg/kg EGP+辐射 |
从表中可看出, 小鼠经60Co γ射线2Gy照射后, G0/ G1期脾细胞明显增加, 而S期和(M + G2)期脾细胞明显减少(P < 0.01);与模型组相比, 100mg/kg、200mg/kg和400mg/kg EGP照射组小鼠的G0/G1期脾细胞明显减少, S期和(M +G2)期脾细胞明显增加(P < 0.01)。
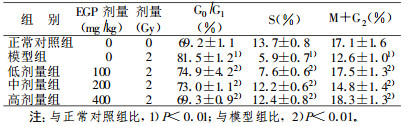
2.2 琼枝麒麟菜多糖对辐射损伤小鼠胸腺细胞周期的影响从表 2中可看出, 模型组与正常对照组比较, 小鼠经60Co γ射线2Gy照射后, G0/G1期胸腺细胞明显增加, 而S期和(M + G2)期胸腺细胞明显减少(P < 0.01);与模型组相比, 100 mg/kg、200 mg/kg和400mg/kg琼枝麒麟菜多糖照射组小鼠的G0/G1期胸腺细胞明显减少, S期和(M +G2)期胸腺细胞非常明显增加(P < 0.01)。
|
|
表 2 琼枝麒麟菜多糖对辐射损伤小鼠胸腺细胞周期的影响(x ±s, n =10) |
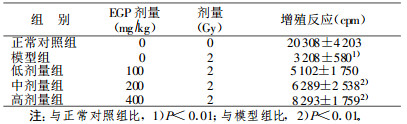
从表 3可以看出, 小鼠接受60Co γ射线2 Gy照射后, 模型组小鼠胸腺细胞3H-TdR掺入值显著低于正常对照组(P < 0.01)。经200 mg/kg和400mg/kg剂量的EGP腹腔注射的小鼠胸腺细胞3H-TdR掺入值明显高于模型组, 差异有显著性(P < 0.01)。100 mg/kg剂量的琼枝麒麟菜多糖腹腔注射的小鼠胸腺细胞3H-TdR掺入值与模型组相比差异无显著性。
|
|
表 3 琼枝麒麟菜多糖对小鼠胸腺细胞3H-TdR掺入的影响(x ±s, n =10) |
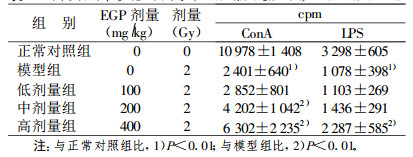
由表 4可以看出, 小鼠接受60Co γ射线2Gy照射后, 模型组小鼠脾细胞对ConA及LPS的增殖值明显低于正常对照组(P < 0.01);200 mg/kg剂量的EGP腹腔注射的小鼠脾细胞对ConA的增殖值明显高于模型组, 差异有显著性(P < 0.01), 但对LPS的增殖与模型组相比差异无显著性(P > 0.05); 400 mg/kg剂量的EGP腹腔注射的小鼠脾细胞对ConA及LPS刺激的小鼠脾细胞增殖值均明显高于模型组, 差异有显著性(P < 0.01)。
|
|
表 4 琼枝麒麟菜多糖对小鼠脾细胞增殖反应的影响(x±s, n =10) |
放疗是治疗恶性肿瘤的重要手段, 但放疗在杀死肿瘤细胞的同时, 多伴有其他组织损害。放射线对机体免疫系统造成的毒副作用一直是临床亟待解决的难题, 对机体进行射线防护中, 提高机体的免疫功能是重要的环节[3]。辐射损伤的自然修复是一个漫长的过程, 若能给予适当的药物辅助以预防和促进恢复是很有必要的。目前有效的化学辐射防护药物, 由于具有较大的毒副作用而降低了其临床应用价值[4]。因此, 寻找安全、有效和毒副作用小的辐射防护药物是当前放射生物学的紧迫任务之一[5]。海藻多糖作为一类天然产物, 由于其毒副作用小, 来源丰富, 迅速成为辐射防护药物研究的热点[6, 7]。
细胞周期测定是分析细胞增殖动力学的一种快速和准确的方法。本研究显示: 2 Gy γ射线全身照射后, 胸腺细胞出现明显G1、G2阻滞, S期明显受抑, 预防给予小鼠琼枝麒麟菜多糖胸腺细胞细胞周期率明显改变, 表现为实验组小鼠胸腺S、G2 +M期细胞比模型组明显增加, 说明琼枝麒麟菜多糖可促进胸腺细胞的分裂增殖, 从而使受射线照射损伤细胞得到快速修复。
本次实验细胞增殖结果表明, 小鼠接受2Gy γ射线全身照射后20 h, 小鼠胸腺细胞自发掺入3H-TdR、脾细胞对ConA及LPS的增殖反应均明显降低, 说明电离辐射对小鼠T、B淋巴细胞免疫功能造成了急性损伤。预防性给予小鼠琼枝麒麟菜多糖后再进行照射, 可明显抑制小鼠胸腺细胞自发掺入3H-TdR、脾细胞对ConA及LPS的增殖反应的降低, 而且琼枝麒麟菜多糖对受照小鼠的上述指标的降低程度与用药剂量呈负相关。以上结果与刘志辉等[8]报道相一致。
| [1] |
郭凌, 包惠燕, 叶绍明, 等. 琼枝麒麟菜和异枝麒麟菜硫酸多糖及其水解产物的抑菌作用[J]. 暨南大学学报(自然科学版), 2002, 23(2): 79-84. |
| [2] |
叶绍明, 岑颖洲, 邱玉明, 等.异枝麒麟菜多糖的体外抗病毒作用的初步研究[A].南京生化药学与多糖类药物国际学术研讨会论文集[C]. 2003: 397-400.
|
| [3] |
吴晓, 杨明亮, 黄晓兰, 等. 海带多糖的抗辐射作用与脾细胞凋亡[J]. 武汉大学学报(医学版), 2004, 25(3): 239-241. |
| [4] |
Capizzi RL. The preclinical basis broad-spectrum selective cytoprotection of normal tissues from cytotoxic therapies by amifostine[J]. Semin Oncol, 1999, 26(2): 3-21. |
| [5] |
Bohuslavizki KH, Klutmann S, Jenicke L, et al. Radioprotection of salivary glands by S-2-(3-aminopropylamino) -ethylphosphorothioic(amifostion)obtained in a rabbit animal model[J]. Int J Radiat Oncol Biol Phys, 1999, 45(1): 181-186. DOI:10.1016/S0360-3016(99)00160-1 |
| [6] |
Kim SG, Nam SY, Kim CW, et al. Radioprotective effects of 2-(allylthio) pyrazine an experimental chemopreventive agent: effects on detoxifying enzyme induction[J]. Res Commun Mol Pharmacol, 1998, 101(3): 275-288. |
| [7] |
Kim ND, Kim SG. Chemopreventive effects of 2-(allylthio) pyrazine[J]. Arch Pharm Res, 1999, 22(2): 99-107. DOI:10.1007/BF02976531 |
| [8] |
刘志辉, 孟庆勇, 刘秋英, 等. 海藻多糖对γ射线照射小鼠免疫功能的影响[J]. 中国公共卫生, 2003, 19(2): 171-172. |