放射性皮肤溃疡多见于放射性事故和肿瘤放疗等引起的并发症, 其特点为顽固性反复发作、长期不愈合, 最后可能发展为癌变[1]。此病变发生发展的分子机制尚不清楚, 更缺乏有效的治疗手段。作者以往的研究证实受照射皮肤组织中多种细胞凋亡率增高, 尤其是血管内皮细胞凋亡率增高, 伴随P53、Bax等表达的增高及Bcl-2表达的抑制。上述变化可能与放射性皮肤溃疡发生发展的机制相关[2, 3]。而在皮肤受照射后与细胞凋亡和溃疡愈合均密切相关的生长因子表达水平的变化规律尚不清楚。本研究试图通过检测受照射皮肤组织中多种生长因子及其受体的表达来分析放射性皮肤溃疡发生发展及难愈合的机制。
1 材料和方法40只清洁级雌性Wistar大鼠(250±10)g由军事医学科学院动物中心提供, 以60Coγ射线进行局部照射, 照射野为双侧臀部、双后腿及尾部, 照射剂量为50 Gy, 照射量率为4.612Gy/min, 一次照射。观察病变55d, 并分别于照射后1, 3, 5, 9, 11, 14, 17, 21, 25, 28, 35, 40, 55d各活杀3只动物取材。取材部位:溃疡出现前取双后肢内侧各一块, 溃疡出现后取溃疡部位。另8只未照射大鼠作为正常对照。另取大鼠21只, 经麻醉、备皮、局部消毒后, 于每只大鼠背部剪切2个直径为15mm的圆形伤口, 深及皮肤全层, 包扎后单笼饲养, 于伤后0, 1, 3, 7, 11, 14, 21d各活杀3只动物取材。标本经缓冲福尔马林液固定, 石蜡包埋, 切片后进行常规染色、免疫组化染色及原位杂交。
免疫组化染色法:切片按微波炉抗原修复法处理后, 抗VEGF(兔多抗, SantaCruz公司)1:100, 4℃过夜。以下方法按SP试剂盒(Zymed公司产品)方法进行, 以PBS、正常兔血清代替一抗作空白对照和替代对照, 以正常大鼠皮肤及大鼠单纯伤口愈合期伤部皮肤为实验对照[4], 以胞膜和(或)胞浆染成棕黄色作为阳性判定标准。
原位杂交方法:采用合成寡核苷酸探针, 长度43bp, 生物素标记, DAB显色。以PBS代替探针和杂交前RNaseA消化切片30min作为阴性对照。
图像分析及统计处理方法:于每组各时间点共选6张切片, 采用LeicaQTM970型自动图像分析仪, 400倍镜下测量阳性部位的积分光密度值(IOD)。以SAS 6.03软件包, 采用两因素析因设计及其资料的统计分析方法处理数据。
2 结果 2.1 病变观察照射后1~8d, 受照部皮肤无明显变化, 照后9~11d, 所有动物足底及尾跟部出现红肿, 照后13~15d, 所有动物首先于尾跟部及肛周出现小米至大米粒样大小的溃疡, 继而照射野内其余部位相继出现溃疡。溃疡底部开始为红色, 有渗出液, 未见感染。之后溃疡多逐渐扩大、加深, 水肿则渐减轻。照后23d, 最大溃疡环绕尾跟部10mm长。观察期间内未见到溃疡愈合现象。
光镜观察, 大鼠急性放射性皮肤损伤的基本病理改变可分为两期, 即溃疡前期和溃疡期。①溃疡前期的病变特点(照后1~14d):照射后1~7d可见受照区表皮细胞肿胀、变性及坏死, 偶见表皮微小局灶性增生, 照后9d出现少量表皮浅层缺失灶; 毛囊和皮脂腺周围有少量炎细胞浸润(中性粒细胞为主, 淋巴细胞次之); 血管充血明显, 并于照后9d出现小血管炎(小血管壁有炎细胞浸润)和内皮细胞坏死脱落; 照后9d真皮胶原纤维明显肿胀, 排列紊乱。②溃疡期的病变特点:照后14d可见多发局灶性溃疡形成, 部分融合、发展成较大溃疡。溃疡表面常为坏死组织层, 其特点是坏死组织和存活组织之间不能形成明显的划界性炎症。坏死层下面常为断裂、融解、紊乱的胶原纤维, 其中有成纤维细胞松散聚集形成的细胞团块, 有畸形成纤维细胞[5], 新生毛细血管数量较少, 不能形成有效的肉芽组织。炎症细胞数量不多, 以中性粒细胞为主, 淋巴细胞、巨噬细胞和浆细胞偶见。溃疡深层血管多有充血出血, 可见内皮细胞肿胀、脱落。溃疡区毛囊及皮脂腺多消失。溃疡周围表皮细胞增生活跃, 逐渐向溃疡区迁移, 但观察期内未见到溃疡完成愈合。非溃疡区可见到局灶性表皮细胞坏死及表皮萎缩现象。
单纯伤口:伤后7d伤口明显缩小, 14d愈合。镜下:伤后1~3d为炎症渗出期, 3~10d肉芽组织大量增生, 同时表皮细胞增殖移行, 至14d完全覆盖创面。
2.2 VEGF的表达 2.2.1 VEGF的表达(免疫组化)(1) 正常皮肤内VEGF为弱阳性, 主要分布在成纤维细胞及血管内皮细胞的胞膜及胞浆中。(2)在单纯伤口组, 自伤后1~5d, 伤口肉芽组织成纤维细胞、血管内皮细胞以及伤口新生表皮细胞中VEGF表达逐渐增强, 7~11d为高峰, 之后随伤口逐渐愈合而渐减弱。(3)照射组皮肤:在照后1~14dVEGF表达较正常皮肤轻度增高, 阳性部位相同; 溃疡形成后(14~55 d)表达明显增强, 但阳性细胞数量和强度均弱于单纯伤口组, 不能形成一个表达高峰, 如图 1所示, 阳性细胞同样为新生表皮细胞、成纤维细胞和少量的血管内皮细胞等(图 1统计结果显示, 两组表达水平差异有显著性, P < 0.01, 特别是在照射后21、25d差异尤为显著)。空白、替代对照均为阴性。
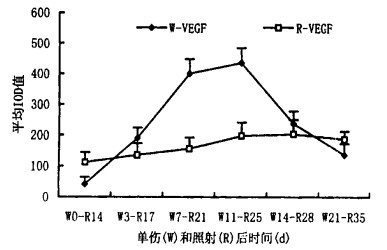
|
图 1 VEGF在单纯伤口及急性放射性皮肤溃疡组织中的表达水平(免疫组化) |
正常皮肤内VEGFmRNA为可疑阳性。在单纯伤口组和照射组VEGFmRNA阳性变化规律与VEGF免疫组化结果基本相同。
3 讨论作者以往的研究证实, 辐射引起的多种凋亡诱导基因的高表达以及过度的细胞凋亡与急性放射性皮肤溃疡发生发展的机制有关[2, 3, 6]。特别是辐射引起血管内皮细胞凋亡率增高, 影响新血管生成, 是放射性皮肤溃疡难愈合的重要机制。多种生长因子可抑制电离辐射诱导的细胞凋亡, 如bFGF, VEGF, EGF等均可抑制辐射诱导的血管内皮细胞凋亡, 促进细胞增殖[7]。多种生长因子在单纯伤口或其他类型皮肤创面内的高水平表达是创面愈合的重要始动和促进因素。生长因子通过其特异受体起作用, 它们可以调节自身或与其相关生长因子受体的表达。但电离辐射对局部放射性皮肤损伤(溃疡)组织中多种生长因子及其受体表达的影响规律尚未见报道。
创面局部的生长因子来源有两个, 一是血源, 一是局部组织细胞的分泌。辐射引起局部血循环障碍, 血管内皮细胞变性、凋亡、坏死脱落, 影响炎症细胞(主要为单核—巨噬细胞等)粘附及迁出血管, 使局部生长因子浓度降低。受照射后皮肤(溃疡)局部的成纤维细胞、血管内皮细胞等合成、分泌VEGF的功能也会受到影响。为示区别, 同时作了免疫组化和原位杂交, 证实辐射损伤的皮肤组织细胞合成分泌VEGF的功能在溃疡形成前被电离辐射轻度激活, 但在溃疡形成后在辐射和伤口的双重刺激下明显低于单纯伤口组, 不能形成高峰值, 是溃疡形成、发展及难愈合的原因之一。
| [1] |
赵坡, 王德文, 高亚兵, 等. 人放射性皮肤溃疡MDM2, P53蛋白高表达研究[J]. 中华放射医学与防护杂志, 1996, 16(4): 223-225. |
| [2] |
谷庆阳, 曹卫红, 王德文, 等. P53, Bax, Bcl-2蛋白表达及细胞凋亡在急性放射性皮肤溃疡发生发展过程中的作用探讨[J]. 军事医学科学院院刊, 2001, 25(2): 103-106. DOI:10.3969/j.issn.1674-9960.2001.02.007 |
| [3] |
谷庆阳, 曹卫红, 王德文, 等. 辐射诱导难愈性皮肤溃疡组织中多种凋亡相关基因的表达[J]. 现代康复, 2001, 5(6): 50-51. DOI:10.3321/j.issn:1673-8225.2001.06.025 |
| [4] |
Gu QY, Wang DW, Cui CB, et al. Effects of radiation on wound healing[J]. JEPTO, 1998, 17(2): 117-123. |
| [5] |
谷庆阳, 高亚兵, 崔彩彬, 等. 大鼠放射复合伤口愈合特点的病理研究[J]. 军事医学科学院院刊, 2000, 24(1): 40-43. DOI:10.3969/j.issn.1674-9960.2000.01.012 |
| [6] |
Nakamura Y, Hasegawa M, Hayakawa K, et al. Induction of P53-dependent apoptosis in vivo by nedaplatin and ionizing radiation[J]. Oncol Rep, 2000, 7(2): 261-265. |
| [7] |
Langley RE, Bump EA, Quartuccio SG, et al. Radiation-induced apoptosis in microvascular endotheliocytes[J]. Br J Cancer, 1997, 75(5): 666-672. DOI:10.1038/bjc.1997.119 |


