2. 浙江大学医学院
细胞程序性死亡(Apoptosis,Programmed Cell Death,PCD)是细胞的不同于坏死的另一种死亡方式,其特点为细胞发生核固缩、核碎裂和凋亡小体形成。PCD受诸多因素调控,P53是重要因素之一,其主要作用机制为触发异常细胞的凋亡过程[1, 2]。曾有学者报道高剂量X射线照射可诱发细胞P53基因发生突变[3]。本文旨在经介入放射检查及治疗病人的X射线常剂量来处理人外周血细胞,考察细胞的P53基因变异以及细胞凋亡状况,探索评价其工作中该剂量的安全性。
1 材料与方法 1.1 细胞血细胞取自5位健康志愿者外周血,经淋巴细胞分离液密度梯度离心(400g×30 min)分离单核淋巴细胞,以Hank’s液洗涤离心2次,细胞再悬于RPMI 1640细胞培养液[含15%小牛血清、2 mmol·L-1L-谷氨酰胺、1.5 mg·L-1PHA(sigma)、10万U·L-1青霉素和100mg·L-1链霉素]。细胞浓度调节为1×106个ml-1。在X射线处理前,细胞经37℃孵育30 min。
1.2 仪器用日本岛津RS-100型800 mA X射线机进行照射,管电压85kV,电流1.6mA,X射线焦点与标本距离为82 cm即焦皮距82 cm),用英国NE公司制造的法玛剂量仪2571型进行受照剂量监测,结果为1.1 cGy·min-1。
1.3 X射线处理样本共分7组,X射线照射剂量分别为200, 100, 50, 20, 10至5 cGy,以及空白对照。血细胞经X射线处理后,置37℃培养至96h。
1.4 细胞DNA提取血细胞DNA的提取采用蛋白酶K消化,常规酚/氯仿抽提法抽提,乙醇沉淀后溶于TE缓冲液备用。
1.5 CR-SSCP银染技术检测P53基因5~9外显子突变按Matozaki等[4]提供方法,以PCR扩增P53基因的5~9外显子,引物由中国科学院上海细胞研宄所合成。取PCR扩增产物5μl与20μl 4×变性载样缓冲液(含95℃甲酰胺)混匀,95℃变性5min后置冰浴。PAGE采用6%聚丙烯酰胺凝胶(含5%甘油),电泳后作银染色。
1.6 PCR-RFLP技术检测P53基因249位密码子突变上述PCR扩增产物10μl加Hae Ⅲ 10 U37℃酶切12 h,取酶产物作8% PAGE银染色,该PCR扩增产物有一Hae Ⅲ酶切位点,若249密码子未发生突变则产生39 bp和78bp两个片段。若249密码子有突变,则该酶切位点消失。
1.7 P53蛋白的免疫组化染色血细胞经96 h培养作涂片,甲醇固定,以3%过氧化氢封闭阻断,滴加抗P53蛋白单克隆抗体(D0-1,DAK0公司)50μl·片-1,37℃孵育90 min后作SABC染色,DAB显色10 min,经苏木素复染,脱水,透明封片,显微镜下观察。
1.8 细胞凋亡的原位末端标记细胞凋亡的检测,采用DNA末端转移酶介导的Bio-dUTP末端标记技术(Terminad De-oxynucleotidyl Transferase-Mediated dUTP-biotin Nick End Label-ing,TUNEL),主要方法为:细胞涂片经甲醇固定,50μg·ml-1蛋白酶K37℃消化15min,3%甲醇过氧化氢封闭,水洗后,滴加末端标记反应液50μl·片-1,反应介质为:TDT缓冲液含100 mmol·L-1 potassium Cacodylate, 2 mmol·L-1 Cobalt Chloride, 0.2 mmol·L1 dithiothteitol,pH7.2),0.3 U·ul-1TdT (Promage公司)和0.04 nmol·-111-Bio-dUTP(华美公司)。经37℃标记90min后以0.02 mol·L-1PBS中止和漂洗3次后作SABC染色(同上),DAB显色后,4%甲基绿复杂15 s,漂洗后脱水,透明封片,置显微镜下观察,每张片子取左、右、上、下、中5个不同部位,计数2 000个细胞,计算出细胞凋亡指数。
1.9 统计分析实验数据的统计分析采用SPSS统计分析软件包处理。
2 结果 2.1 X射线处理对血细胞活性的影响血细胞经不同剂量的X射线照射后,以苔盼蓝染色计数细胞存活率(见图 1)。
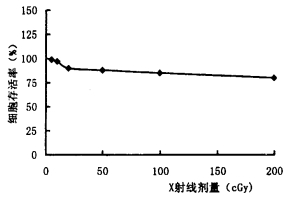
|
图 1 细胞存活率 |
血细胞以TUNEL技术测定细胞凋亡率,结果发现,未加X射线处理的血细胞自发细胞凋亡发生频率为(0.3±0.1)%, 且随着培养时间的延长而增长,至96 h, 凋亡频率约为(11.8±1.2)%, 而经不同的剂量的X射线照射24 h后,细胞凋亡频率与X射线剂量呈明显的剂量依赖关系(见图 2)。结果显示,X射线剂量>50 cGy在48 h后,细胞凋亡率与对照差异明显(P < 0.01)。20cGy在72h后与对照差异有显著性(P < 0.01)而5~10 cGy则与对照差异无显著性(P > 0.05)。
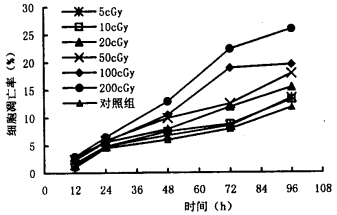
|
图 2 经不同剂量X射线处理后血细胞的细胞凋亡率 |
血细胞经不同剂量的X射线处理、培养96 h后,作细胞涂片,P53蛋白的免疫组化染色结果各剂量组均未检测到异常表达的P53蛋白。
2.4 血细胞的P53基因5;9外显子的PCR-SSCP分析血细胞经X射线处理,培养96 h后,取细胞DNA, 作PCR扩增,扩增产物经SSCP-银染分析。结果P53基因5~9外显子未出现单链DNA泳动变位(mobility Shift), 经0~200 cGy剂量X射线处理后P53基因的5~9外显子未出现明显的突变。
2.5 血细胞的P53基因249位点的PCR-RFLP分析为进一步观察血细胞P53基因的突变,以PCR-RFLP技术检测249密码子的突变,结果所有标本的P53基因249位密码子Hae Ⅲ酶切位点均未丢失,表明在0~200 cGy的X射线处理后血细胞未出现P53基因249密码子的急性突变。
3 讨论医疗照射是人工电离辐射的主要来源,介入放射是医疗照射的重要组成部分,此法X射线曝光量大,曝光时间长,介入放射是否造成对P53抑癌基因的影响,目前这方面的报道甚少。
X射线对人体细胞的影响是多方面的,主要危害之一为诱导细胞转化,而促使细胞转化有诸多因素,其中最主要为P53基因的异常, 正常的P53基因产物通过诱导细胞程序性死亡,清除异常细胞,维护机体平衡,1993年Krolewski和John[3]等学者报道经X射线诱导转化的体细胞存在有P53基因异常,认为X射线通过促使P53基因突变导致细胞转化。为考察X射线对人体细胞的影响,选用常用临床剂量5~100 cGy以及较高剂量200 cGy对人外周围血淋巴细胞的P53基因、P53蛋白的表达以及细胞凋亡的影响,以期探讨临床介入放射的安全性。
P53基因在X射线诱导细胞转化中的作用,由于实验方法的不同所得结果有所差异,Krolewski等米用每天600 cGy连续6周的处理结果诱导成3株转化细胞,进一步分析3株细胞的P53基因,蛋白以及细胞凋亡,认为X射线诱导转化细胞的成功,主要是通过X线诱使P53基因突变而导致细胞的转化,而Yanagish[6]等通过野生型P53基因传染细胞后以X射线诱导,结果发现通过野生型P53基因的转染能明显降低细胞转化和突变,认为野生型P53蛋白修复经X射线损伤的细胞基因,维持细胞基因的稳定性。
本文利用介入放射常用剂量的X射线处理人外周血淋巴细胞,经培养96 h以PCR-SSCP技术测定细胞P53基因的5;9外显子变异,结果均未出现单链DNA的异常泳动,同时通过PCR-RFLP亦未发现P53基因突变热点249位密码子的突变。此外通过免疫组化染色,未检出P53蛋白的异常表达,实验过程中所设阳性对照均可检出P53基因和蛋白异常,实验结果表明我们所用的剂量的X射线处理血细胞以P53基因和蛋白为指标均无明显影响,细胞均为正常。表明5~200 cGy剂量的X射线,单剂量照射诱导细胞转化的可能性极小。
血细胞对X射线较为敏感, 经不同剂量的X射线处理后,细胞活性受到一定影响,且细胞存活率与X射线照射剂量有密切关系(见图 1)而细胞凋亡是细胞对X射线的正常反应,实验结果表明X射线处理后的细胞凋亡发生频率与X射线剂量相关,尤其在X射线处理48 h后X射线剂量> 50 cGy组细胞凋亡率与空白对照组差异明显。在72 h后20 cGy组与对照组的差异亦显著(P < 0.01)而剂量 < 10 cGy组差异则不显著,对照X射线处理后的细胞存活率,两者相关。实验结果与Boreharn结果相似[5, 8]。结果表明临床常用剂量的X射线处理外周血淋巴细胞通过细胞凋亡清除损伤细胞,维持机体平衡。外周血淋巴细胞的细胞凋亡对X射线较为敏感,可作为人体反映X射线剂量的生物学指标和模型之一。
| [1] |
Russell JH, Wang R. Autoimmune gld mutation uncouples suicide and cytokine/proliferation pathways in activated, mature T cell[J]. Eur J immunol, 1993, 23(9): 2379-2382. DOI:10.1002/(ISSN)1521-4141 |
| [2] |
Lowe SW, Ruley HE. Stabilization of the P53 tumor suppressor is induced by adenovirus EIA and accompanies apoptosis[J]. Genes Dev, 1993, 7(4): 535-545. DOI:10.1101/gad.7.4.535 |
| [3] |
Krolewski B, Little JB. Application of denaturing gradient gel bolts to detect P53mutation in X-ray transformed mouse C3H 10T1/2 clones[J]. Mol Carcinog, 1993(3): 190-196. |
| [4] |
Matozaki T, Sakamoto C, Matsuda K., et al. Missense mutations and a deletion of the P53 gene in human gastric cancer[J]. Biochem Biophys Res Commun, 1992, 182(1): 215-223. DOI:10.1016/S0006-291X(05)80133-0 |
| [5] |
Boreham DR, Gale KL, Maves SR., et al. Radiation-induced apoptosis in human lymphocytes: potential as a biological dosimeter[J]. Health Phys, 1996, 71(5): 685-691. DOI:10.1097/00004032-199611000-00007 |
| [6] |
Yamagishi N, Miyakoshi J, Tatebe H. Decrease in the frequency of X-ray induced mutation by wild type P53 protein in human osteoscarcoma cells[J]. Carcinogenesis, 1997, 18(4): 695-700. DOI:10.1093/carcin/18.4.695 |
| [7] |
Radojcic M, Crompton NE. Age dependence oft-lymphocyte apoptosis induced by high-energy proton exposure[J]. Ra-diat Environ Biophys, 2001, 40(2): 131-135. DOI:10.1007/s004110100093 |
| [8] |
Boreham DR, Dolling JA, Maves SR, et al. Dose rate effects for apoptosis and micronucleus formation in gamma irradiated human lymphocytes[J]. Radiat Res, 2000, 153(5 ptl): 579-586. |


