近几年发展起来的体细胞基因位点突变检测技术, 为受照人员吸收剂量的估算开辟了新的途径。国内外均已有这方面的研究报道。应用于突变检测的基因主要有, 血型糖蛋白A (glycoprotein A, GPA)基因[1]、T细胞受体基因[2]、次黄嘌呤磷酸核糖基转移酶[3]等。除GPA基因外, 其余基因对细胞的生存均有重要作用, 一旦发生突变, 即会引起细胞衰亡, 因此突变存在时间短, 不利于吸收剂量的远期估算[4]。血型糖蛋白A是分布在人体红细胞膜表面上的一种富含唾液酸的蛋白质, 其主要生物学功能是决定MNSs血型。GPA基因发生突变后, 仅引起细胞MNSs血型抗原的改变, 不影响细胞的生理功能, 因此这种突变是可以延续的, 并且能随细胞分裂而遗传给子细胞; 如果突变发生在造血干细胞, 则可持续于人的一生中, 许多年以后仍可检测到这种突变[5]。基于此, 血型糖蛋白A基因位点突变分析法在辐射生物剂量诊断的研究中具有明显的优越性。
1 材料与方法 1.1 细胞株人红白血病细胞株K562, 引自中科院上海细胞所, 其生物学特性是细胞较大(直径20 μm)基本上为3倍体, ph'染色体阳性, 有多能干细胞特性。K562细胞培养于含10%小牛血清的RPMI-1640培养液中。培养条件为, 37℃、100%湿度、5%CO2。取对数生长期的细胞配成1×106/ml细胞悬液, 分装7瓶, 30 ml/瓶。培养瓶厚度为3.5 cm, 培养面积为6 cm×8 cm。
1.2 照射条件取上述细胞, 用60Coγ射线点源照射, 培养瓶中心点距点源100 cm; 每瓶1组, 照射剂量分别为:0, 0.25, 0.50, 1.00, 2.00, 4.00, 6.00Gy。照射后无菌操作将30 ml/瓶分为10 ml/瓶, 分组编号, 其中染色体畸变分析组加秋水仙素, 置于培养箱中培养4h, 培养条件同上。
1.3 染色体畸变分析染色体标本制备采用本实验室建立的方法[6]; 每份样本分析染色体数目为60±5的中期分裂细胞400个, 记录各类畸变。
1.4 总DNA制备培养细胞离心收集后, 用PBS洗涤; 加细胞裂解液, 于55℃水浴14h;用酚、氯仿去除蛋白后加1倍体积异丙醇, 室温放置10min; 离心取沉淀溶于TE中, 4℃保存备用。
1.5 PCR、aPCR技术常规PCR技术, 于PCR仪中自动扩增; 条件为(92℃、40 s+60℃、40 s+70℃、60 s)×35;aPCR, 条件同前, 引物比为:100:1。
1.6 PAGE, SSCP及银染技术PCR产物加变性剂, 于42℃保温5min; 走含5%甘油的中性胶, 电场强度为15 V/cm, 时间为3~5h;经含10%乙醇0.5%冰乙酸的溶液固定后, 以含0.1%硝酸银、0.056%甲醛的溶液染色; 再用含1.5%氢氧化钠、0.4%甲醛的溶液显色; 以0.75%碳酸钠溶液停显, 干燥保存。
1.7 影像分析采用CS-900双波长飞点扫描仪, ABS透射方式, Zig-Zag形扫描, 自动测定650nm处吸收曲线和相对面积。
2 结果 2.1 照射诱发GPA基因随机突变

|
图 1 GPA基因及其5'和3'端, 引物P1和P2 |
用引物P1、P2扩增出的GPA基因第3外显子区域, 在经aPCR、SSCP以及银染处理后, 得到其基因突变电泳图谱。对电泳图谱进行仔细分析发现, 无论是低剂量还是高剂量电离辐射, 均能诱发出大量突变, 且无明显的共有突变条带。实验表明, 辐射引起的GPA基因第3外显子的突变可能是随机的, 即无突变热点。
2.2 GPA基因突变与照射剂量正相关在GPA基因的第三外显子上有一个SacI内切酶位点(图 1)。SacI能识别6个碱基, 其顺序是5'TCATGA3', 可以将GPA基因第三外显子切成两个片段; 一旦该外显子任一碱基发生突变, 则不能进行酶切。细胞受到辐射后, DNA发生突变, 突变情况可依据SacI酶切程度来判断。
应用PCR技术扩增GPA基因第三外显子区域, 经SacI酶切, 走PAGE, 银染后, 置于CS-900双波长飞点扫描仪进行扫描分析, 计算扫描面积。数据分析显示, 随着照射剂量的增加, DN A的突变率也在增加, 切合直线回归方程Y=AX+B, 即Y =5.0881X+36.4613。其中相关系数r=0.9382, P<0.01, 表明照射剂量与基因突变呈正相关。数据列表 1。
|
|
表 1 辐射与DNA突变 |
显微镜镜检染色体畸变情况, 包括双十环、无着丝粒断片、染色单体断片等, 数据列于表 2。统计学分析表明照射剂量与染色体畸变呈正相关。畸变细胞的直线回归方程为Y=11.0882X+9.2996, 相关系数r=0.9317, P<0.01。
|
|
表 2 照射剂量与染色体畸变率 |
GPA基因突变用于检测受照剂量的研究, 最早由美国Lowrence Livermore研究所进行[8]。检测原理是特异单克隆抗体与不同表型的红细胞结合诱发不同荧光, 经流式细胞仪检测、分类统计, 指标是GPA基因突变引起的变异红细胞比率。该方法已在前苏联切尔诺贝利核事故[1]、巴西戈亚尼亚辐射事故[9]以及日本原爆幸存者某些受照人员[8]剂量估算中取得了较好的应用检验并获得良好的结果。该检测方法的优点是:灵敏、快速、稳定性好, 由于GPA突变发生在骨髓干细胞, 变异表现为红细胞膜抗原结构异常, 突变表达持久, 可终身不变, 尤其可适用于慢性低剂量照射引起的突变; 缺点是仅能检测MN型杂合个体, 即约人群的50%, 而且由于GPA完全在红细胞上表达需要4个月, 因此, 难以在照射后短时间内作为生物剂量计判断受照人员的剂量。况且流式细胞仪价格昂贵、特异单克隆抗体制备技术复杂, 因而不利于推广。
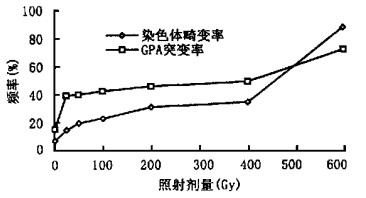
聚合酶链式反应技术(PCR)的发展, 为从分子水平上估算照射剂量带来了可能。从理论上讲, 分子水平上的估算更为准确和灵敏, 而且对所有人群都适用。据Kudo等人报道, 他们获得了K562细胞株血型糖蛋白的cDNAs, 利用cDNA序列, 部分地分析了基因组结构, 通过Southern杂交分析, 显示K562细胞的GPA具有与正常人白细胞GPA相同的结构, 而且这些cDNA核苷酸序列和来自正常人网织红细胞的核苷酸序列也是一致的[10]。因此我们选择了K562细胞, 利用PCR等分子生物学技术, 通过分析GPA基因第3外显子SacI内切酶位点的方法, 检测GPA基因突变率与受照剂量之间的关系。此方法的建立, 可取材于外周血细胞中的总DNA, 克服了红细胞中不含DNA而不能进行基因型分析之缺陷。本项研究证明应用基因位点突变分析技术检测照射剂量与基因突变的关系, 取得了较好的结果。照射能诱发GPA基因随机突变, 且照射剂量与突变率有一定的对应关系。为确认照射剂量与基因突变之正相关的可信度, 我们同时在同样的条件下分析了基因突变率和染色体畸变率, 发现二者均与照射剂量呈直线关系, 且相关性非常好(图 2), 相关系数r=0.9975, P<0.01。
|
图 2 照射引起的基因突变率和染色体畸变率的比较 |
从图中我们也可以看出, 在低剂量照射(0.00~4.00 Gy)时, 无论是染色体畸变率或者GPA基因突变率与照射剂量均表现出一种线性关系; 但当照射剂量大于4.00 Gy时, 染色体畸变率或者GPA基因突变率均明显上升, 表明大剂量照射对细胞的影响尤为显著, 这可能是由于高剂量电离辐射引起多基因突变的缘故[11]; 同时也注意到, 大剂量照射对基因造成的突变率的斜率较小, 提示在受到大剂量照射时, 以基因突变率来估算受照剂量可能比以染色体突变率估算更为可信。另一方面, 染色体畸变率比GPA基因突变率要低, 这可能是因为, 电离辐射引起的许多突变, 并不表现在染色体上, 换句话说, 染色体仅能反映其本身可见的那部分损伤[12]。因此, 分析GPA基因突变可揭示染色体畸变所不能揭示的规律, 依据其建立的生物剂量计更适用于受照人员的剂量监测和估算, 为及时正确的医学干预、保障放射工作者的身体健康提供科学依据。
| [1] |
Jensen RH, Langlois RG, Bigbee WL, et al. Elevated fraquency of glycophorin a mutations in erythrocytes from chernobyl accident victims[J]. Radiation Res, 1995, 141: 129. |
| [2] |
李进. 辐射生物剂量计[J]. 国外医学放射医学核医学分册, 1995, 19: 276. |
| [3] |
Albertini RJ, Nicklas JA, O'Neill JP. Somatic cell mutations in humans: biomarkers for genotoxicity[J]. Environ. Health, 1993, 100(supp13): 193. |
| [4] |
Staume T, Lucas JN, Tucker JD, et al. Biodosimetry for a radiation worker using mutiple assays[J]. Health Physics, 1992, 62: 122. |
| [5] |
陈振军, 王继发. GPA基因突变分析技术及其应用[J]. 国外医学放射医学核医学分册, 1995, 19: 132. |
| [6] |
朱炳钗. 60Coγ线低剂量率照射狗染色体畸变的观察[J]. 辐射研究与辐射工艺学报, 1986, 4(2): 37. |
| [7] |
Sibert PD, Fukuda M. Isolation and characterization of human gly cophorin A cDNA clones by a synthetic oligonucleotide approch: nucleotide sequence and mRNA structure[J]. Proc. Natl. Acad. Sci. USA, 1986, 83: 1665. DOI:10.1073/pnas.83.6.1665 |
| [8] |
Langlois RG, Bigbee WL, Jensen RH. Evidence for increased somatic cell mutations at the glycophorin A locus in atomic bomb survivors[J]. Science, 1987, 236: 445. DOI:10.1126/science.3563520 |
| [9] |
Straume T, langlois RG, Lucas J, et al. Novel biodosimetry methods applied to victims of the Goiania accident[J]. Chromosome Analysis, 1991, 60: 71. |
| [10] |
Kudo S, Fukuda M. Structural organization of gly cophorin A and B genes: Glycophorin B gene evolved by homologous recombination at Alu repeat sequences[J]. Proc Natl Acad Sci USA, 1989, 86: 4619. |
| [11] |
David MDM. Molecular characterization of HPRT -deficient mutants induced by γ-rays or αparticles showing that the majority have delations of al1 or part of the HPRT gene[J]. Mutation Res, 1989, 220: 11. DOI:10.1016/0165-1110(89)90006-7 |
| [12] |
Muir P. Karyotypic abnormality of the X chromosome is rare in mutant HPRT lymphocyte clones[J]. Mutation Res, 1988, 197: 157. |




