机体摄入高剂量或中等剂量的放射性核素显然是有害的, 无论从整体水平、细胞水平还是亚细胞水平都表现出明显的损伤效应〔1〕。但是, 在低剂量的放射性核素影响下, 是否可产生与高剂量作用时明显不同的效应?单纯的低剂量外照射, 可促进生长发育, 以及免疫增强的刺激效应〔2〕, 但迄今关于单纯的低剂量核素内照射是否可诱发刺激效应, 文献中尚未见报道, 因此有必要加以研究阐明。本文探讨了有可能在核电站环境中低剂量释出而被人体摄入的具有高传能线密度(LET) 〔3〕的α辐射体放射性核素235U对脾淋巴细胞DNA合成和UDS的刺激效应。
2 实验材料及方法 2.1 实验材料浓缩铀235UO2F2原液浓度为60g/L, 其中235U的丰度为18.9 %。丝裂原PHA由上海医学化检所提供。LPS为Sigma产品。3H-TdR为上海原子核研究所生产, 基比活度为37GBq/L。
2.2 细胞培养脾脏T和B淋巴细胞用RPMI 1640全培养液(GIBCO), 即在RPMI 1640培养液中增补20mmol/L Hepes, 2mmol/L谷氨酰胺, 3.6g/L葡萄糖, 2g/L碳酸氢钠, 5 ×10-5mol/L 2-ME, 100U/ml青霉素, 100μg/ ml链霉素, 以及10 %灭活小牛血清。
2.3 实验动物及摄入浓缩铀235U剂量实验用纯品系雄性BALB/c小白鼠, 鼠龄为7 ~ 8周, 体重21 ±2g, 由苏州医学院实验动物中心供应。取含235U的浓缩铀原液, 稀释成工作液, 由小白鼠尾静脉注入, 其观察剂量分别为0.001, 0.01, 0.1, 1, 100和500μg/kg, 平行对照动物则注入生理盐水。
2.4 方法 2.4.1 检测脾脏T和B淋巴细胞DNA合成在静脉注入不同剂量的235U 5d后, 各组动物由颈动脉放血处死, 立即无菌操作摘取脾脏, 置RPMI 1640培养液中, 用眼科弯镊轻轻梳刮脾脏制成单细胞悬液, 随即2000r/min离心100min, 弃上清液收获细胞用RPMI 1640液清洗后, 重新悬浮于RPMI 1640培养液中调整细胞浓度为2 ×106cells/ml。取无菌96孔平底培养板, 每孔加入细胞悬液100μl, 以及PHA(200μg/ ml)或LPS(40μg/ml)各100μl, 每份样品设自身对照, 三复孔培养于37 ℃、50ml/L CO2培养器内培养72小时, 在终止培养前16小时, 每孔加入3H-TdR 18.5kBq.终止培养后, 用多头细胞样品收集器收获细胞于玻璃纤维滤膜上, 50 ℃干燥后, 置于含0.6 %PPO和0.06 %POPOP的二甲苯闪烁液5ml的测量杯中, 其放射性活度用Beckman液体闪烁计数装置LS 6800进行测定, 结果以实验组对照组的Bq/min·106cells的放射性活度表示, 求出刺激指数, 阐明其DNA合成能力的变化。
2.4.2 检测脾脏淋巴细胞紫外线诱导的UDS各组小白鼠在静脉注入235U后12d时, 由颈动脉放血处死, 无菌取脾, 置于RPMI 1640培养液中制成单细胞悬液, 移入离心管中2000r/min离心100min, 弃上清。收获细胞用含10-2mol羟基脲的RPMI 1640全培养液调整细胞浓度为1 ×107cells/ml。应用无菌24孔平底培养板, 每孔加入已调整好的细胞悬液100μl, 每一样品设5只重复孔, 一式两块培养板, 放入37 ℃、50ml/L CO2培养器中预培养30min; 随后每孔加入37kBq 3H-TdR。在每一样品的第3 ~ 4孔中分别加入200μg/ml的PHA 100μl。将其中一块培养板置于无菌超净工作台中央, 紫外线光源用15W紫外线灯, 距离40cm处照射5min, 紫外线剂量为20J/m2。然后将两块24孔培养板放入37 ℃、50ml/L CO2培养器内培养2h。培养结束后立即用多头细胞样品收集器收获细胞于玻璃纤维滤膜上, 待滤膜样品干燥后。置于含5ml闪烁液(由0.6 %PPO和0.06 %POPOP二甲苯液组成)测量杯中, 用Beckman LS 6800液体闪烁计数器测量放射性活度, 以Bq/min·107cells及刺激指数表示。UV诱导的UDS结果以紫外线照射的淋巴细胞3H- TdR掺入的放射性活度减去未经紫外线照射的淋巴细胞3H-TdR掺入的放射性活度的差值表示。
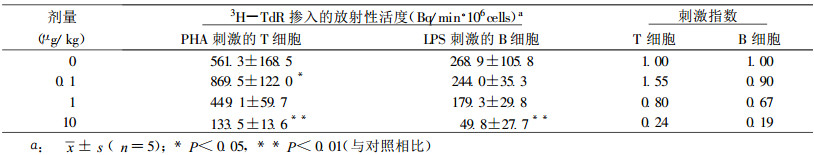
3 实验结果 3.1 浓缩铀235U对脾淋巴细胞DNA合成的刺激效应通过微量细胞培养3H-TdR掺入实验, 观察到浓缩铀235U在机体摄入剂量为0.1μg/kg体重时, 可使PHA反应性T淋巴细胞的3H-TdR掺入量呈显著增升, 刺激指数值明显加大, 呈现出235U对T淋巴细胞的刺激效应, 见表 1。
|
|
表 1 浓缩铀235U在不同水平摄入机体时对脾T和B淋巴细胞DNA合成能力的影响 |
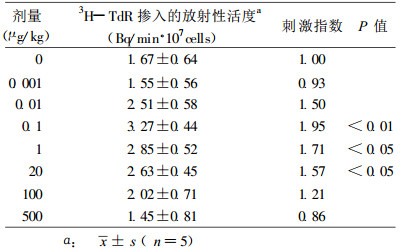
不同剂量浓缩铀235U对脾淋巴细胞UV诱导UDS的影响见表 2。观察到在机体内污染0.1 ~ 20μg/kg体重范围的低水平浓缩铀235U作用下, 可使脾脏淋巴细胞的3H-TdR掺入率呈明显增升, 表明浓缩铀在低剂量摄入时, 可使脾脏淋巴细胞UV诱导的UDS值明显增高, 刺激指数显著升值, 呈现出对脾脏淋巴细胞DNA切除修复功能有明显的刺激作用。
|
|
表 2 浓缩铀235U在不同水平摄入机体时对脾淋巴细胞UV诱导UDS能力的影响 |
不同剂量浓缩铀235U对未经UV照射的脾淋巴细胞UDS的影响见表 3。结果显示, 浓缩铀235U各作用组脾淋巴细胞UDS值均明显高于对照组, 经统计学处理有显著和非常显著的差异。表明浓缩铀235U内污染12d后, 对脾淋巴细胞DNA仍具有持续作用, 继而诱发脾淋巴细胞的DNA切除修复能力的增强。
|
|
表 3 浓缩铀235U在不同水平摄入机体时诱发脾淋巴细胞UDS能力的增强作用 |
环境中的各种辐射因素以及许多化学物质所致DNA损伤所诱发致癌[7, 8], 致畸[9, 10]和致突变[11, 12]作用是非常敏感的。我们已经观察到浓缩铀235UO2F2摄入机体后, 可引起DNA单链和双链的断裂。DNA是电离辐射的重要靶分子, 而生物细胞具有高效切除修复DNA损伤的能力, 这些细胞包括已增殖的哺乳动物细胞, 未分裂的肝细胞, 小脑细胞和各种淋巴细胞。DNA切除修复与细胞周期无关, 称非程度DNA合成(UDS)。这种切除修复不受DNA复制合成抑制剂羟基脲的影响。
过去的大量研究工作都集中在高剂量对机体诱发的辐射效应方面, 而观察低剂量辐射效应的研究都局限在外照射方面, 并且证实了低剂量外照射对生物机体呈现有益的刺激效应。但对低剂量核素内照射所诱发的刺激效应未见报道。为此, 本文研究了低剂量浓缩铀235U内照射诱发脾脏淋巴细胞DNA合成和UDS的刺激效应, 发现低剂量浓缩铀235U摄入机体后, 可诱发脾脏淋巴细胞DNA合成能力的增强和对DNA非程序合成具有明显的刺激作用, 从而反映了对DNA修复能力的增强。已经观察到当机体预先暴露于低剂量辐射后, 可对随后的高剂量X射线诱发的染色单体断裂损伤效应变得不敏感, 可呈现一定程度的保护作用, 产生适应性反应。这些结果表明无论低剂量的内照射或外照射, 都可以导致DNA合成及其修复能力的增加。
| [1] |
朱寿彭, 李章. 放射毒理学[M]. 北京: 原子能出版社, 1992: 89-99.
|
| [2] |
Luckey TD. Physiological benifits from low level of ionizing radiation[J]. Health Phys, 1982, 43: 771-778. DOI:10.1097/00004032-198212000-00001 |
| [3] |
Liu SZ. Radiaton hormesis: its expression in the immune system[J]. Health Phys, 1987, 52: 517-520. |
| [4] |
朱寿彭. 浓缩铀的放射毒理[M]. 北京: 原子能出版社, 1998: 145-148.
|
| [5] |
Zhu SP, Lai GH, Wang LY. Radioimmunotoxicological effect of enriched uranium on central and penipheral immune cells and the protective action of IL-1 and IL-2[J]. Nucl Sci Tech, 1994, 5: 93-99. |
| [6] |
Evans RG, Norman A. Unscheduled incorporation of thymidine in ultraviolet irradiated human lymphocytes[J]. Radiat Res, 1968, 36: 287-298. DOI:10.2307/3572653 |
| [7] |
Sega GA, Sotomayer RE, Inide Serres FJ, et al. Chemical. mutagens[M]. New York: Plenum Press, 1982: 421-429.
|
| [8] |
Boice JD. Radiation carcinogenesis[M]. New York: Raven Press, 1984: 285-298.
|
| [9] |
Zhu SP. Correlation between induced embryo toxicity and absorption dose of enriched uranium in testes[J]. Nucl Sci Tech, 1996, 7: 173-176. |
| [10] |
Von Somntag C. The chemical basia of radiation biology[M]. London: Taylor and Francis, 1987: 271-273.
|
| [11] |
Hu QY, Zhu SP. Induction of chromosomal aberrations in male mouse germ cells by uranyl fluoride containing enriched uranium[J]. Mutat Res, 1990, 244: 209-214. DOI:10.1016/0165-7992(90)90130-C |
| [12] |
Cattanach BM, Rasberry C. Genetic effects of combined chemical-x-ray treatments in male mouse germ cells[J]. Int J Radiat Biol, 1987, 51: 985-988. |
| [13] |
Zhu SP, Hu QY, Cao GF, et al. Induction of mutagenic effect in somatic and germ cells by enriched uranium[J]. Nucl Sci Tech, 1993, 4: 19-27. |