生物剂量计是根据电离辐射引起的一系列生物效应, 估算个人受照剂量的技术方法。它能为采取正确的医学预防和治疗措施提供可靠数据。目前较为成熟的生物剂量计是染色体畸变分析[1]。但染色体仅能反映细胞水平的损伤, 故其畸变率比基因突变率要低。因此, 为提高剂量估算的准确性而开展基因水平的生物剂量检测很有必要。
随着分子生物学理论与技术的飞速发展。基因水平的突变检测技术为受照人员吸收剂量的估算开辟了新的途径。尤其是体细胞基因位点突变分析技术(somatic gene mutation assay)在辐射生物剂量学研究中的成功应用, 已建立了几种较好的生物剂量分析方法[2~5]。应用于突变检测的基因主要有, 人类白细胞抗原(human leucocyte antigen, HLA)基因, 次黄嘌呤-磷酸核糖转移酶(hypoxanthine phosphoribosyl transferase, HPRT)基因, T细胞受体(T-cell receptor, TCR)基因, 血型糖蛋白A(glycophorin A, GPA)基因等。
1 体细胞基因突变及突变分析方法电离辐射作用于人体, 经最早期的原初反应后, 导致生物分子损伤, 进而表现为细胞损伤, 再出现各种临床症状。通常用于剂量效应分析的是造血细胞的基因突变, 因为其具有普遍性、稳定性、灵敏度高、时效量效关系都比较好等特点。
单就造血细胞来说, 辐射损伤大致可分为3步:
① 损伤最早发生在造血干/祖细胞或某些前体细胞的DNA上, 如碱基的转换、颠换、移码以及基因片断的缺失、易位、插入、重排等, 造成基因突变。
② 基因突变影响基因的正常表达, 使基因表达产物即蛋白质发生量和质的改变, 甚至有些基因失去表达能力, 而另一些不应表达的基因却产生大量蛋白。③蛋白表达量的增减、蛋白功能的改变最终影响到表型的改变, 严重的导致机体发生病变, 如器官功能紊乱、丧失或癌变等, 最终导致死亡。
近年来已发展了多种基因突变分析方法, 但总的来说可以分为两种。一种是从细胞水平上间接检测基因突变频率(mutation frequence, MF), 实际上是检测基因表达产物及其生物学特性的变化。主要有细胞克隆法, 多核细胞法、放射自显影法等。另一种方法是从分子水平上直接检测基因的突变频率, 所用方法主要有聚合酶链式反应(PCR)、核苷酸序列测定、单链构象多态性分析(SSCP)和限制性片段多态性分析等(RFLP)。辐射诱导的淋巴细胞凋亡(apoptasis)率的测定, 可能会成为另一种潜在的生物剂量计[6, 7]。
2 依赖HLA-A基因突变的生物剂量分析方法HLA, 即人类的白细胞抗原, 具高度多态性。其中, HLA-A位于6p21.3, 长约5kb, 是一个重要的细胞表面抗原, 在大多数有核细胞中都表达。
1988年, Janatipour等首先建立了依赖补体的细胞毒性筛选法[2, 8], 即克隆法。HLA-A在人群中, 存在有20多个共显性等位基因。在澳大利亚, HLA -A2和HLA-A3所占比例最大。筛选A2A3杂合个体, 分离其淋巴细胞加入单克隆抗体抗HLA-A2或抗HLA-A3, 和含补体的兔血清。稀释后接种于96孔板培养。只有HLA-A2或HLA-A3发生突变的淋巴细胞才能生长, 形成克隆。克隆经标准NIH (淋巴细胞毒试验)血清法对HLA分型, 确定其为HLA-A2或HLA-A3。HLA的突变检测在对100kVpX射线照射时的效应关系基本没有阈值, 与1Gy的倍增剂量有较好的线性关系。
Kushiro[9]等利用流式细胞法, 检测HLA-A2和HLA-A24杂合体(约占日本人的60%)。用藻红蛋白标记抗HLA-A2或HLA-A24单克隆抗体, 异硫氰基荧光素标记抗CD3抗体。使之表现出不同荧光。经流式细胞仪检测, 计算突变频率。研究结果表明, HLA基因位点突变与辐射有较好的相关性。Kushiro[7]等还检测了168例原爆幸存者HLA突变情况, 结果无统计学意义。可能是由于HLA的重要性, HLA突变细胞被逐渐淘汰。提示, HLA基因位点突变分析法不适于受照远后期剂量的估算, 即不宜用作终生生物剂量计。
3 依赖HPRT基因突变的生物剂量分析方法HPRT, 即次黄嘌呤-磷酸核糖转移酶, 其基因位于X染色体长臂末端上, 体细胞中只有一个拷贝, 该基因对电离辐射较敏感。正常的次黄嘌泠-磷酸核糖转移酶特异性不强, 能把嘌呤类似物(如6-硫代鸟嘌呤, 6-TG)掺入到DNA中, 从而引起细胞死亡。
HPRT基因位点发生突变后, 淋巴细胞对嘌呤类似物产生抗性, 在有嘌呤类似物存在的情况下也能生存。利用此特性可检测细胞的突变频度, 从而估算辐射剂量, 这特别适用于评价急性照射和慢性小剂量照射的辐射危害程度。但是带有突变的HPRT基因是不稳定的[10], 且突变的淋巴细胞在体内易被淘汰, 不能长期存在, 所以只适用于受照后两年内的估算[3]。在离体培养条件下, 100kVpX射线照射时, 用HPRT检测突变基本没有阈值, 且与0.6Gy的倍增剂量呈线性关系。
以往曾有学者研究了多种HPRT基因位点突变的检出方法, 例如:
放射自显影法[11, 12] :在淋巴细胞培养体系中加入3H标记的脱氧胸腺嘧啶核苷, 使之掺入到淋巴细胞DNA中, 再经培养即可检测到抗嘌呤类似物的突变细胞。
克隆检测法[13] :即分离在6-TG环境中生的克隆细胞。该方法能够确定发生突变的细胞, 获得具稳定的HPRT—表型的克隆。检查结果准确, 其中B淋巴细胞克隆法比T淋巴细胞克隆法灵敏。
多核细胞检测法(又称细胞质分裂阻滞法) [3, 14] :细胞松驰素B能阻断细胞质分裂。而不影响细胞核分裂。利用这一特点可使对6-TG具有抗性的突变体经72h培养形成双核或多核细胞, 以此推算体细胞的突变频率。
多引物PCR方法[15] :用8对寡聚核苷酸引物扩增HPRT基因的9个外显子, 分析其基因突变情况, 也表明突变与剂量有一定关系, 而且随着辐射剂量的增加, 点突变逐渐减少, 缺失突变逐渐增加。
4 依赖TCR基因突变的生物剂量分析方法TCR是T淋巴细胞表面的一种受体蛋白, 在识别抗原及参与T细胞介导的免疫应答过程中起重要作用。
TCR为异二聚体, 由ê链和β链或δ链或γ链组成, 能和CD3分子形成复合体。如果TCR发生突变, 便不能形成复合体。用导硫氰基荧光素标记抗CD3抗体(产生绿色荧光), 藻红蛋白标记抗CD4抗体(产生红色荧光)。正常的T淋巴细胞CD3+CD4+表现为桔红色, 而CD3-CD4+表现为绿色。经流式细胞仪计数CD3-CD4+突变体, 再估算受照剂量[4]。
Seyama[16]等用TCR生物剂量计检测了9名切尔诺贝利核电站事故受害者, 其结果与依据染色体畸变分析所得结果非常一致。Kyoizum[4]等用此剂量计检测了18名接受131I放射治疗的甲状腺癌症患者, 结果也与131I给药的放射活度呈显著的线性剂量效应关系。
由于TCR突变的表达需要长达几个月的时间, 因而不能在辐照后立即应用。但Ishioka等[17]认为改良后的TCR突变分析法(improved TCR mutation assay)可用于近期辐射暴露的剂量测定, 也可用于局部放疗的妇科肿瘤病人的剂量研究, 且有较好的线性关系。具体做法是用mitogen刺激淋巴细胞加速TCR蛋白的表达, 作者认为phytohemagglutinin(PHA)能使突变在一周内得到表达。
5 依赖GPA基因突变的生物剂量分析方法GPA是存在于人的红细胞表面的一种血型糖蛋白, 其基因位于4q28 ~ 31。GPA蛋白因1、5位氨基酸的不同而表现为M、N两种抗原形式, 决定人的MN血型系统。电离辐射能引起MN杂合子表型转换, 突变的红细胞可以有4种表现型—MΦ、NΦ、MM和NN。用不同颜色的荧光标记的GPA-M或GPA-N的单克隆抗体, 与红细胞结合, 可表现出不同颜色或不同强度的荧光。经流式细胞仪检测分析, 确定其突变率。研究表明, 其结果与受照剂量有较好的线性关系[5]。不过目前仅能用于MN杂合子(约占人群的50 %)的检测。
人体内成熟的红细胞无细胞核, 其表面GPA抗原实际上源自红细胞前体或造血干细胞。因此检测到的GPA突变频率, 反映了红细胞前体或造血干细胞的突变情况。GPA基因位点突变多属于中性突变, 能在体内长期存在, 故造血干细胞GPA基因位点突变在许多年以后仍能通过血细胞表现出来。从这一点来讲, GPA生物剂量计可适合于受照已久远的剂量的估算。事实上, 长期慢性小剂量照射引起的GPA基因位点突变, 也能在造血干细胞中获得累积和持续表达, 其受照剂量也可通过此方法得到确定。但由于突变只能通过成熟的红细胞检测, GPA生物剂量计不适用于急性照射后的快速检测。
1995年, Jensen[18]等对切尔诺贝利核电站事故(10年后)中的120名受害者和营救人员进行GPA突变检测, 结果与其它方法所获得的结果一致, 并且所得的剂量效应曲线同早先用同样方法对原爆幸存者(40年后)进行分析所得曲线[19]非常接近。这说明辐射诱发的体细胞基因位点突变能够长期存在于骨髓干细胞中, 也说明GPA生物剂量计能够作为终生生物剂量计。
近年来, GPA生物剂量计还用于肿瘤病人放射治疗后的剂量监测[20], 在评估个体接触有害理化因素致癌研究方面也展示了良好的应用前景[21, 22, 23]。
但是也有实验表明, 染色体的稳定畸变可能比GPA位点突变更易于在体内长期累积[10]。
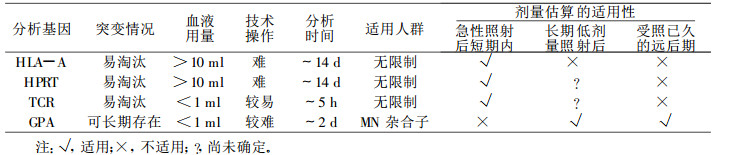
一般来说, 电离辐射诱发的各种体细胞基因突变, 是不可逆的, 能随细胞的分裂而遗传给子细胞, 属于稳定性遗传。但是, 如果该基因对于细胞的生存比较重要(比如TCR, HLA等), 带突变的细胞就容易被淘汰。基于这类突变的辐射生物剂量计, 只适用于急性照射后的短期估算, 不适用于长期慢性低剂量照射以及受照已久的远后期剂量的估算。相比较而言, GPA对细胞的生存影响不大, 带有GPA突变的细胞并无选择或生理劣势, 故能在体内累积和延续, 若干年以后还能检测到突变的存在, 并且与照射剂量仍保持较好的相关性, 因此基于GPA基因位点突变分析技术的生物剂量计最适于放射性工作者的剂量监测或估算。几种生物剂量分析方法的比较列于附表。
|
|
附表 几种生物剂量分析方法的比较 |
在应用基因位点突变分析技术时, 一个不容忽视的问题是个体的基因自发突变(spontaneous mutation)。自发突变是普遍存在的, 而且个体与个体之间存在有较大差异。这种差异主要是由于个体对辐射的敏感性、适应性不同造成的, 而且这种差异还随着个体年龄、精神状态、身体状况、生活方式(如是否吸烟、喝酒等)、生活环境(是否接触其它物理或化学致突因子)等的变化而变化, 因此在突变分析过程中必须考虑这个因素。
总的来说, 基于基因位点突变分析技术的生物剂量计可重复性强, 结果客观, 灵敏度高, 既适用于事故受照人员的剂量估算, 也适用于长期从事放射工作人员和接触有害理化致突因子人员的健康评价, 能对及时正确地采取医学措施提供可靠的剂量依据, 故具有良好的发展前景。
| [1] |
金璀珍, 刘秀林. 染色体畸变在辐射事故中作为生物剂量估计的应用评价[J]. 中华放射医学与防护杂志, 1993, 13: 8. |
| [2] |
Janatipour M, Trailor KJ, Kutkaca R, et al. Mutations in human lymphocytes studied by an HLA selection system[J]. Mutation Res, 1988, 198: 221. DOI:10.1016/0027-5107(88)90058-9 |
| [3] |
Norman A, Mitchell JC and Lwamoto KS. A sensitive assay for 6-thioguanine-resistant lymphocyte[J]. Mutation Res, 1988, 208: 17. DOI:10.1016/0165-7992(88)90014-0 |
| [4] |
Kyoizumi S, Umeki S, Akiyama M, et al. Frequency of mutant T lymphocytes defective in the expression of the T-cell antigen receptor gene among radiation exposed people[J]. Mutation Res, 1992, 265: 173. DOI:10.1016/0027-5107(92)90046-5 |
| [5] |
Langlois RG, Akiyama M, Kusinoki Y, et al. Analysis of somatic cell mutation at the glycophorin A locus in atomic bomb survivors: a comparative study of assay methods[J]. Radiat Res, 1993, 136: 111. DOI:10.2307/3578647 |
| [6] |
Boreham DR, Gale KL, Maves SR, et al. Radiation-induced apoptosis in human lymphocytes: potential as a biological dosimeter[J]. Health Phys, 1996, 71: 685. DOI:10.1097/00004032-199611000-00007 |
| [7] |
Menz R, Andres R, Larsson B, et al. Biological dosimettry: the potential use of radiationinduced apoptosis in human T-lymphocytes[J]. Radiat Environ Biophys, 1997, 36: 175. DOI:10.1007/s004110050069 |
| [8] |
Mccarron MA, Kutlaca A and Morley AA. The HLA-A mutation assay: improved technique and normal results[J]. Mutation Res, 1989, 225: 189. DOI:10.1016/0165-7992(89)90118-8 |
| [9] |
Kushiro J, Hirai Y, Kusunoki Y, et al. Development of a flow-cytometric HLA-A locus mutation assay fo r human peripheral blood lymphocytes[J]. Mutation Res, 1992, 272: 17. DOI:10.1016/0165-1161(92)90005-7 |
| [10] |
Little JB, Nagasawa H, Pfenning T, et al. Radiation-induced genomic instability: delayed mutagenic and cytogenetic effects of X-rays and alpha Particles[J]. Radiat Res, 1997, 148: 299. DOI:10.2307/3579514 |
| [11] |
Evans HJ and Vijayalaxmi. Induction of 8-azaguanine resistance and sister chromatid exchange in luman lymphocytes exposed to mitomicin Cand Xrays in vitro[J]. Nature, 1981, 292: 601. DOI:10.1038/292601a0 |
| [12] |
Albertini RJ, Sullivan CM, Berman JK, et al. Mutagenicity monitoring in humans by audiogrophic assay for mutant T lymphocytes[J]. Mutation Res, 1988, 204: 481. DOI:10.1016/0165-1218(88)90043-2 |
| [13] |
Moley AA, Trainor KJ, Seshadri R, et al. Mearsurement of in vivo mutations in human lymphocytes[J]. Nature, 1983, 302: 155. DOI:10.1038/302155a0 |
| [14] |
杨素霞. 细胞质分裂阻滞法检测体细胞HPRT基因位点突变的作用[J]. 中国辐射卫生, 1997, 6: 116. |
| [15] |
赵艳华, 邢瑞云, 马平, 等. 60Coγ射线致Hela MR细胞HPRT基因突变谱研究[J]. 辐射研究与辐射工艺学报, 1998, 16: 20. |
| [16] |
Seyama T. Analysis of somativ mutations frequence among persons exposed to radiaton from the Chernobyl Nuclear Power Plant accident[J]. Radiation Res, 1993, 134: 45. |
| [17] |
Ishioka N, Umeki S, Hirai Y, et al. Stimulated rapid expression in vitro for early detection of in vivo T-cell receptor mutations induced by radiation exposure[J]. Mut Res, 1997, 390: 269. DOI:10.1016/S1383-5718(97)00025-9 |
| [18] |
Jensen RH, Langlois RG, Bigbee WL, et al. Elevated frequency of glycophorin Amutations in erythrocytes from Chernobyl accident victims[J]. Radiat. Res, 1995, 141: 129. DOI:10.2307/3579040 |
| [19] |
Langlois RG, Bigbee WL, Kyoizumi S, et al. Evidence for increased somatic mutations at the glycophorin A locus in atomic bomb survirous[J]. Science, 1987, 236: 445. DOI:10.1126/science.3563520 |
| [20] |
Jensen RH, Reynolds JC, Robbins J, et al. Glycophorin Aas a biological dosimeter for radiation dose to the bone marrow from iodine-131[J]. Radiat Res, 1997, 147: 747. DOI:10.2307/3579490 |
| [21] |
Akiyama M, Omeki S, Kusunoki Y, et al. Somatic-cell mutations as a possible predictor of cancer risk[J]. Health Phys, 1995, 68: 643. DOI:10.1097/00004032-199505000-00003 |
| [22] |
Albertini RJ, Nicklas JA and O' neill JP. Somatic cell gene mutations in humans:biomarkers for genotoxicity[J]. Envion Health Perspect, 1993, 101(supp13): 193. |
| [23] |
Tekkel M, Rahu M, Veidebaum T, et al. The estonian study of chernobyl cleanup worders: I. Design and questionaire data, 11. Incidence of cacer and mortality[J]. Radiat Res, 1997, 147: 641. DOI:10.2307/3579631 |