拉曼光谱是一种基于拉曼散射效应的非弹性散射光谱分析技术[1]。拉曼光谱表现的是物质分子结构振动和转动信息, 因此具有指纹图谱功能。近年来拉曼光谱技术因其无损性、非接触性、分析时间短、分辨率高、水分无干扰等优点, 在药品检测和质量评价方面得到了大量应用, 例如药物成分识别、药物真伪鉴定、药物晶型分析、药物定量分析、药物微量分析、药物成分分布、药物含量均匀性分析等[2-11]。共焦显微拉曼成像是将拉曼光谱分析技术与显微分析技术相结合的一种新型可视化分析手段。它将拉曼光谱仪和一个标准的光学显微镜耦合在一起, 在使用高放大倍数的物镜观察样品的同时使用显微的激光光斑对样品进行拉曼光谱采集。与传统拉曼光谱技术相比, 在灵敏度、分辨率等多方面得到了提高[12]。
药物活性成分在制剂中分布均匀性表征是药品质量研究的重要组成部分。药物分布均匀性一方面可以反映产品制剂工艺, 另一方面也可能影响药物制剂的稳定性甚至体内特征。共焦显微拉曼成像技术用于制剂中药物分布均匀性评价具有便捷、直观等优势。1999年, Breitenbach等[13]首次报道了这方面技术应用研究。随着检测手段的发展, 结合表面增强拉曼光谱技术, 已经可以实现对于痕量药物的成像和均匀性分析[14]。然而, 几乎所有药物分布均匀性分析的研究对象都是片剂[14-21], 针对注射用冻干制剂的相关研究和分析方法未见报道。对于加入辅料的冻干制剂, 虽然不会像片剂或胶囊受到原辅料混合工艺的影响, 但冻干工艺变化很可能影响冻干物内部药物分布的均匀性, 进而影响产品质量。因此这类冻干制剂的药物分布均匀性问题也应该得到重视。
注射用培美曲塞二钠是临床上治疗局部晚期肺癌或转移性非小细胞肺癌的常用药物。该药原研制剂力比泰®于2005年在我国上市, 此后也有多家企业生产不同规格的仿制药上市销售。随着生产企业的增多, 不同厂家产品是否存在质量差异成为了药物一致性评价研究的课题。2014年该药物国家评价抽验项目的结果表明, 不同厂家产品冻干物的外观在表面光滑程度、整体疏松程度、硬度等方面均有较大差异。由于不同产品的处方大致相同, 主要辅料均为甘露醇, 因此提示以上这些差异极可能为冻干工艺不同所导致。而不同冻干工艺是否会影响冻干物内药物分布均匀性尚未可知。本课题将以不同厂家生产的注射用培美曲塞二钠为研究对象, 首次尝试研究冻干制剂内药物分布特征, 探究共焦显微拉曼成像技术用于评价冻干制剂药物分布均匀性的可行性, 为冻干制剂质量评价以及产品工艺研究和改良提供新思路和新方法。
材料与方法仪器 共焦显微拉曼光谱仪(LabRAM HR Evolution, 日本HORIBA公司), 激发光波长532 nm, 功率10%, 50倍物镜, 光栅选择600 (500 nm), 共焦针孔(hole): 200 μm, 光谱采集时间优化为5 s, 累积1次, 使用CCD检测器对样品进行光谱采集, Labspec®软件(日本HORIBA公司) 处理光谱数据。
试药与样品 培美曲塞二钠对照品(批号: 100897-202004, 中国食品药品检定研究院); 甘露醇对照品(批号: 100533-202006, 中国食品药品检定研究院); 5个厂家注射用培美曲塞二钠样品信息见表 1。
| Table 1 Products of pemetrexed disodium for injection used in the study |
对照品与冻干制剂拉曼光谱的采集 对培美曲塞二钠对照品和甘露醇对照品进行单光谱采集, 获得特征拉曼光谱图, 确定二者的特征拉曼光谱峰。对不同厂家培美曲塞二钠冻干物粉末进行单光谱采集, 获得各产品的拉曼光谱图, 考察培美曲塞二钠和甘露醇的特征峰在冻干制剂拉曼光谱图中的专属性。
对照品拼接物拉曼光谱成像 将培美曲塞二钠对照品和甘露醇对照品横向拼接平铺于载玻片上, 用另一载玻片按压获得一个平整表面。在拼接处进行二维光谱阵列采集(成像采集), 采集步长为20 μm, 步数为30 (X轴) × 20 (Y轴), 采用特征峰夹峰法对采集的光谱图进行成像处理。
冻干制剂拉曼光谱成像 取5个厂家的产品, 切割西林瓶, 分别取出完整的冻干物, 正向置于载玻片上, 取另一载玻片轻轻按压冻干物上表面获得一个平整表面(不破坏冻干物整体结构)。在上表面12点、3点、6点、9点及中心位置5个区域依次进行成像采集, 分别记为1~5号, 采集步长为20 μm, 步数为30 (X轴) × 20 (Y轴), 分别采用特征峰夹峰法和特征峰强度比值法对采集的光谱图进行成像处理, 评价冻干制剂药物分布均匀性。同法操作, 以1 μm步长对原研产品进行成像采集, 采用特征峰夹峰法对采集的光谱图进行成像处理。
拉曼光谱成像处理方法 本研究中采用两种方法对冻干制剂拉曼光谱进行成像处理, 分别为夹峰法和强度比值法。夹峰法是以物质的特征拉曼光谱峰进行拉曼成像处理的方法, 在光谱图中选择1 625和480 cm-1的拉曼峰分别作为培美曲塞二钠和甘露醇的特征峰, 以不同颜色区分, 对二维采集的所有光谱图进行成像处理, 成像图中每个像素点代表一张光谱图, 像素点的颜色强弱代表图谱中所选特征峰的强度大小; 强度比值法是以物质的特征拉曼光谱峰强度比值进行拉曼光谱成像处理的方法, 在光谱中计算培美曲塞二钠与甘露醇特征峰的强度比值(RI), 以该值对二维采集的所有光谱图进行光谱成像, 成像图中每个像素点代表一张光谱图, 像素点由蓝色至红色代表着光谱图中峰强度比值由小到大。
培美曲塞二钠相对含量测定法的方法学验证 将不同比例(培美曲塞二钠∶甘露醇= 20∶80、40∶60、50∶50、60∶40、80∶20、90∶10) 的培美曲塞二钠和甘露醇对照品加水溶解并混匀, 分别取0.5 mL置EP管中, 于-30 ℃预冻6 h, 之后以-88 ℃/8 pa升华干燥12 h进行冻干, 得到不同药物-辅料比的自制冻干物。完整取出冻干物, 于载玻片上按压成扁平状进行成像采集, 采集步长为20 μm, 步数为30 (X轴) × 20 (Y轴)。计算各比例冻干物所有采集光谱图中培美曲塞二钠与甘露醇特征峰强度比值的平均值, 建立强度比值与药物-辅料比例的线性关系。采用不同药物-辅料比的自制冻干物分别进行二维光谱成像采集, 计算特征峰强度比值平均值, 代入线性方程计算药物-辅料比, 评价方法回收率(n = 3)。选择药物-辅料比50∶50的自制冻干物进行方法精密度考察, 以20 μm步长、5 (X轴) × 5 (Y轴) 成像采集25张拉曼光谱图, 计算特征峰强度比值平均值, 同一区域连续重复测定6次, 计算日内精密度, 在第2天和第3天分别重复测定3次, 计算日间精密度。
药物分布均匀性分析 为了更加准确、客观地以“强度比值法”成像结果进行药物分布均匀性分析, 本研究将各扫描区域内全部像素点(光谱图) 中的峰强度比值数据导入SPSS软件, 计算平均值(RI mean); 将峰强度比值取整(I) 作为横坐标, 以取整后强度比值出现的频次(F) 作为纵坐标, 绘制频次分布直方图。直方图表示整个成像结果中培美曲塞二钠-甘露醇拉曼光谱特征峰强度比值的分布特征。同时, 如图 1所示, 分别引入最大频次(h)、分布宽度(w)、半分布宽度(1/2w) 和最大频次的强度比值(Imax) 等参数, 并计算最大频次/分布宽度(h/w) 和最大频次强度比值与半分布宽度的差的绝对值(|1/2w-Imax|), 用以评价药物分布均匀性, 其中, h/w用于评价分布直方图的离散度, h/w越大代表离散度越小, 说明该扫描区域内药物分布越均匀; |1/2w-Imax|可在一定程度上反映直方图的对称性, 用于初步评价分布直方图的偏度, 该数值越趋近于0即1/2w与Imax越接近, 直方图对称性越好, 说明扫描区域内不存在药物集中分布偏多或偏少的现象。
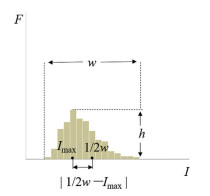
|
Figure 1 Graphic illustration of parameters for histogam evaluation. F: Frequency; I: Relative Raman intensity of pemetrexed to mannitol; h: Maximum frequency; w: Distribution width |
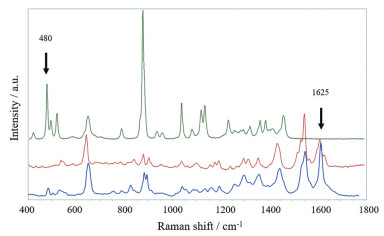
培美曲塞二钠对照品和甘露醇对照品的拉曼光谱如图 2所示, 两种成分分别在1 625和480 cm-1峰位处具有互不干扰的拉曼散射峰, 前者推测为培美曲塞二钠分子苯环结构弯曲振动引起的散射峰, 后者推测为甘露醇分子中O-C-C结构的弯曲振动和不对称伸缩振动引起的散射峰, 分别将它们指定为两种成分的特征峰。
|
Figure 2 Raman spectra of reference standards and brand product. Pemetrexed disodium (red) characteristic peak at 1 625 cm-1, mannitol (green) characteristic peak at 480 cm-1, brand product (blue) shows the characteristic peaks of pemetrexed disodium and mannitol at 1 625 cm-1 and 480 cm-1 both |
原研和仿制药5个厂家冻干制剂的拉曼光谱图基本一致。以原研产品为例, 拉曼光谱图中明显可见峰位为1 625 cm-1的培美曲塞二钠特征峰和480 cm-1的甘露醇特征峰(图 2), 说明该检测条件下各产品拉曼光谱图中培美曲塞二钠特征峰和甘露醇特征峰专属性良好, 可以用于冻干制剂的后续分析和成像。
3 夹峰法成像对冻干制剂药物分布的评价本研究中分别选取培美曲塞二钠特征峰(1 625 cm-1, 标记为绿色) 和甘露醇特征峰(480 cm-1, 标记为红色), 采用夹峰法对对照品拼接物和各厂家冻干制剂成像采集的拉曼光谱图进行成像处理。
3.1 对照品拼接物拉曼光谱成像对照品拼接物拉曼成像处理结果如图 3所示, 图 3A为成像采集区域显微图, 图 3B为图 3C和3D的叠加图, 图 3C和3D分别为单独选择培美曲塞二钠特征峰和甘露醇特征峰处理的成像图。叠加图中红色区域和绿色区域可以互相区分, 并且其分布界线与光学显微镜下对照品拼接物中两种物质的分布界线一致。该结果说明夹峰法成像分析方法能够准确地识别区分培美曲塞二钠和甘露醇两种物质。
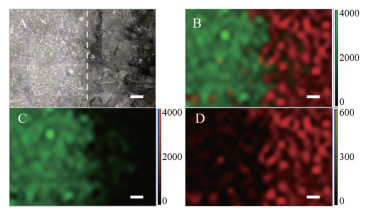
|
Figure 3 Raman spectroscopy mapping of mosaic mixture of pemetrexed disodium (left side of mixture) and mannitol (right side of mixture) reference standards. A: Optical image; B: Merge of images C and D; C: Raman image generated by clipping pemetrexed characteristic peak at 1 625 cm-1 (green); D: Raman image generated by clipping mannitol characteristic peak at 480 cm-1 (red). The scale bars are 50 μm |
对原研产品在20 μm步长下获得的扫描图谱进行成像处理, 成像图中代表培美曲塞二钠的绿色区域和代表甘露醇的红色区域几乎重叠, 说明该条件无法将二者在冻干制剂中的分布进行区分, 每个像素点的拉曼光谱图中都同时存在培美曲塞二钠和甘露醇的特征峰。在此基础上, 尝试通过减小步长、增加分辨率将主成分与辅料在成像图中区分。然而, 即使将扫描步长减小至1 μm, 得到的拉曼成像结果与20 μm步长结果基本相同。以上结果证明, 冻干制剂中的培美曲塞二钠高度分散在赋形剂甘露醇中, 采用夹峰法进行拉曼光谱成像并不能将二者区分, 无法达到评价药物分布均匀性的目的。
4 培美曲塞二钠相对含量测定法的方法学验证内标法是拉曼光谱定量分析方法之一, 待测物质与内标物质拉曼特征峰的相对强度与二者含量比例在一定范围内呈线性[22]。可以利用该方法的原理建立培美曲塞二钠与甘露醇特征峰强度比值(即二者相对强度) 与药物-辅料比例的线性关系, 对冻干制剂中主成分与辅料的相对含量进行定量分析, 从而达到评价药物分布均匀性的目的。采用不同药物-辅料比的自制冻干物进行该方法的方法学验证。
4.1 线性将自制冻干物所有采集光谱图中培美曲塞二钠与甘露醇特征峰强度比的平均值对药物-辅料比例作图, 建立线性关系, 得线性方程为y = 3.844 2x + 2.564 5 (r2 = 0.992 9), 说明药物-辅料比在20∶80~90∶10内与特征峰强度比值线性关系良好。
4.2 精密度和回收率选择药物-辅料比50∶50的自制冻干物进行方法精密度考察, 计算日内精密度为5.24%、日间精密度RSD为5.77%。选择5种不同药物-辅料比的自制冻干物(培美曲塞二钠∶甘露醇分别为40∶60、50∶50、60∶40、80∶20、90∶10) 进行方法回收率考察(n = 3), 结果分别为113.44%、124.71%、106.62%、103.25%和103.74%, 结果表明方法回收率良好。
方法学验证结果说明, 通过拉曼光谱扫描并计算光谱图中培美曲塞二钠和甘露醇特征拉曼峰的强度比值, 可以实现对冻干制剂中二者相对含量的准确定量分析。在此基础上, 在二维光谱阵列分析中可以尝试采用特征峰强度比值法, 即以二者特征峰强度比值作为成像参数, 进行药物分布均匀性分析。
5 特征峰“强度比值法”成像对冻干制剂药物分布的评价以培美曲塞二钠与甘露醇的相对含量对药物分布均匀性进行评价, 采用特征峰“强度比值法”对不同厂家冻干制剂成像采集的拉曼光谱图进行成像处理, 结果见图 4, 从左至右依次为每个产品1至5号区域内的成像结果。如成像图中颜色标尺所示, 像素点由蓝色至红色说明光谱图中峰强度比值由小到大, 代表扫描区域内样品中培美曲塞二钠相对甘露醇的含量由低到高, 整体像素颜色越均匀, 说明该区域内培美曲塞二钠相对甘露醇的量越一致, 分布均匀性越好。观察成像结果可以发现不同产品之间以及产品不同区域之间药物分布均匀性都有不同, 其中原研产品的均匀性差异最小, 而仿制药3号的均匀性差异最大。
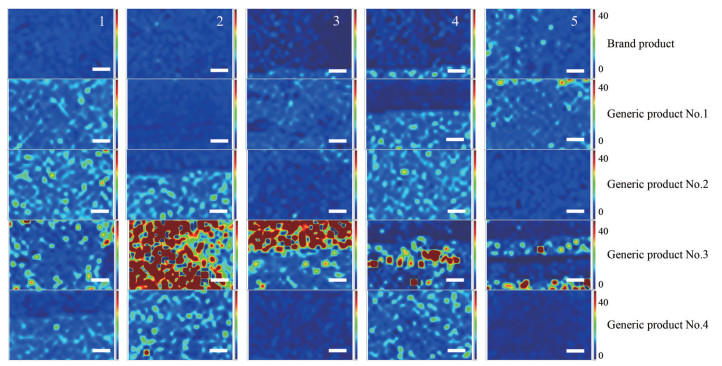
|
Figure 4 Raman spectroscopy mapping of 5 products by relative Raman intensity of pemetrexed (peak at 1 625 cm-1) to mannitol (peak at 480 cm-1) in regions 1-5, respectively. The scale bars are 100 μm |
根据各扫描区域成像结果绘制峰强度比值频次分布直方图, 结果见图 5。其中, 仿制药3号冻干制剂5个扫描区域内峰强度比值的分布最宽, 特别是2号区域直方图几乎呈扁平状。峰强度比值落在横坐标趋近于0的区域内说明该扫描点的样品中几乎不含主成分; 相反, 峰强度比值落在横坐标值较高的区域内说明该扫描点的样品中主成分含量极高, 辅料含量极少。从直方图结果可以看出, 仿制药3号药物分布均匀性明显不如其他产品。
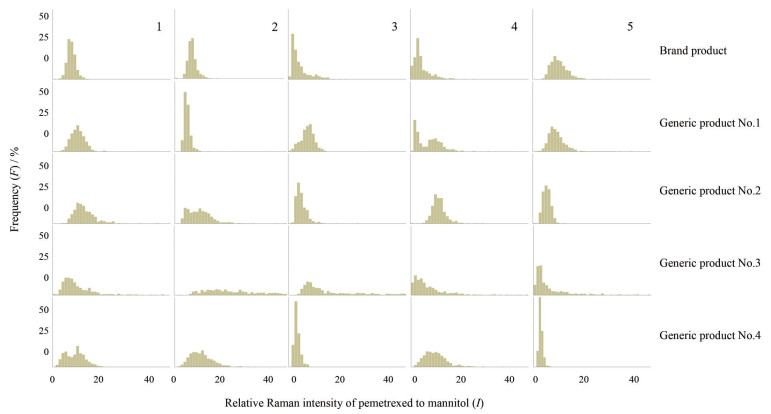
|
Figure 5 Histograms plotted by frequency of relative Raman intensity of pemetrexed to mannitol from all pixels in Raman spectroscopy mapping of figure 4 |
对直方图进行参数分析, 如图 1所示计算参数h/w和|1/2w-Imax|, 结果见表 2。仿制药3号各区域内的h/w值远小于其他产品, 说明其均匀性较差; 仿制药4号(进口仿制药) 的5个区域内h/w的平均值在所有产品中是最高的, 但是RSD较大, 说明该产品不同区域之间药物分布均匀性差异明显, 其中区域3和5的均匀性较好(h/w较大), 1、2和4区域内的均匀性相对较差(h/w较小); 原研产品、仿制药1号和仿制药2号三者h/w的平均值相似, 而原研产品5个区域内h/w的RSD明显小于其他产品, 说明原研产品总体药物分布均匀性较好, 不同区域内药物分布均匀性特征较为一致。分析各产品直方图|1/2w-Imax|计算值, 结果表明原研产品与仿制药产品相比药物分布均匀性相对较好; 而仿制药3号的各扫描区域的|1/2w-Imax|值均较大, 说明出现了药物或辅料集中分布的部分。
| Table 2 Parameters of histograms plotted by relative Raman intensity of pemetrexed to mannitol for homogeneity evaluation of pemetrexed distribution in different products |
此外, 将各产品5个扫描区域内全部像素点中的峰强度比值计算平均值(region mean), 代入4.1项下的线性方程, 得到各产品中培美曲塞二钠与甘露醇相对含量的计算值(calculate value), 结果见表 2。相对含量的计算值与实际处方中二者比例较为一致, 也验证了本次基于特征峰“强度比值法”的拉曼测定和均匀性评价的准确性和可靠性。
讨论近年来, 基于不同光谱的显微成像技术在药物质量表征和研究中得到越来越多的应用, 通过化学显微成像可以在保持样品完整的前提下直观获得样品内部的结构信息[23-27]。其中, 采用拉曼光谱成像法评价药物活性成分在制剂中的分布均匀性受到了较多关注, 主要因为其可以在一定程度上反映产品制剂工艺特征, 有助于产品质量评价、工艺分析优化以及伪药劣药鉴别[19, 28, 29]。该评价方法在片剂中的应用已相对成熟, 采用夹峰法进行成像处理, 便可得到各成分在制剂中的分布成像图[29, 30]。本研究在评价注射用冻干制剂中药物分布均匀性时, 首先尝试了夹峰法进行成像处理, 结果发现即使将图谱采集精度减小到步长1 μm, 也无法将制剂中的药物和辅料区分, 分析认为这是因注射用冻干制剂生产工艺与片剂不同导致的。片剂生产工艺中药物和辅料为物理混合, 且粉末粒度通常在微米级别, 将图谱采集步长减小到药物辅料粉末粒度以下, 采集到的拉曼光谱为单一成分的光谱图, 因此采用夹峰法成像可将药物和辅料轻易区分, 观察到制剂中药物成分分布的图像。而冻干制剂通常将药物和辅料先全部溶解于同一介质中, 经过冷冻干燥过程将液体介质去除形成固体冻干物。此时药物在辅料中呈高度分散的状态, 大部分扫描点下的光谱图中都同时含有药物和辅料的特征峰, 采用夹峰法成像无法将二者区分。基于内标法拉曼光谱定量分析的原理[22], 本研究又采用了药物-辅料峰强度比值法以二者特征峰的相对强度值对冻干制剂拉曼图谱进行成像处理。方法学验证结果表明, 该方法可以准确反映冻干制剂中药物与辅料的相对含量, 以此对冻干制剂中药物分布均匀性进行分析与评价。同时研究中也发现, 由于冻干制剂为疏松多孔的块状物, 进行拉曼光谱采集时扫描平面不如片剂平整, 导致不同扫描点下的拉曼光谱图信号强弱不一, 而采用峰强度比值法进行成像, 以药物辅料相对含量进行评价, 也可以很好地解决这一缺陷给均匀性分析带来的影响。因此峰强度比值法比经典的夹峰法更适合用于对冻干制剂中药物分布均匀性的评价。
采用峰强度比值法的拉曼光谱成像评价5个厂家注射用培美曲塞二钠冻干制剂中药物分布均匀性, 综合分析成像和频次分布直方图结果, 认为原研产品的药物分布均匀性与各仿制药产品比较相对较好。此外, 通过分析各产品不同区域内峰强度比值发现, 原研制剂和仿制药1号中心位置的峰强度比值比周围区域高, 说明中心位置药物的相对含量比周围高, 而其余3个厂家产品的情况与之相反, 中心位置药物相对含量较周围低。由于不同产品的处方组成大致相同, 以上药物分布均匀性差异可能来自于不同产品之间冻干工艺不同。
冻干制剂中药物分布均匀性在一定程度上可反映制剂微观结构的一致性, 与冻干工艺密切相关。预冻方式、预冻时间、冻干曲线都可能影响到药物和辅料的析出速度与程度, 从而影响冻干物结构和药物分布均匀性。良好的冻干结构能够保证冻干过程中溶剂顺利逸出, 反之会增加溶剂挥发阻力。结构上的不均匀可能会导致局部溶剂残留增加, 甚至可能会使活性药物成分局部降解, 影响产品稳定性和体内药效以及毒性。因此药物分布均匀性是冻干制剂的一个重要质量属性, 可在多方面影响产品质量和体内性质, 有必要对其进行评价。过去由于没有合适的测定和评价方法, 几乎没有对冻干制剂药物分布均匀性的研究。随着检测技术的发展, 冻干制剂药物分布均匀性相关的质量评价以及产品工艺研究应受到更多关注。
结论本研究采用共焦显微拉曼光谱成像技术, 以注射用培美曲塞二钠为模型药物, 首次对冻干制剂内部药物分布均匀性进行了研究。对比夹峰法和峰强度比值法的成像结果, 夹峰法不能将药物和辅料区分, 而峰强度比值法可以准确表征冻干制剂内药物-辅料的相对含量, 适合用于冻干制剂内药物均匀性评价分析。采用该方法对5个厂家产品中药物分布均匀性进行评价, 结果表明原研产品的均匀性相对较好。本文为研究冻干制剂药物分布均匀性提供了可行的思路和方法, 有助于产品质量评价和工艺分析。也可尝试将该方法用于栓剂、滴丸以及中药制剂等的相关研究工作。
作者贡献: 第一作者韩静负责实验、数据处理与分析和论文撰写; 通讯作者施亚琴、孙葭北负责本文选题与设计、实验设计、数据分析和论文指导; 姚静参与数据分析并对实验思路提供了宝贵意见; 董美阳参与样品测定。
利益冲突: 所有作者均声明无任何利益冲突。
| [1] |
Gordon KC, Mc Goverin CM. Raman mapping of pharmaceuticals[J]. Int J Pharm, 2011, 417: 151-162. DOI:10.1016/j.ijpharm.2010.12.030 |
| [2] |
Cao L, Wang Y, Luo JN. Confocal Raman microscopy identification of synthetic hypoglycemic drugs adulterated in Chinese traditional medicines[J]. Chin J Pharm Anal (药物分析杂志), 2011, 31: 539-543. |
| [3] |
Wang Y, Cao L, Luo JN. Identification of adulterated PDE5 inhibitors by confocal Raman microscopy[J]. Chin Pharm J (中国药学杂志), 2011, 46: 789-793. |
| [4] |
Sun SQ, Liu J, Zhou Q. Quick and non-destructive identification of traditional Chinese herbs (rhubarb) by Fourier transform infrared spectroscopy and Fourier transform Raman spectroscopy[J]. Chin J Anal Chem (分析化学), 2002, 30: 140-143. |
| [5] |
Peng B, Wang JR. Advances in characterization of pharmaceutical polymorphisms by vibrational spectroscopy[J]. Acta Pharm Sin (药学学报), 2021, 56: 102-112. |
| [6] |
Moriyama K, Furuno N, Yamakawa N. Crystal face identification by Raman microscopy for assessment of crystal habit of a drug[J]. Int J Pharm, 2015, 480: 101-106. DOI:10.1016/j.ijpharm.2015.01.031 |
| [7] |
Hu M, Chen ZP, Chen Y, et al. Quantification of methimazole in plasma and tablet samples by surface enhanced Raman spectroscopy in combination with multiplicative effects model[J]. Chin J Anal Chem (分析化学), 2015, 43: 759-764. |
| [8] |
West MJ, Went MJ. Detection of drugs of abuse by Raman spectroscopy[J]. Drug Test Anal, 2011, 3: 532-538. DOI:10.1002/dta.217 |
| [9] |
Ando D, Miyazaki T, Yamamoto E, et al. Chemical imaging analysis of active pharmaceutical ingredientin dissolving microneedle arrays by Raman spectroscopy[J]. Drug Deliv Transl Res, 2022, 12: 426-434. DOI:10.1007/s13346-021-01052-y |
| [10] |
Docoslis A, Huszarik KL, Papageorgiou GZ, et al. Characterization of the distribution, polymorphism, and stability of nimodipine in its solid dispersions in polyethylene glycol by micro-Raman spectroscopy and powder X-ray diffraction[J]. AAPS J, 2007, 9: E361-E370. DOI:10.1208/aapsj0903043 |
| [11] |
Schoenherr C, Haefele T, Paulus K, et al. Confocal Raman microscopy to probe content uniformity of a lipid based powder for inhalation: a quality by design approach[J]. Eur J Pharm Sci, 2009, 38: 47-54. DOI:10.1016/j.ejps.2009.05.011 |
| [12] |
Xu YJ, Luo RH, Guo MT, et al. The application and development of confocal Raman micro-spectroscopy[J]. Laser J (激光杂志), 2007, 28: 13-14. |
| [13] |
Breitenbach J, Schrof W, Neumann J. Confocal Raman-spectroscopy: analytical approach to solid dispersions and mapping of drugs[J]. Pharm Res, 1999, 16: 1109-1113. DOI:10.1023/A:1018956304595 |
| [14] |
Firkala T, Farkas A, Vajna B, et al. Investigation of drug distribution in tablets using surface enhanced Raman chemical imaging[J]. J Pharm Biomed, 2013, 76: 145-151. DOI:10.1016/j.jpba.2012.12.017 |
| [15] |
Boiret M, Rutledge DN, Corretta N, et al. Application of independent component analysis on Raman images of a pharmaceutical drug product: pure spectra determination and spatial distribution of constituents[J]. J Pharm Biomed, 2014, 90: 78-84. DOI:10.1016/j.jpba.2013.11.025 |
| [16] |
Eksi-Kocak H, Tamer SI, Yilmaz S, et al. Quantification and spatial distribution of salicylic acid in film tablets using FT-Raman mapping with multivariate curve resolution[J]. Asian J Pharm Sci, 2018, 13: 155-162. DOI:10.1016/j.ajps.2017.07.010 |
| [17] |
Jiang HY, Ding CH, Wang Y, et al. Determination of acetaminophen spatial distribution and content in tablets using confocal micro-Raman spectroscopy mapping[J]. J Nanopart Res, 2020, 22: 265. DOI:10.1007/s11051-020-04970-z |
| [18] |
Hisada H, Okayama A, Hoshino T, et al. Determining the distribution of active pharmaceutical ingredients in combination tablets using near IR and low-frequency Raman spectroscopy imaging[J]. Chem Pharm Bull, 2020, 68: 155-160. DOI:10.1248/cpb.c19-00791 |
| [19] |
Farkas A, Nagy B, Marosi G. Quantitative evaluation of drug distribution in tablets of various structures via Raman mapping[J]. Period Polytech-Chem, 2018, 62: 1-7. |
| [20] |
Su Y, Zhang YX, Wang Y, et al. Spatial distribution and content determination of Ganoderic acid F in tablets using confocal Raman microspectroscopy[J]. J Ambient Intell Human Comput, 2021, 12: 3505-3514. DOI:10.1007/s12652-020-02516-8 |
| [21] |
Strachan CJ, Rades T, Gordon KC, et al. Raman spectroscopy for quantitative analysis of pharmaceutical solids[J]. J Pharm Pharmacol, 2007, 59: 179-192. |
| [22] |
Pelletier MJ. Quantitative analysis using Raman spectrometry[J]. Appl Spectrosc, 2003, 57: 20A-42A. DOI:10.1366/000370203321165133 |
| [23] |
Chen JX, Guo Z, Li HY, et al. Real-time UV imaging of chloramphenicol intrinsic dissolution characteristics from ophthalmic in situ gel[J]. Acta Pharm Sin (药学学报), 2013, 48: 1156-1163. |
| [24] |
Feng J, Guo Z, Wu L, et al. Taste-masking mechanism of layer-by-layer self-assembly coating investigated by synchrotron radiation-based Fourier-transform infrared spectromicroscopy[J]. Acta Pharm Sin (药学学报), 2016, 51: 985-990. |
| [25] |
Duan XH, Wu L, Li X, et al. Three-dimensional structure investigation of beads self-assembled by cyclodextrin using synchrotron radiation X-ray microcomputed tomography[J]. Acta Pharm Sin (药学学报), 2018, 53: 291-296. |
| [26] |
Xiong T, Wu L, Peng H, et al. In situ characterization of structural change and internal particle distributions of soft capsules based on synchrotron radiation X-ray micro computed tomography[J]. Acta Pharm Sin (药学学报), 2020, 55: 1030-1034. |
| [27] |
Mészárosa LA, Galataa DL, Madarásza L, et al. Digital UV/VIS imaging: a rapid PAT tool for crushing strength, drug content and particle size distribution determination in tablets[J]. Int J Pharm, 2020, 578: 119174. DOI:10.1016/j.ijpharm.2020.119174 |
| [28] |
Sacrea PY, Deconincka E, Saerensb L, et al. Detection of counterfeit Viagra® by Raman microspectroscopy imaging and multivariate analysis[J]. J Pharm Biomed, 2011, 56: 454-461. DOI:10.1016/j.jpba.2011.05.042 |
| [29] |
Gendrina C, Roggoa Y, Collet C. Pharmaceutical applications of vibrational chemical imaging and chemometrics: a review[J]. J Pharmaceut Biomed, 2008, 48: 533-553. DOI:10.1016/j.jpba.2008.08.014 |
| [30] |
Ewing AV, Kazarian SG. Recent advances in the applications of vibrational spectroscopic imaging and mapping to pharmaceutical formulations[J]. Spectrochim Acta A, 2018, 197: 10-29. DOI:10.1016/j.saa.2017.12.055 |
 2022, Vol. 57
2022, Vol. 57


