2. 暨南大学药学院, 广东 广州 510032
2. School of Pharmaceutical Sciences, Jinan University, Guangzhou 510032, China
囊性纤维化(cystic fibrosis, CF) 是由囊性纤维化跨膜电导调节因子(cystic fibrosis transmembrane conductance regulator, CFTR) 发生基因突变导致CFTR蛋白功能缺陷或缺失的一种多系统常染色体隐性遗传病。患者的主要临床表现为呼吸系统和消化系统异常, 通常伴有慢性梗阻性肺部病变、胰腺外分泌功能不良和汗液电解质异常升高等特征。其中, 肺部的反复感染、炎症和呼吸衰竭是导致CF患者死亡的主要原因。不同地区CF的发病率各不相同, 相关数据表明, 欧洲的CF发病率较高, 约1/3 000的高加索人会患此病, 而亚洲人口的发病率约为1/30 000。随着医疗技术的发展, CF患者的平均存活年龄逐渐增大, 但目前仍无有效根治该疾病的方法[1]。
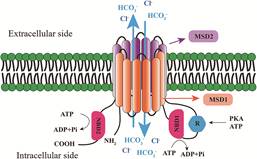
1 囊性纤维化的致病原因CF是由人体7号染色体上编码CFTR的基因出现致病性突变而引起CFTR蛋白功能缺失所引起的[2]。CFTR蛋白是一种广泛存在于多个器官(包括呼吸系统、消化系统、生殖系统、汗腺等) 上皮细胞的环磷酸腺苷依赖性氯离子通道, 能转运Cl-和HCO3-等, 通过结合三磷酸腺苷与蛋白激酶A磷酸化激活, 对机体电解质和体液的吸收及分泌起重要作用, 具体机制如图 1所示[3]。CFTR基因突变可能使氨基酸序列发生变化或产生正常CFTR基因所没有的新的氨基酸序列, 影响CFTR蛋白的表达和功能, 使上皮细胞的阴离子无法正常转运, 水分泌减少, 黏膜表面脱水并酸化, 最终导致多个器官腔道中黏液过于黏稠, 易聚积并堵塞导管[1]。
|
Figure 1 Model showing proposed domain structure of cystic fibrosis transmembrane conductance regulator (CFTR). MSD1 and MSD2: Membrane spanning domains; NBD1 and NBD2: Nucleotide binding domains; every membrane spanning domain followed by a nucleotide binding domain. R is an intrinsically disordered region between NBD1 and MSD2. PKA: Protein kinase A; ATP: Adenosine triphosphate; ADP: Adenosine diphosphate |
针对呼吸系统, 由于呼吸道积聚黏液, CF患者临床上主要表现为肺部反复感染致使肺功能下降, 严重者出现呼吸衰竭。胰液黏性的增加会引起胰腺组织的破坏, 从而出现胰腺囊肿或纤维化。此外, 与CF相关的糖尿病、远端肠梗阻综合征、肝病、不孕不育症和骨质疏松症等也频繁发生。
1989年, Riordan等[4]成功鉴定并克隆了CFTR基因。该基因位于7号染色体(7q31.2) 的长臂上, 长度约为250 kb, 包含27个外显子。目前, 已知的CFTR基因突变种类大概有2 000种, 根据所造成的功能缺陷, 主要分为以下6种类型[1]。Ⅰ类突变: 主要影响CFTR蛋白的产生, 包括移码突变、剪切突变及由于转录过程提前出现终止密码子导致转录提前终止的无义突变。Ⅱ类突变: 到达细胞表面的CFTR蛋白数量减少, 这是由于蛋白质错误折叠和滞留在内质网被过早降解, 减少了运输到细胞表面的CFTR, 少数到达细胞表面的CFTR也会表现出门控异常, 包括最常见CFTR蛋白第508位缺少苯丙氨酸(F508del) 的突变(约90%的CF患者属于此类突变)。Ⅲ类突变: 即门控突变, CFTR蛋白的功能受损, 导致其开放率和开放时间显著下降。Ⅳ类突变: CFTR通道门控功能正常, 但其孔隙构象异常, 导致通过的离子流量显著降低。Ⅴ类突变: 剪切异常引起的正常mRNA数量减少, 导致CFTR蛋白减少, 这一过程中正常与异常mRNA的数量比例具有个体及器官差异性。Ⅵ类突变: 破坏细胞表面CFTR蛋白的稳定性。
研究表明[5], 不是所有的CFTR基因突变都会引起发病, 只有部分突变会导致典型的CF临床表现, 而另一部分突变引起的疾病称为CFTR相关疾病, 可将其定义为“与CFTR功能障碍相关但不符合CF诊断标准的疾病”。目前, 诊断CF的主要指标为汗液中氯化物浓度(chloride concentration in sweat, SCC), 当SCC值(阈值为60 mmol·L-1) 升高时, 预示可能患CF[4]。
2 囊性纤维化的治疗方案目前, CF的治疗方案主要包括针对基因突变的疗法及针对患者临床表现的疗法。如对于气道中黏液过多导致的肺部感染, 一般给予黏液溶解剂以降低黏液阻塞概率, 同时配合使用抗生素治疗感染; 对于因胰腺外分泌功能受阻导致的营养不良或CF相关的糖尿病, 除根据患者突变类型采取相应的CFTR调节剂外, 一般联合给予胰酶(脂肪酶、淀粉酶、蛋白酶) 或胰岛素[4]。具体给药途径包括以下几类。
2.1 口服给药口服给药是临床应用最广泛的给药方式, 可经胃肠道吸收的药物都会首选设计成口服制剂, 其制备方法简单方便, 用药安全, 患者一般可自行服药。目前治疗CF的药物主要是CFTR调节剂, 通过增强CFTR蛋白功能或校正CFTR基因突变导致的异常, 已上市的CFTR调节剂均是口服固体制剂[6]。但口服后药物经胃肠道吸收及肝脏代谢后再进入血液, 这一过程相对起效较慢, 不适用于急症。同时, 口服药物存在首过效应, 进入血液的药物量减少, 导致药效较低。CF患者还通常因胰腺功能失常伴随营养不良, 日常需进行胰酶替代治疗, 即每餐需服用脂肪酶、淀粉酶、蛋白酶等胰酶, 以保证身体所需营养。
2.2 注射给药注射给药的药物吸收快、进入体内的药量较准确, 尤其适用于无法口服给药的患者。但注射给药出现不良反应的概率相对较高。目前注射给药主要用于CF并发症的治疗, 如在CF患者肺部出现严重急性感染时, 静脉注射抗生素可能是必须的, 但这一理论仍需进一步研究。目前大部分CF患者在发生感染后仍首选口服给药治疗[7], 将静脉注射抗生素作为CF患者感染时的辅助用药。另一方面, CF患者因胰腺分泌功能失常, 通常伴随CF相关的糖尿病, 届时需结合使用胰岛素以控制患者血糖。由于胰岛素口服易被胃肠道消化酶破坏失效, 故目前主要采用皮下注射方式给药, 以联合治疗CF相关的糖尿病。
2.3 吸入给药对于CF患者, 由于气道黏液易积聚, 肺部感染是其最常见的并发症。肺部吸入给药因具有吸收表面积大、起效迅速、无首过效应、直达病灶部位等特点而广受研究者青睐。近年来, 肺部吸入给药用于治疗CF及其肺部感染的研究正逐年增加[7]。通常将黏液溶解剂及抗生素设计成肺部吸入给药制剂, 前者用于控制CF患者气道黏液的黏稠度, 后者用于治疗CF患者的肺部感染。
3 囊性纤维化的治疗药物及其作用机制 3.1 针对CFTR基因的药物在CFTR基因发现前, CF治疗主要针对其临床病理表现而采取相应的控制手段。自发现CFTR基因以来, 研究者开始寻找针对该基因突变引起的CFTR蛋白功能受损或缺失的疗法, 包括CFTR增效剂及校正剂, 具体药物信息见表 1。
| Table 1 Drugs for the treatment of cystic fibrosis (CF) |
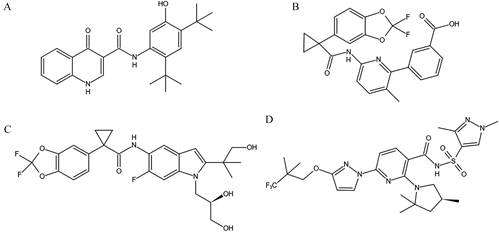
是福泰制药公司(Vertex Pharmaceuticals, Inc.) 推出的第一个治疗CFTR基因突变的口服制剂, 通用名为伊伐卡托(ivacaftor, 又称VX-770), 化学结构见图 2A[8], 主要适用于门控突变(Ⅲ类突变, 约占总量的5%) 的4个月或以上的CF患者, 其突变位点包括G551D、G1244E、G1349D、G178R、G551S、S1251N、S1255P、S549N、S549R。此外, 对R117H突变(属于Ⅳ类突变) 引起的CF也有一定治疗作用。Kalydeco与含有脂肪的食物一起服用时, 其药效较单独服用可提高2.5~4倍, 6岁以上儿童及成人的推荐剂量为150 mg·12 h-1 [9]。Ivacaftor可显著提高细胞表面CFTR蛋白的活性, 通过增加CFTR蛋白通道的开放频率及开放时间, 促进Cl-转运, 增强水进出细胞的能力, 从而降低CF患者黏液的黏度。有研究对635名接受ivacaftor治疗的CF患者(实验组) 进行了5年的追踪调查, 结果显示与未使用ivacaftor的对照组相比, 实验组患者的肺功能明显强于对照组, 且实验组患者的体重指数(body mass index, BMI) (实验组+ 2.4 kg·m-2, 对照组+ 1.6 kg·m-2) 也高于对照组; 同时, 实验组患者的病情恶化频率及住院频率也显著降低[10]。
|
Figure 2 Structures of drugs for CFTR gene. A: Ivacaftor; B: Lumacaftor; C: Tezacaftor; D: Elexacaftor |
是福泰制药公司推出的一种ivacaftor和lumacaftor (鲁玛卡托, 又称VX-809) 联用的复方制剂, 适用于2岁及以上的F508del纯合子突变的CF患者, 这类患者占据CF病例1/2以上。研究表明, Orkambi与含脂肪的食物同服可明显增加lumacaftor的药效[11]。Lumacaftor (化学结构见图 2B) 可提高F508del-CFTR的构象稳定性, 阻止其降解, 从而使到达细胞表面的CFTR蛋白数量增多。但少量到达细胞表面的F508del-CFTR蛋白可能发生门控异常, 当lumacaftor与ivacaftor联用时, 可有效控制门控异常的发生, 进一步改善到达细胞表面的CFTR蛋白的功能。
但lumacaftor是细胞色素P450 3A (cytochrome P450 3A, CYP3A) 的强诱导剂, 而ivacaftor是CYP3A的敏感底物, 两者联用会缩短ivacaftor的体内半衰期, 降低其疗效, 故在联合用药时应适当增加ivacaftor剂量, 且应避免与敏感的及治疗指数较窄的CYP3A底物联用。Orkambi的Ⅲ期临床试验结果表明, lumacaftor和ivacaftor联用24周后, F508del-CFTR纯合子突变的≥ 12岁的CF患者耐受性良好, 肺功能和BMI (增加0.24~0.28 kg·m-2) 均得到改善, 肺部恶化率(fewer pulmonary exacerbations, PExs) 降低30%~39%[11]。
3.1.3 Symdeko是tezacaftor (替扎卡托, 又称VX-661) 和ivacaftor联用的复方制剂, 该药适用于6岁以上的F508del纯合子突变及伴有某些“残余功能”的F508del杂合子突变的CF患者。同样, Symdeko与含脂肪的食物同服效果更佳。Tezacaftor的化学结构(图 2C) 及作用机制均与lumacaftor类似, 主要通过促进F508del-CFTR蛋白的加工和运输, 增加到达细胞表面的CFTR蛋白量, 与ivacaftor合用可增强细胞表面CFTR蛋白的功能[12]。
研究表明, 与Orkambi相比, 患者对Symdeko的耐受性更好, 服用药物后产生的不良反应更少。Ⅲ期临床试验结果表明, tezacaftor与ivacaftor联用24周后, 患者的肺功能得到显著改善; PExs显著降低。此外, tezacaftor非CYP3A4酶的诱导剂, 因此, Symdeko的药物相互作用少。但值得注意的是, tezacaftor亦是CYP3A的底物, 故使用时应避免与强效CYP3A诱导剂(如利福平) 联用[13]。
3.1.4 Trikafta是由福泰制药公司研发的首个三重药物[elexacaftor (VX-445)、tezacaftor、ivacaftor] 联合应用的复方制剂, 适用于治疗12岁及以上的CFTR基因至少有1个F508del突变的CF患者, Trikafta的服用方法同样推荐与含脂肪的食物同服[9]。Elexacaftor的化学结构见图 2D, 其作用机制与tezacaftor相似, 主要是促进F508del-CFTR蛋白的加工与运输。但这两种药物与蛋白质的结合位点不同, 所以两者之间不仅没有竞争关系, 同时给药还会产生协同效应。研究数据表明, Trikafta可显著增加细胞表面CFTR蛋白的数量并完善其功能[14]。
与其他CFTR调节剂相比, Trikafta的治疗范围更广, 可用于治疗所有F508del突变(约90% CF患者为该突变) 引起的CF, 包括F508del-CFTR最小功能突变(即患者含有的CFTR蛋白极少甚至没有) 引起的病变。Middleton等[15]报道了一项为期24周的试验, 研究对象为403名≥ 12岁的F508del-CFTR最小功能突变患者, 该研究显示, 在接受elexacaftor/tezacaftor/ivacaftor治疗24周后, 患者肺功能明显改善, SCC浓度为41.8 mmol·L-1, PExs显著降低。但elexacaftor同样为CYP3A底物, 应避免与利福平等强效CYP3A诱导剂合用。
3.2 针对CF患者临床表现的药物自CFTR调节剂研发以来, CF的临床治疗效果有了明显提高, 患者机体功能和生活质量都显著改善, 从而延长了患者寿命。但由于年龄、突变类型、治疗费用等原因, 并非所有CF患者均能获得适合自己的CFTR调节剂。此外, CFTR调节剂只能促进SCC浓度趋于正常, 但不能使其恢复至正常数值, 且肺部感染等并发症依旧威胁着CF患者的生命及生活质量。因此, 抗炎和抗菌等治疗手段仍必不可少, 调节患者CFTR功能的同时应有效控制CF并发症[4]。针对CF患者临床表现的具体药物信息见表 1。
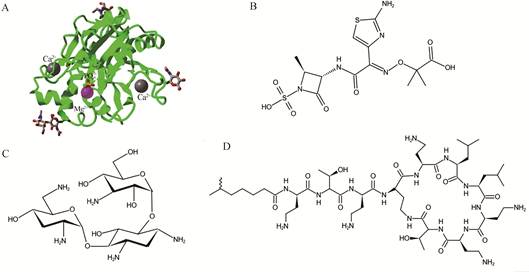
3.2.1 Pulmozyme重组人脱氧核糖核酸酶(Pulmozyme, dornase alfa) 是一款通过雾化给药改善CF患者肺功能的重要药物, 每日剂量2.5 mg。Pulmozyme是重组人脱氧核糖核酸酶Ⅰ (recombinant human deoxyribonuclease Ⅰ, rhDNase Ⅰ)的高纯度溶液, 其活性与二价阳离子(如Ca2+、Mg2+) 的存在密切相关, 图 3A展示了rhDNase Ⅰ与Ca2+、Mg2+及磷酸盐复合的结构[16]。CF患者气道的脓性分泌物中含有大量脱氧核糖核酸(deoxyribonucleic acid, DNA), 这是由于气道感染后, 导致中性粒细胞聚集, 中性粒细胞的分解会产生大量DNA, 从而引起分泌液黏附性和黏弹性增高, 黏液阻塞气道造成呼吸道进一步感染, 炎症反复出现[17]。Dornase alfa可降解气道中的DNA, 从而降低分泌物的黏附性和黏弹性, 提高黏液纤毛清除率, 改善肺功能。有研究表明, 患有轻中度CF的成年患者在连续给药6个月后, 肺功能的平均改善率约为5.8% (每日给药1次) 和5.6% (每日给药2次), 还可降低PExs。Pulmozyme是目前唯一有效改善患者肺功能的一种黏液溶解剂[16]。
|
Figure 3 A: Schematic diagram of rhDNase Ⅰ (PDB ID: 4AWN). B-D: Chemical structures of tobramycin (B), aztreonam (C) and colistin (D) |
妥布霉素(化学结构见图 3B) 对大部分革兰阴性菌具有抗菌活性, 由于妥布霉素口服不吸收, 故需胃肠外给药。TOBI和Tobi Podhaler是诺华制药公司(Novartis Pharmaceuticals) 研发的吸入性妥布霉素制剂, 其中TOBI为吸入用妥布霉素溶液, Tobi Podhaler是吸入性妥布霉素干粉制剂, 两者均主要用于CF伴肺部感染的患者。TOBI推荐剂量为每隔1个月通过PARI LC PLUS™雾化器给药, 每日2次, 每次1瓶(含妥布霉素300 mg)。Tobi Podhaler推荐剂量是每隔1个月通过干粉吸入器(Podhaler®) 给药, 每日2次, 每次4粒(每粒含妥布霉素28 mg)[18]。引起CF患者肺部感染的主要致病菌为铜绿假单胞菌, 妥布霉素可与细菌细胞中的30S核糖体亚单位结合, 影响其蛋白的转录和翻译, 改变细胞膜通透性, 破坏细胞膜, 导致细胞死亡[19]。研究表明[20], 间歇性使用TOBI可改善CF患者肺功能并降低患者痰标本中铜绿假单胞菌的密度。
3.2.3 Cayston®是氨曲南(aztreonam) 吸入制剂, 用于改善肺部被铜绿假单胞菌感染的CF患者的呼吸症状。Cayston®通过Altera®雾化器给药, 每日3次, 每次剂量为75 mg。氨曲南的化学结构见图 3C, 它可与细菌的青霉素结合蛋白3作用, 抑制细菌细胞壁合成, 最终导致细胞溶解死亡, 因此, 氨曲南对大部分革兰阴性需氧菌均具有抗菌活性。Cayston®长期安全性评价试验结果显示, 接受Cayston®治疗的CF患者的肺功能及生活质量都得到明显改善, 目前Cayston®已广泛应用于美国CF患者的治疗, 通常与吸入性妥布霉素交替使用[21]。
3.2.4 Colistin黏菌素(colistin) 是一种荷正电的环状阳离子抗菌肽, 属于多黏菌素家族, 又称多黏菌素E (polymyxin E), 对革兰阴性菌具有强大的杀菌作用[22]。黏菌素由1个七肽环、1个三肽尾部、1个疏水的酰基链组成(图 3D)[23]。因黏菌素具有肾毒性和神经毒性, 20世纪70年代后, 临床上已较少使用。近年来, 由于细菌耐药性的产生, 黏菌素作为抗多药耐药性革兰阴性菌的最后防线重回临床。黏菌素的杀菌作用是通过与细菌外膜上的脂多糖(lipopolysaccharide, LPS) 结合, LPS可阻止抗生素进入细胞, 是细菌外膜发挥保护作用的主要成分之一。荷正电的黏菌素与LPS中荷负电的脂质A通过静电结合, 再竞争性取代细菌外膜上的Mg2+和Ca2+, 降低细菌外膜的稳定性, 使抗生素更易进入细胞。同时, 黏菌素还可增强细胞膜的通透性, 使细胞内容物流出, 最终导致细菌死亡。此外, 黏菌素还具有抗内毒素作用, 脂质A是内毒素的主要成分, 黏菌素通过中和脂质A实现抑制内毒素活性的目的[24]。
早期, 黏菌素主要以非活性前药—甲磺酸黏菌素(colistimethate sodium, CMS) 通过胃肠外给药方式在临床使用。此外, 口服或外用的硫酸黏杆菌素(colistin sulphate, CS) 也有应用。现代新型给药系统尝试黏菌素以干粉吸入剂的方式递送至肺部[22], 尽管目前尚未有确切的临床试验数据, 但已有研究根据临床症状评分及CF患者肺功能的改善情况表明黏菌素吸入疗法优于安慰剂[21]。
4 新型CFTR调节剂基于CFTR调节剂的广泛应用, 全球约90% CF患者的肺功能及营养状况得到了改善, 但仍有约10%的患者无有效治疗方法。此外, 已有研究表明ivacaftor并不能完全消除因门控突变引起的功能缺陷, 长期使用ivacaftor可能对F508del-CFTR蛋白有一定的抑制作用[25]。因此, 新型CFTR调节剂即应运而生(表 2)。
| Table 2 New CFTR modulators |
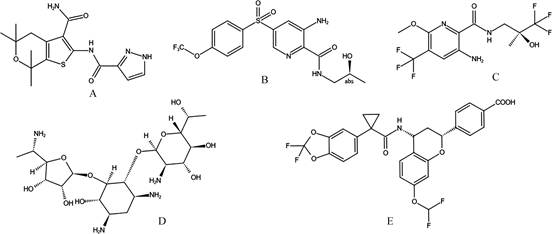
GLPG1837是新型CFTR增效剂, 目前正处于临床研究阶段[26]。GLPG1837 (图 4A) 的化学结构与ivacaftor不同, 但二者作用机制类似。这两种药物联用时会出现竞争性抑制作用, 即二者可能作用于同一结合位点。研究表明, 与ivacaftor相比, GLPG1837对G178R、S549N、G551D、R117H等突变体均表现出更好疗效。但ivacaftor对CFTR蛋白的亲和力远高于GLPG1837, 故二者联用时难以确定CLPG1837的准确剂量。此外, 联合用药研究还发现GLPG1837对lumacaftor的抑制作用明显低于ivacaftor[25], 这表明GLPG1837与lumacaftor联用可能更具前景。
|
Figure 4 Structures of new CFTR regulators. A: GLPG1837; B: GLPG2451; C: QBW251; D: ELX-02; E: GLPG2222 |
GLPG2451是CFTR增效剂, 在高通量筛选实验中, 根据GLPG2451的药代动力学特性及其低CYP诱导能力, 将GLPG2451列为临床候选药物[27]。研究发现, GLPG2451的化学结构(图 4B) 与GLPG1837、ivacaftor均不同, 但其作用机制及结合位点与上述两药相似, 即三者存在竞争性抑制作用。同时, 与ivacaftor相比, GLPG2451对F508del-CFTR的作用更强; 与GPLG1837相比, GLPG2451对CFTR校正剂的负面影响更小[25]。目前, GPLG2451的临床前安全性评价结果良好, 已进入Ⅰ期临床试验阶段[27]。
4.3 QBW251QBW251 (icenticaftor) 是一种口服小分子CFTR增效剂, 其化学结构见图 4C[28]。研究发现QBW251在Ⅲ类和Ⅳ类突变CF患者中具有较高生物活性, 可改善患者肺功能。但QBW251对F508del突变的患者并没有显著疗效, 这可能是由于Ⅲ类和Ⅳ类突变患者的细胞表面有较多CFTR蛋白, 而F508del突变患者的细胞表面CFTR蛋白极少或没有, 从而限制了QBW251的增效作用。因此, QBW251与CFTR校正剂联用可能疗效更好。此外, 初步研究表明QBW251对健康志愿者和CF患者都有良好的耐受性和安全性, 进一步的作用机制研究亟待开展[29]。
4.4 ELX-02ELX-02 (又称NB-124) 是一种新型的小分子氨基酸类似物, 其化学结构见图 4D, 拟用于治疗基因无义突变引起的遗传病。无义突变是指编码某种氨基酸的密码子碱基发生改变, 使其变成终止密码子(UAA、UAG或UGA), 从而使肽链合成提前终止, 未得到功能蛋白。此外, 无义突变还可降低mRNA的稳定性, 导致mRNA降解, 最终影响蛋白质合成。CFTR无义突变患者无法合成功能完整的CFTR蛋白, 故CFTR增效剂和校正剂对此类患者均无治疗效果[30]。研究证明, ELX-02通过注射给药后可抑制CFTR基因的无义突变, 其作用机制如下: ELX-02与核糖体小亚基中的解码位点结合, 使其识别同源或近同源氨酰基-tRNA的能力下降; 同时, ELX-02可增加近同源氨酰基-tRNA与“过早终止密码子(UAA、UAG或UGA)”结合, 取代第一类肽链释放因子发挥通读活性, 使蛋白质在翻译过程中越过“过早终止密码子”, 得到全长的功能蛋白。与此同时, ELX-02对“天然终止密码子(UAA、UAG或UGA)”无显著影响, 不会影响其他正常蛋白的翻译[31]。研究发现, 氨基酸类抗生素(如庆大霉素) 虽也具有与ELX-02相似的通读活性, 但该类化合物具有一定的肾毒性和耳毒性, 不可全身给药或长期使用。而ELX-02属于非抗生素高效通读剂, 耐受性良好, 目前正在准备针对G542X突变的CF患者的Ⅱ期临床试验[30], 未来可能应用于临床。
4.5 GLPG2222GLPG2222 (又称ABBV-2222) 是一种新型CFTR校正剂, 化学结构见图 4E。对F508del突变的CF患者的原代细胞具有较强的体外治疗活性。研究表明, GLPG2222可能与lumacaftor或tezacaftor有类似作用机制, 即选择性纠正F508del基因在内质网上的错误折叠, 以促进正常CFTR蛋白到达细胞表面。值得关注的是, 与lumacaftor及tezacaftor相比, GLPG2222表现出体外效价更高, 与药物相互作用能力更小的特征。目前, GLPG2222已进入Ⅱ期临床试验, 有望成为CF患者新型三联疗法的主要成分之一[32]。
5 总结与展望CF是一种由CFTR基因突变引起的多系统疾病, 随着研究者对其发病机制的不断深入, CF的治疗逐渐由对症治疗(使用抗生素等) 转变成对因治疗(使用CFTR调节剂)。目前, CFTR调节剂主要通过调整特定类型的基因突变, 使CFTR蛋白的功能增强或数量增加, 已有约90% CF患者的机体功能和营养状况得到了改善。但是, 已知的CFTR突变基因有上千个, 突变多样性导致仍有部分CF患者无法受到有效治疗, 故新型CFTR调节剂的研究仍非常重要。
由于CFTR突变基因的多样性, 不可仅依赖于寻找CFTR调节剂, 还应积极寻找其他不受CFTR基因突变限制的治疗方法, 尽可能使所有CF患者都得到有效治疗。如用功能性基因替换缺陷基因的基因疗法, 有望成为根治CF的方法。此外, 研究者在上皮细胞中发现了其他非CFTR离子通道, 如钙激活氯离子通道(TMEM16A)、上皮细胞钠离子通道(ENaC)、多功能阴离子转运体(SLC26A9) 等, 这些离子通道均与水分泌有关, 可通过调节其功能改善CF患者气道的状况, 有望成为药物新的作用位点。
作者贡献: 朱春娥负责综述的选题并提出修改建议; 林霖负责综述的调研与撰写; 王岩和吴传斌负责本综述的指导与审阅。
利益冲突: 论文不涉及相关知识产权, 不存在利益冲突。
| [1] |
Wei T, Sui H, Su Y, et al. Research advances in molecular mechanisms underlying the pathogenesis of cystic fibrosis: from technical improvement to clinical applications[J]. Mol Med Rep, 2020, 22: 4992-5002. DOI:10.3892/mmr.2020.11607 |
| [2] |
Chen Q, Shen Y, Zheng J. A review of cystic fibrosis: basic and clinical aspects[J]. Animal Model Exp Med, 2021, 4: 220-232. DOI:10.1002/ame2.12180 |
| [3] |
Link SL, Nayak RP. Review of rapid advances in cystic fibrosis[J]. Mo Med, 2020, 117: 548-554. |
| [4] |
Riordan JR, Rommens JM, Kerem B, et al. Identification of the cystic fibrosis gene: cloning and characterization of complementary DNA[J]. Science, 1989, 245: 1066-1073. DOI:10.1126/science.2475911 |
| [5] |
Bienvenu T, Lopez M, Girodon E. Molecular diagnosis and genetic counseling of cystic fibrosis and related disorders: new challenges[J]. Genes (Basel), 2020, 11: 619. DOI:10.3390/genes11060619 |
| [6] |
Sareen A, Ramphul M, Bhatt JM. It's not all about inhaled treatment: challenges with oral therapy in paediatric respiratory medicine[J]. Breathe (Sheff), 2021, 17: 210005. DOI:10.1183/20734735.0005-2021 |
| [7] |
VanDevanter EJ, Heltshe SL, Skalland M, et al. The effect of oral and intravenous antimicrobials on pulmonary exacerbation recovery in cystic fibrosis[J]. J Cyst Fibros, 2021, 20: 932-936. DOI:10.1016/j.jcf.2021.02.012 |
| [8] |
Guo ZR. Preparation of evacetor for the treatment of cystic fibrosis[J]. Acta Pharm Sin (药学学报), 2020, 55: 2746-2750. |
| [9] |
Wendekier C, Wendekier-Raybuck K. Cystic fibrosis: a changing landscape[J]. Nursing, 2021, 51: 32-38. |
| [10] |
Volkova N, Moy K, Evans J, et al. Disease progression in patients with cystic fibrosis treated with ivacaftor: data from national US and UK registries[J]. J Cyst Fibros, 2020, 19: 68-79. DOI:10.1016/j.jcf.2019.05.015 |
| [11] |
Cheng PC, Alexiou S, Rubenstein RC. Safety and efficacy of treatment with lumacaftor in combination with ivacaftor in younger patients with cystic fibrosis[J]. Expert Rev Respir Med, 2019, 13: 417-423. DOI:10.1080/17476348.2019.1602040 |
| [12] |
Paterson SL, Barry PJ, Horsley AR. Tezacaftor and ivacaftor for the treatment of cystic fibrosis[J]. Expert Rev Respir Med, 2020, 14: 15-30. DOI:10.1080/17476348.2020.1682998 |
| [13] |
Lommatzsch ST, Taylor-Cousar JL. The combination of tezacaftor and ivacaftor in the treatment of patients with cystic fibrosis: clinical evidence and future prospects in cystic fibrosis therapy[J]. Ther Adv Respir Dis, 2019, 13: 1753466619844424. |
| [14] |
Hoy SM. Elexacaftor/ivacaftor/tezacaftor: first approval[J]. Drugs, 2019, 79: 2001-2007. DOI:10.1007/s40265-019-01233-7 |
| [15] |
Middleton PG, Mall MA, Dřevínek P, et al. Elexacaftor-tezacaftor-ivacaftor for cystic fibrosis with a single Phe508del allele[J]. N Engl J Med, 2019, 381: 1809-1819. DOI:10.1056/NEJMoa1908639 |
| [16] |
Southern KW, Clancy JP, Ranganathan S. Aerosolized agents for airway clearance in cystic fibrosis[J]. Pediatr Pulmonol, 2019, 54: 858-864. DOI:10.1002/ppul.24306 |
| [17] |
Khan MA, Ali ZS, Sweezey N, et al. Progression of cystic fibrosis lung disease from childhood to adulthood: neutrophils, neutrophil extracellular trap (NET) formation, and NET degradation[J]. Genes (Basel), 2019, 10: 183. DOI:10.3390/genes10030183 |
| [18] |
Velino C, Carella F, Adamiano A, et al. Nanomedicine approaches for the pulmonary treatment of cystic fibrosis[J]. Front Bioeng Biotechnol, 2019, 7: 406. DOI:10.3389/fbioe.2019.00406 |
| [19] |
Loebinger MR, Polverino E, Chalmers JD, et al. Efficacy and safety of TOBI Podhaler in Pseudomonas aeruginosa-infected bronchiectasis patients: iBEST study[J]. Eur Respir J, 2021, 57: 2001451. DOI:10.1183/13993003.01451-2020 |
| [20] |
Taccetti G, Francalanci M, Pizzamiglio G, et al. Cystic fibrosis: recent insights into inhaled antibiotic treatment and future perspectives[J]. Antibiotics (Basel), 2021, 10: 338. DOI:10.3390/antibiotics10030338 |
| [21] |
Elson EC, Mermis J, Polineni D, et al. Aztreonam lysine inhalation solution in cystic fibrosis[J]. Clin Med Insights Circ Respir Pulm Med, 2019, 13: 1179548419842822. |
| [22] |
Zhu C, Chen J, Yu S, et al. Inhalable nanocomposite microparticles with enhanced dissolution and superior aerosol performance[J]. Mol Pharm, 2020, 17: 3270-3280. DOI:10.1021/acs.molpharmaceut.0c00390 |
| [23] |
Sun Z, Palzkill T. Deep mutational scanning reveals the active-site sequence requirements for the colistin antibiotic resistance enzyme MCR-1[J]. mBio, 2021, 12: e0277621. DOI:10.1128/mBio.02776-21 |
| [24] |
El-Sayed Ahmed MAE, Zhong LL, Shen C, et al. Colistin and its role in the era of antibiotic resistance: an extended review (2000-2019)[J]. Emerg Microbes Infect, 2020, 9: 868-885. DOI:10.1080/22221751.2020.1754133 |
| [25] |
Yeh HI, Qiu L, Sohma Y, et al. Identifying the molecular target sites for CFTR potentiators GLPG1837 and VX-770[J]. J Gen Physiol, 2019, 151: 912-928. DOI:10.1085/jgp.201912360 |
| [26] |
Liu F, Zhang Z, Levit A, et al. Structural identification of a hotspot on CFTR for potentiation[J]. Science, 2019, 364: 1184-1188. DOI:10.1126/science.aaw7611 |
| [27] |
Van der Plas SE, Kelgtermans H, Mammoliti O, et al. Discovery of GLPG2451, a novel once daily potentiator for the treatment of cystic fibrosis[J]. J Med Chem, 2021, 64: 343-353. DOI:10.1021/acs.jmedchem.0c01796 |
| [28] |
Grand DL, Gosling M, Baettig U, et al. Discovery of icenticaftor (QBW251), a cystic fibrosis transmembrane conductance regulator potentiator with clinical efficacy in cystic fibrosis and chronic obstructive pulmonary disease[J]. J Med Chem, 2021, 64: 7241-7260. DOI:10.1021/acs.jmedchem.1c00343 |
| [29] |
Kazani S, Rowlands DJ, Bottoli I, et al. Safety and efficacy of the cystic fibrosis transmembrane conductance regulator potentiator icenticaftor (QBW251)[J]. J Cyst Fibros, 2021, 20: 250-256. DOI:10.1016/j.jcf.2020.11.002 |
| [30] |
Kerem E. ELX-02: an investigational read-through agent for the treatment of nonsense mutation-related genetic disease[J]. Expert Opin Investig Drugs, 2020, 29: 1347-1354. DOI:10.1080/13543784.2020.1828862 |
| [31] |
Crawford DK, Alroy I, Sharpe N, et al. ELX-02 generates protein via premature stop codon read-through without inducing native stop codon read-through proteins[J]. J Pharmacol Exp Ther, 2020, 374: 264-272. DOI:10.1124/jpet.120.265595 |
| [32] |
Singh AK, Fan Y, Balut C, et al. Biological characterization of F508delCFTR protein processing by the CFTR corrector ABBV-2222/GLPG2222[J]. J Pharmacol Exp Ther, 2020, 372: 107-118. DOI:10.1124/jpet.119.261800 |
 2022, Vol. 57
2022, Vol. 57


