病毒是一类不具有细胞结构、只含有一种核酸(DNA或RNA) 的微生物, 由一个核酸长链和蛋白质外壳构成, 没有自身的代谢机构及酶系统, 必须寄生在活细胞内并通过宿主细胞进行复制、增殖。每一次病毒性传染病的暴发都对人类的健康以及经济活动造成了巨大的威胁和损害。公元165年, 一场天花席卷了罗马帝国并肆虐了15年, 夺走了数百万罗马公民的生命。在此之后, 天花在世界各地时有发生, 累计已夺取上亿人的生命; 1918年一场席卷全球的西班牙大流感造成了至少2 000万人死亡, 成为历史上死亡人数最多的一次疫情; 近几年多次在非洲暴发的埃博拉出血热使近千名患者死亡; 全球范围内多次暴发的麻疹疫情[1]已造成数十万患者死亡。而如今出现的新型冠状病毒肺炎(corona virus disease 2019, COVID-19)[2]更是给当今世界和人类发出了新的挑战, 从2019年底暴发至今, 累计确诊病例已超过4亿, 其中死亡病例约607万(截至2022年3月21日)[3]。除此之外, 病毒感染与肿瘤[4]、先天性畸形[5]、神经系统疾病如帕金森病[6]等也有一定的关系。
目前已经有多种药物用于治疗病毒感染, 然而大部分抗病毒药物是针对单个病毒编码的病毒特异性靶点抑制剂。这些抑制剂通常会导致病毒变异为耐药毒株, 如新型冠状病毒的变异毒株德尔塔及奥密克戎毒株。除易引起病毒变异产生耐药性外, 现有的抗病毒药物还存在治疗窗口窄的问题[7]。因而, 亟待科学家们发现具有广谱抗病毒作用的药物, 特别是针对新靶点新机制的抗病毒新药。
开发靶向激酶的抑制剂是发现广谱抗病毒药物的重要方法。大量经FDA批准的激酶抑制剂再利用, 是一种潜在的抗病毒治疗策略。如图 1所示, 22个已报道的具有抗病毒活性的激酶抑制剂, 其中有8个酪氨酸激酶抑制剂已经用于抗病毒临床试验研究。此外, 4个酪氨酸激酶抑制剂: afatinib、ibrutinib、osimertinib和zanubrutinib虽未见其抗病毒活性的相关报道, 但是已经用于抗病毒的临床研究。相关研究表明, 激酶抑制剂的抗病毒研究具有巨大的潜力[7-10]。
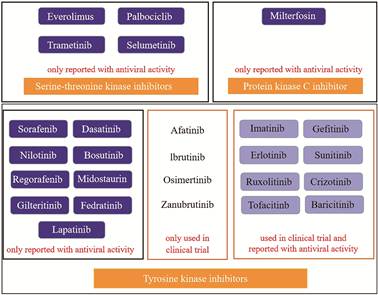
|
Figure 1 Kinase inhibitors possess antiviral activity or are useful in the management of viral infections[10] |
宿主细胞的质膜是病毒进入细胞必须克服的第一道物理屏障。病毒只有穿过这个屏障才能将其遗传物质递送到细胞质内, 实现在细胞质内的复制, 引发感染。如果成功阻碍其进入细胞, 就可将病毒拒于宿主细胞之外。一些病毒通过与质膜的直接融合来实现细胞穿透, 如单纯疱疹病毒1型(HSV-1)、仙台(Sendai) 病毒和人类免疫缺陷病毒(human immunodeficiency virus, HIV, 即艾滋病病毒), 而大部分病毒则通过内吞途径进入宿主细胞[11-15]。已知的内吞作用方式主要有以下4种: ①网格蛋白介导型内吞作用(clathrin-mediated endocytosis, CME); ②胞膜窖介导型内吞作用(caveolin-mediated endocytosis); ③网格蛋白和胞膜窖非依赖型内吞作用(clathrin and caveolin-independent endocytosis); ④巨胞饮作用(macropinocytosis)。其中, CME是病毒进入宿主细胞最常见的途径[16]。1980年, Helenius等[17]在研究塞姆利基森林病毒(Semliki forest virus, SFV) 进入幼年仓鼠肾细胞(baby hamster kidney cells, BHK-21) 的过程中首次证明这一感染途径。抑制此途径可阻断病毒进入宿主细胞, 从而抑制病毒感染。
所有哺乳动物细胞中均存在CME作用, 是胞外物质进入细胞内最广泛的途径之一。网格蛋白是由分子质量约为192 kDa的重链和分子质量为33~35 kDa的轻链组成的二聚体, 呈三脚架样结构。在细胞内吞的初期, 网格蛋白构成一个多面体的晶格作为机械支架, 当病毒入侵时, 不能与细胞质膜成分直接结合, 而是需要网格蛋白衔接蛋白(adaptor protein, AP-2) 介导。质膜上的受体蛋白通过衔接蛋白AP-2聚集, 然后介导网格蛋白结合在AP-2的另一端, 使质膜产生内陷, 最终从质膜上脱离进入胞质, 形成网格蛋白包被囊泡(clathrin-coated vesicles, CCV)。随后, CCV被动力蛋白(dynamin) 剪切, 进入细胞内[18, 19]。AP-2参与膜受体的识别, 同时能与网格蛋白结合, 介导病毒从质膜到内体的运输过程。由此可见, 衔接蛋白家族成员之一的AP-2蛋白在CME过程中发挥着不可或缺的作用。如前文所述AP-2是一种在CCV形成中起连接作用的蛋白质, 而在CME过程中AP-2的招募受到磷酸化/去磷酸化循环调控[20]。Conner等[21]首先鉴定并证明衔接子相关蛋白激酶1 (adaptor-associated protein kinase 1, 也称为AP-2-associated protein kinase 1, 简称AAK1), 是调控AP-2蛋白复合物的特异性关键激酶。AAK1介导网格蛋白的内吞作用过程如图 2所示。

|
Figure 2 Adaptor-associated protein kinase 1 (AAK1)-mediated clathrin endocytosis |
AAK1的命名与AP-2相关。AAK1是丝氨酸/苏氨酸激酶, 属于Numb相关蛋白激酶(Numb-associated kinase, NAKs) 家族。该激酶家族的其他成员包括BMP-2诱导激酶(BMP-2-inducible kinase, BIKE/BMP2K)、细胞周期蛋白G相关激酶(cyclin G-associated kinase, GAK) 和肉豆蔻酰化和棕榈酰化丝氨酸苏氨酸激酶1 (myristoylated and palmitoylated Ser/Thr kinase 1, MPSK1, 又称STK16)。
成熟的AP-2分子是一个异源四聚体结构, 由两个结构上相关联的大亚基α和β2 (接近100~130 kDa), 一个中亚基μ2 (约50 kDa) 和一个小亚基单位σ2 (17~20 kDa) 组成。AAK1是调控AP-2蛋白μ2亚基(AP2M1) 第156位苏氨酸(T156) 磷酸化的特异性关键激酶。AAK1介导的AP-2蛋白μ2亚基磷酸化能够确保AP-2蛋白对货物膜蛋白分选信号的高亲和力。该位点被磷酸化后, 有利于μ2亚基保持开放构象, 便于其与质膜结构结合[22]。由此可见, 在CME过程中, AP-2蛋白μ2亚基T156的磷酸化水平高低决定了CME过程的顺利进行。因此, AAK1对CME过程起着至关重要的作用。亦有报道表明[23], 虽然AAK1在体外与AP-2稳定结合, 并特异性靶向AP2M1, 但在体内的μ2磷酸化并不因野生型或非活性的AAK1的过度表达而改变。因此AAK1需要被激活后方能发挥其调控作用。AAK1可以与网格蛋白直接结合, 并且AAK1自身的激酶活性也可以在与网格蛋白结合后被激活, 进而在CME过程中形成了正反馈的信号通路环, 以增强AP-2介导的网格蛋白的招募, 从而起到协助病毒入侵的作用。
相关文献还报道了AAK1其他的一些生物学功能。AAK1通过调节转铁蛋白内化和快速循环, 在内体途径的多个步骤发挥作用, 包括来自早期核内体的受体循环和参与蛋白质降解的途径[24]。此外, AAK1结合并磷酸化Numb (一种内吞蛋白, 会影响CCV的形成) 来调控内吞活性[25]。Gupta-Rossi等[26]发现AAK1是Notch通路的正调控因子。因此, 靶向AAK1是调控内吞作用的关键因素之一。Kuai等[27]发现天然产物K252a (1) 对AAK1有抑制作用, Sorrell等[28]首次报道AAK1和K252a的复合物的共晶结构(图 3)。这一共晶结构为后续设计和优化AAK1抑制剂提供了有力支撑。
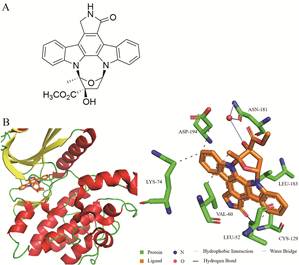
|
Figure 3 A: The chemical structure of K252a (1). B: Interaction of K252a with AAK1 (PDB code: 4wsq). Inhibitors are shown in stick representation with orange carbon atoms. Hydrogen bonds are indicated by blue lines. Key interacting residues are shown and labeled |
据文献报道, AAK1与多种疾病相关。2012年, 美国Lexicon医药公司和Bristol-Myers Squibb (BMS) 公司发布的专利表明, AAK1抑制剂具有治疗疼痛的潜能[29-32]。2016年, Kostich等[33]首次报道AAK1抑制剂具有治疗神经性疼痛的作用。靶向AAK1的临床化合物LX9211 (2, 图 4) 已经完成与疼痛相关的Ⅰ期临床试验并表现出良好的安全性。这表明靶向AAK1的小分子抑制剂在临床上是安全可靠的[34, 35]。
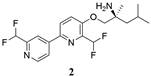
|
Figure 4 The chemical structure of AAK1 inhibitor clinical candidate LX9211 |
靶向AAK1除了具有治疗疼痛的作用之外, 还具有潜在的抗病毒作用。2012年, Neveu等[36]提出AAK1抑制剂具有抗丙型肝炎病毒的作用。随后, Einav等[37]申请的美国专利明确提出, AAK1抑制剂可破坏丙型肝炎病毒(hepatitis C virus, HCV) 的装配和HIV-1的复制。但是, AAK1的抗病毒作用一直以来似乎没有得到科学家们的重视, 其相关研究鲜有文献报道。直到2019年新型冠状病毒暴发以来, 科研工作者积极探索各种机制的抗病毒治疗方案, 对AAK1抑制剂抗病毒作用也更加重视。
2.2 AAK1与不同病毒的作用机制 2.2.1 AAK1作用于HCV的机制HCV是由英国科学家Houghton团队等于1989年发现的一种包膜阳性单链RNA病毒[38, 39]。全球约有5 800万人患有慢性丙型肝炎且每年新增约150万例, 其中有一部分是无症状的感染人群。而无症状的丙型肝炎可进一步发展转化为严重的肝脏疾病, 包括肝硬变和肝细胞癌[40]。2016年5月, 世界卫生组织大会通过了首份《2016-2021年全球卫生部门病毒性肝炎战略》, 旨在预防和消除病毒性肝炎这一公共卫生问题。深入了解AAK1对HCV病毒的作用机制, 能够帮助科研工作者们在这一领域取得新的进展。
2012年, Neveu等[36]在HCV病毒的核心蛋白中发现了一个保守的YXXΦ基序(Φ是一个庞大的疏水残基)。通过将YXXΦ突变、沉默AP2M1表达或过表达显性阴性AP2M1突变体, 发现其对HCV的RNA复制并无影响, 但显著抑制细胞内和细胞外的感染。作者运用微流体亲和力分析、蛋白质片段互补分析和感染细胞中的免疫共沉淀手段证明了该基序介导了HCV病毒核心与AP2M1结合, 这种结合是HCV组装必不可少的。在此之前并无AAK1和GAK介导病毒感染的报道, 作者提出AAK1和GAK调控核心-AP2M1的结合, 以及具有AAK1药理活性的抑制剂苏尼替尼会破坏这种结合(IC50 = 0.045 ± 0.02 μmol·L-1), 进而显著抑制HCV的组装和传染性病毒的产生。这些结果对HCV组装机制的理解和设计新的抗病毒药物具有指导意义。其中, 苏尼替尼和厄洛替尼是一种新型多靶向性的酪氨酸激酶抑制剂, 最先批准用于癌症的治疗。苏尼替尼、厄洛替尼和AAK1与GAK结合的解离常数(Kd) 分别为11 nmol·L-1和3.1 nmol·L-1 [41]。
2015年, Neveu等[42]进一步通过研究证实: 不同于AAK1在HCV组装中的作用, AAK1是调控HCV进入的关键宿主因子。表皮生长因子受体(epidermal growth factor, EGFR) 内吞的调节以及AP2M1和Numb的磷酸化是AAK1和GAK介导HCV进入的机制。AAK1或GAK的缺失损害了表皮生长因子(EGF) 介导的增强型HCV进入和EGFR的内吞作用。而EGFR是HCV进入的辅助因子, 也是厄洛替尼的靶点。此外, 作者还发现RNA干扰介导的AP2M1或Numb的耗尽, 或其磷酸化位点突变体的过度表达均可抑制HCV的进入。总之, 这些结果证实了AAK1和GAK是HCV进入细胞的关键调节因子, 苏尼替尼和厄洛替尼(除EGFR之外) 的抗病毒药效是对AAK1和GAK抑制的结果。
AAK1既可以作用于HCV的组装和进入, 还能调控HCV的运输和释放。质膜内运输是被病毒劫持的许多细胞过程之一。膜的运输部分依赖于APs和跨膜货物之间的相互作用, APs定位于不同的细胞内隔间, 并以不同的途径介导质膜运输[43]。Benedicto等[44]首次证明了网格蛋白参与丙型肝炎病毒从受感染的细胞中排出。其中, 网格蛋白干扰导致了HCV核心颗粒从早期的内体重新分布到溶酶体。Einav课题组[45]进一步证明了AAK1和GAK调控的AP-1活性在HCV释放过程中的作用, 并证明了HCV颗粒在活细胞中与AP-1和AP-2特异性地协同通信。Einav课题组[46]研究发现宿主激酶AAK1和GAK通过控制网格蛋白相关的AP来调节HCV感染。非结构蛋白2 (NS2) C端的两个的双亮氨酸基序介导了与AP-1A、AP-1B和AP-4结合, 从而释放HCV。通过感染性和共培养实验表明, 虽然3个接头都介导了HCV的释放和无细胞传播, 但AP-1B和AP-4 (而不是AP-1A) 介导了细胞间的传播。活细胞成像显示, HCV与AP-1A、AP-1B和AP-4共转运, 并且AP-4介导HCV在高尔基体后间隔内的转运。为了确定NS2-AP-1B结合和HCV细胞间扩散是否可以被药理学抑制, 并进一步验证抑制AAK1和GAK与抗病毒药效的关系, 采用选择性的AAK1抑制剂和GAK抑制剂处理细胞, 结果和预测的一致。由于丙型肝炎病毒的细胞间传播受到AAK1和GAK的调节, 因此对AAK1和GAK抑制剂的治疗具有敏感性。AAK1和GAK参与的HCV无细胞和细胞间扩散的调控, 为研究者提供了对HCV在不同释放途径中运输机制的理解, 并揭示了在细胞间病毒传播中AP的作用。
2.2.2 AAK1作用于DENV的机制登革热病毒(dengue virus, DENV) 是黄病毒科的一种单股正链RNA病毒。登革热病毒有4个血清型(DENV1~DENV4), 不同血清型之间氨基酸序列的同源性为65%~70%。感染某一种血清型的登革热病毒引起的疾病严重程度不同, 从无症状感染至症状较轻的登革热, 还有严重的登革出血热和登革休克综合征[47]。截止目前尚无有效的疫苗或抗病毒药物[48]。全球只有三家公司研制的登革热疫苗进入临床阶段, 分别是赛诺菲巴斯德公司研制的四价嵌合疫苗CYD-TDV、美国变态反应与传染病研究所研制的TV003/TV005疫苗和日本武田制药公司的四价嵌合疫苗DENVax[49]。在缺乏抗病毒药物或疫苗的情况下, 迫切需要开发一种有效的抗病毒策略来对抗这种病毒病原体。因此, 了解DENV感染的机制对于帮助制定治疗策略是必要的。
2017年, Einav课题组[45]报道了AP-1和AP-2复合物以及AAK1和GAK在黄病毒科家族成员进入、组装和释放中的作用, 并进一步验证了这些宿主因子是广谱抗病毒治疗的潜在靶点。研究发现苏尼替尼/厄洛替尼组合也是一种潜在的抗DENV策略, 比直接作用抗病毒药物具有更高的耐药性, 这种组合在体外限制了DENV感染, 降低了相关小鼠模型中的病毒血症、发病率和死亡率, 可阻断4种DENV血清型和多种病毒生命周期的进入和后期阶段。证实了苏尼替尼和厄洛替尼介导的对AAK1和GAK活性的抑制是抗病毒作用的重要机制。这说明两种药物苏尼替尼和厄洛替尼既可作为识别病毒感染中重要宿主因子的工具, 也可作为对抗新病毒感染的潜在治疗方法。Einav课题组[45]选取了两个母核结构为咪唑并[1, 2-b]哒嗪的AAK1抑制剂和两个母核结构为异噻唑并[5, 4-b]吡啶的GAK抑制剂。这4个化合物对大多数苏尼替尼和厄洛替尼的癌症靶标(如VEGFR和EGFR) 缺乏亲和力, 而对2型DENV感染具有剂量依赖性抑制, EC50值在1.5~5.1 μmol·L-1之间, 这也进一步证实了AAK1和GAK是潜在的抗病毒靶标。
苏尼替尼和厄洛替尼介导的对AAK1和GAK活性的抑制是抗病毒作用的一个重要机制, 而抗病毒作用的其他机制尚未完全确定。Pu等[50]整合体外和体内的数据进一步证实了使用苏尼替尼/厄洛替尼联合治疗病毒感染的可行性。研究表明, 在感染DENV时, AAK1的表达量与病毒丰度具有直接相关性, 而GAK的表达量与病毒的丰度水平不相关, AAK1可能是治疗登革热病毒感染的一个非常重要的靶标, 为AAK1的抗病毒作用的机制提供了更深入的理解。
Tongmuang等[51]发现在人肝癌(Huh7) 细胞中, AP2M1的敲除能减少被感染的细胞外DENV的产生。为了表征AP2M1在DENV复制进入后阶段的作用, 作者绕过病毒进入细胞的步骤, 将裸露的DENV RNA转染到AP2M1敲低的细胞中, 发现增加了细胞内病毒粒子, 但减少了细胞外病毒的产生。这些证据证实敲除AP2M1会影响DENV的释放。研究还发现在DENV感染的Huh7细胞中, 用苏尼替尼治疗能够减少细胞外病毒粒子的产生以及抑制所有血清型中DENV的产生。
Verdonck等[52]研究发现AAK1在登革热病毒感染细胞中过表达, 但在其他细胞并不过度表达。研究中发现了低纳摩尔AAK1结合亲和力的AAK1抑制剂显示了对DENV的抗病毒活性。此外, 优化后的AAK1抑制剂在DENV感染的原发树突细胞和抗EBOV (埃博拉病毒中最烈性的泛嗜性的病毒) 活性中表现出非常强的活性。因而, 可开发基于AAK1抑制的广谱抗病毒药物。
2.2.3 AAK1作用于RABV的机制狂犬病病毒(rabies virus, RABV) 是引起人和动物的一种致命性神经系统疾病。了解RABV感染机制对狂犬病毒感染的防治具有重要意义。Wang等[53]进行了高通量RNAi分析, 确定AAK1是调节狂犬病病毒进入细胞的重要成分。AAK1基因敲除能显著抑制RABV对细胞的感染, AAK1诱导的RABV进入需要AAK1诱导的AP2M1苏氨酸156的磷酸化。虽然GAK也能磷酸化AP2M1[54], 但是在体外检测到GAK siRNA敲除对细胞中对RABV感染的抑制作用较小, 而对GAK具有高亲和力的厄洛替尼几乎不能抑制细胞RABV的感染。而苏尼替尼抑制AAK1活性可阻断AP2M1磷酸化, 并显著抑制RABV感染, 阻止RABV早期进入内体。这些结果表明, RABV进入需要AP2M1磷酸化, 主要由AAK1引起, 而不是GAK。在动物体内研究结果表明, 苏尼替尼可以延长受RABV感染的小鼠的存活时间。这表明AAK1是一种潜在的暴露后预防狂犬病的药物靶点。
Luo等[55]发现神经母细胞瘤(mouse neuroblastoma N2a cells, 简称N2a细胞) 细胞感染RABV后, 细胞中AAK1的转录和表达增加。AAK1基因敲除可显著降低RABV在N2a和BHK-21细胞中的感染, 使用苏尼替尼抑制AAK1活性也可降低RABV感染。但是, AAK1过表达并不能改变RABV在体外的感染情况, 应用苏尼替尼治疗不能显著提高小鼠在致死性RABV攻击后的存活率。这些结果表明RABV的感染依赖于AAK1, 抑制AAK1是一种潜在的狂犬病防治策略。
2.2.4 AAK1作用于SARS-CoV-2的可能机制严重急性呼吸系统综合症冠状病毒2 (severe acute respiratory syndrome coronavirus 2, SARS-CoV-2) 引起新型冠状病毒肺炎是目前生物医学界面临的最大公共卫生挑战。SARS-CoV-2是一个阳性的单链RNA病毒粒子, 主要结构蛋白是刺突蛋白(S)、膜蛋白(M)、包膜蛋白(E) 和核衣壳蛋白(N)[56]。同源三聚体S蛋白是病毒融合和识别的关键蛋白, 糖基化的S蛋白由S1和S2亚基组成。S1亚基与血管紧张素转换酶2 (angiotensin-converting enzyme 2, ACE-2) 受体相互作用, 并通过受体结合域(receptor binding domain, RBD) 决定细胞的趋向性, S2亚基通过七肽重复序列1 (HR1) 和七肽重复序列2 (HR2) 参与病毒融合。S1与ACE-2的相互作用促进了S1的解离和融合前亚稳定S2向更稳定的融合后形式转变。SARS-CoV-2进入宿主细胞可通过融合和内吞途径介导。融合机制通常是通过RBD识别ACE-2受体, 随后S蛋白与ACE-2的相互作用, 通过跨膜丝氨酸蛋白酶2将S蛋白在S1/S2切割位点切割, 激活S蛋白进入S1和S2[49]。
Akbarzadeh-Khiavi等[57]总结了SARS-CoV-2的内吞作用的两种可能机制。第一种是病毒与质膜外的ACE-2受体结合, 内吞过程是通过在质膜的内侧组装网格蛋白、外壳蛋白, 形成一个囊泡。第二种是SARS-CoV-2直接利用网格蛋白依赖的内吞作用进入宿主细胞。病毒进入后, 病毒RNA被释放到细胞质空间中, 在感染细胞中启动结构和非结构蛋白的产生。最后, 冠状病毒的病毒粒子通过出芽进入内质网-高尔基体中间隔室而形成, 并作为新的病毒颗粒释放出来。通过对这两种可能机制的分析, AAK1可能影响SARS-CoV-2病毒的组装和进入。
2.3 抗病毒作用的AAK1抑制剂研究进展AAK1是一种潜在的抗病毒生物靶点。截至目前, 尚无AAK1抑制剂获批用于抗病毒适应症。本文系统总结了文献报道的及专利公布的具有抗病毒作用的AAK1抑制剂的结构及抗病毒活性, 为后续开发靶向AAK1的抗病毒药物的研究提供参考。
本文从以下两个方面进行总结讨论: 一是在“老药新用”这一策略上选出的两个非特异性的AAK1抑制剂——苏尼替尼和巴瑞替尼。苏尼替尼是已经获批的抗癌药物, 虽然不是特异性的AAK1抑制剂, 但对AAK1具有较好的活性并且在研究AAK1的抗病毒机制中显示了重要作用, 一直受到科研工作者的关注。巴瑞替尼则是另一个对AAK1具有较好活性的上市抗癌药物。2019年新型冠状病毒暴发后, 才走进人们视野。二是文献和专利中披露的具有抗病毒活性的特异性的AAK1抑制剂。
2.3.1 具有抗病毒作用的“老药新用”的AAK1抑制剂的结构及抗病毒活性 2.3.1.1 苏尼替尼苏尼替尼(sunitinib, 3, 图 5) 是由辉瑞公司开发的酪氨酸激酶抑制剂, 除了抑制VEGFR2和血小板衍生生长因子受体β (platelet-derived growth factor receptor β, PDGFRβ) 外, 也可以抑制AAK1。2006年被FDA批准用于胃肠道间质瘤(GIST) 和肾细胞癌(RCC) 的治疗。如前文所述, 苏尼替尼对AAK1具有纳摩尔级别的亲和力, 已被广泛用于研究AAK1在病毒感染中的作用[58]。Einav课题组[45]发现苏尼替尼对多种病毒均表现出广谱的抗病毒活性(表 1), 除黄病毒科的HCV、DENV、西尼罗河病毒(West Nile virus, WNV)、寨卡病毒(Zika virus, ZIKV) 外, 还包括其他病毒科的病毒, 如纤丝病毒科的埃博拉病毒(Ebola virus, EBOV)、披膜病毒科的基孔肯雅病毒(Chikungunya virus, CHIKV)、沙粒病毒科的朱宁病毒(Junin virus)、逆转录病毒科的HIV、副粘病毒科的呼吸道合胞体病毒(respiratory syncytial virus, RSV)。对大部分病毒的EC50值均低于1 μmol·L-1, CC50值均大于10 μmol·L-1。CC50值越大, 表示化合物对正常细胞的毒性越小, 安全性越好。
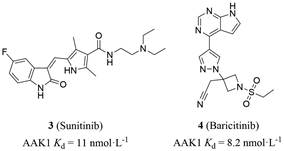
|
Figure 5 Structures of sunitinib and baricitinib and their dissociation constant (Kd) for AAK1 |
| Table 1 Antiviral activity of sunitinib[45]. EC50: Half-maximal effective concentration; CC50: Half-maximal cellular cytotoxicity; HCV: Hepatitis C virus; DENV: Dengue virus; WNV: West Nile virus; ZIKV: Zika virus; EBOV: Ebola virus; JUNV: Junin virus; HIV: Human immunodeficiency virus; RSV: Respiratory syncytial virus; CHIKV: Chikungunya virus |
巴瑞替尼(barictinib, 4, 图 5) 是一种JAK1/JAK2抑制剂, 由Incyte公司发现并由Eli Lilly and Company许可开发和销售, 于2018年被FDA批准用于治疗类风湿关节炎。早在2016年, Sorrell等[28]就发现巴瑞替尼对AAK1具有很强的抑制作用, 通过等温滴定量热法(isothermal titration calorimetry, ITC) 测量结果显示, 巴瑞替尼对AAK1的Kd值达到17.2 nmol·L-1。近期Stebbing团队[59]利用BenevolentAI公司特有的数据库和人工智能算法, 对上市的药品进行计算和分析, 提出巴瑞替尼可能会阻断病毒感染的过程, 预计其会降低病毒感染肺细胞的能力。后来, 该团队评估了巴瑞替尼在相关白细胞亚群中的体外药理学及其体内药代动力学数据, 并发现其抑制了与新型冠状病毒肺炎感染相关的细胞因子的信号传导。作者验证了AI预测的巴瑞替尼对人类NAKs家族成员具有生化抑制作用, 同时测定出巴瑞替尼对AAK1的Kd值为8.2 nmol·L-1 [60], 表明巴瑞替尼可能对表达NAKs的宿主细胞具有抑制作用。作者还发现巴瑞替尼与直接靶向抗病毒药物联合使用可以降低病毒的感染、复制以及异常的宿主炎症反应[61]。
Zhang等[62]表明巴瑞替尼不仅可以通过与AAK1和GAK结合, 中断SARS-CoV-2进入靶细胞的通道和细胞内组装, 而且巴瑞替尼有望通过抑制JAK1/JAK2信号通路来治疗新型冠状病毒肺炎引起的细胞因子风暴。
关于巴瑞替尼在新型冠状病毒肺炎治疗中的作用, 通过检索美国FDA临床数据库官网, 截止到目前(2022年3月22日) 共有26项临床试验, 其中有5项已经完成Ⅱ/Ⅲ期临床试验(NCT04421027、NCT04358614、NCT04362943、NCT04401579、NCT04640168)。巴瑞替尼和抗病毒药物瑞德西韦联用可能是合适的联合治疗策略。研究者曾担心这种联合治疗方案存在如免疫抑制、继发感染和血栓形成等不良反应风险。值得庆幸的是, 临床试验中显示出较少的可以接受的不良反应。
2.3.2 文献和专利中披露的具有抗病毒活性的特异性AAK1抑制剂文献报道的具有抗病毒活性的特异性的AAK1抑制剂很少, 主要是Lexicon制药公司研发的咪唑并[1, 2-b]哒嗪类化合物(5、6)[45, 46], 以及Verdonck等[52]于2019报道过AAK1抑制剂。在发明专利方面, Lexicon医药公司和BMS公司是主要的研究机构, 申请和公开了绝大多数AAK1抑制剂专利。近期, Martinez-Gualda等[63]对AAK1专利进行了综述。Lexicon医药公司也公开了两个新的AAK1抑制剂抗病毒的专利, 这表明AAK1正在成为抗病毒领域的潜在的新生物靶点, 将会迎来更大的研究前景。
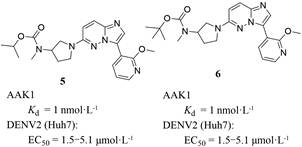
2.3.2.1 咪唑并[1, 2-b]哒嗪类Lexicon制药公司研发的咪唑并[1, 2-b]哒嗪类化合物5和6 (图 6), 对AAK1的Kd值均达到了1 nmol·L-1, 对2型DENV感染具有剂量依赖性抑制, EC50值在1.5~5.1 μmol·L-1。
|
Figure 6 Selective AAK1 inhibitors and their half-maximal effective concentration for DENV2[43] |
Verdonck等[52]从一种结构简单且具有AAK1活性的化合物开始, 开展了AAK1抑制剂优化工作, 并对优化后的化合物进行了抗病毒研究。先前, Bamborough等[64]采用DiscoverX结合分析格式对一组203个蛋白激酶进行了577个结构不同的化合物(代表激酶抑制剂化学空间) 的筛选实验。Verdonck等[52]从中确定了一种基于吡咯并[2, 3-b]吡啶(7-氮杂吲哚) (7) (Kd = 53 nmol·L-1) 结构的AAK1抑制剂作为研究的苗头化合物。早期Bamborough等[64]研究发现该化合物对AAK1的半数抑制活性(IC50 = 1.17 μmol·L-1) 和选择性(Ki = 541 nmol·L-1) 优于NAKs家族的其他3种激酶。Verdonck等[52]为了分析该化合物的结合方式, 测定了该化合物与AAK1结合的晶体结构(PDB 5L4Q), 分辨率为2.0 Å (图 7)。测定的该化合物与AAK1的Kd值为120 nmol·L-1, 比Bamborough等[64]报道的Kd值偏大。该化合物在感染DENV2的Huh7细胞中也具有抗病毒活性(EC50 = 8.37 μmol·L-1)。

|
Figure 7 Crystal structure of AAK1 complexed with hit compound 7 (PDB code: 5L4Q). Inhibitor is shown in stick representation with magenta carbon atoms. Hydrogen bonds are indicated by blue lines. Key interacting residues are shown and labeled |
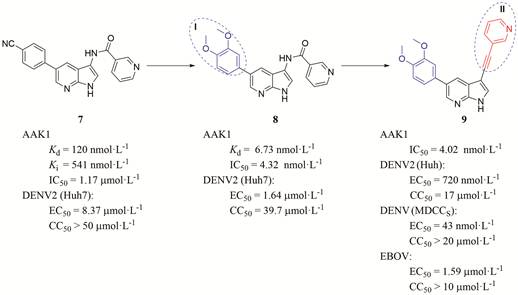
Verdonck等[52]在化合物7的结构基础上, 对其进行结构优化, 并研究其对AAK1的酶活性及抗病毒活性(图 8)。在所有酶活性和抗病毒实验中, 采用苏尼替尼作为阳性对照, 测试出苏尼替尼的Kd值为11 nmol·L-1, IC50为47 nmol·L-1, 对DENV具有强大的活性, EC50值为1.35 μmol·L-1。首先在保留母核结构和片段Ⅱ的结构基础上, 优化结构片段Ⅰ, 经过测试, 优化Ⅰ片段后的化合物, 在酶活性及抑制病毒的能力上均较苏尼替尼差, 其中Ⅰ片段为3, 4-二甲氧基苯基的化合物8 (图 8) 的AAK1酶活性的IC50值为4.32 nmol·L-1, 抗DENV病毒活性的IC50值为1.64 μmol·L-1, 已经接近阳性对照物的活性。接着作者在保留母核结构和片段Ⅰ为3, 4-二甲氧苯基的条件下, 继续优化片段Ⅱ结构, 当Ⅱ结构片段为3-吡啶乙炔基时化合物的活性最好。优化后的化合物AAK1酶活性的IC50值为4.02 nmol·L-1, 抗DENV病毒活性的IC50值为720 nmol·L-1。接下来该团队又尝试对母核结构区域进行改造, 但未得到活性更好的化合物。最终, 筛选出化合物9, 相比于苗头化合物及阳性对照物, 显示出更好的AAK1抑制活性, 对DENV也显示出更好的抗病毒活性。此外, 该化合物在DENV感染的原代树突状细胞中也表现出非常强的活性和抗EBOV活性, 支持了开发基于AAK1抑制的广谱抗病毒药物的潜力。
|
Figure 8 Optimization of compound 7 |
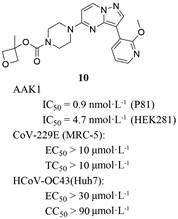
2015年, Lexicon医药公司公开了化合物10的相关专利[65]。专利报道该化合物基于放射活性酶(P81过滤板测定法) 和基于HEK281细胞测定AAK1的IC50值分别为0.9和4.7 nmol·L-1 (图 9)。近期, 该公司又在专利WO2021216454[66]中报道了该化合物的抗病毒活性数据。通过使人胚肺细胞(MRC-5) 细胞感染冠状病毒CoV-229E, 实验结果发现化合物对CoV-229E病毒抑制的EC50值大于10 μmol·L-1, 并且诱导MRC-5细胞死亡的TC50 (half toxicity concentration) 大于10 μmol·L-1。该化合物对冠状病毒HCoV-OC43病毒EC50值大于30 μmol·L-1, 细胞毒性实验显示该化合物对Huh7细胞的CC50值大于90 μmol·L-1。在实验中增加化合物的给药浓度, 发现感染了HCoV-OC43病毒的H292细胞活力增加, 而未感染HCoV-OC43病毒的H292细胞的活力不随浓度增加而增加, 说明该抑制剂在体外具有抗冠状病毒HCoV-OC43的潜力。
|
Figure 9 Structure of compound 10 |
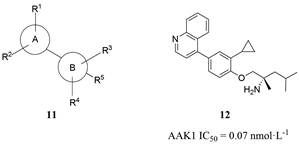
2015年, BMS公司公开了包含该化合物的母核结构为联芳基(图 10) 的激酶抑制剂专利[67]。其中A环是从吡啶、嘧啶或非芳香族3, 6-二氢-吡喃环中选择出来的。此外, A环也可以是一个融合的双环芳香族体系, 如喹啉、1、5-萘啶、1、6-萘啶和吡啶[2、3-b]吡啶。B环从苯基、吡啶、嘧啶或萘支架中选择。每个环都可以被各种各样的取代基取代, 如(异) 烷基、环烷基、烷氧基、腈基、卤化物、酰胺、氨基甲酸酯等。共公布了250个化合物, 并以荧光肽和ATP为底物对其进行体外AAK1酶测定, 数据以半数抑制浓度值表示。结果显示大部分化合物都具有非常强的AAK1抑制作用, 有80个化合物对AAK1的抑制活性的IC50值均低于1 nmol·L-1。其中, 对AAK1抑制活性最好的是化合物(S)-1-(2-环丙基-4-(喹啉-4-基) 苯氧基)-2, 4-二甲基戊-2-胺(12, IC50 = 0.07 nmol·L-1, 图 10)。
|
Figure 10 Biaryl scaffold and the representative compound 12 |
近期, Lexicon医药公司公开了化合物13 (图 11) 的抗病毒数据[68], 该化合物对AAK1的IC50值为2.2 nmol·L-1。通过使宿主细胞感染不同种类的病毒, 来检测化合物13抑制病毒感染的能力, 研究发现该化合物对不同种类病毒的感染有抑制作用(表 2), 部分能同时诱导宿主细胞死亡。研究中也发现增加化合物的给药浓度, 感染病毒的细胞活力增加, 而未感染病毒的细胞活力不随浓度增加而增加。从公开的专利数据可以看出该化合物具有广谱抗病毒的潜在可能。
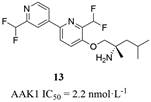
|
Figure 11 Structure of compound 13 |
| Table 2 Antiviral activity of compound 13. aUnless otherwise indicated, the EC50 and CC50 values are in μmol·L-1 |
AAK1作为NAKs家族中调控AP-2蛋白μ2亚基第156位苏氨酸磷酸化的特异性关键激酶, 在CME过程起着至关重要的作用。AAK1抑制剂的研发涉及两个领域, 一个是针对疼痛, 另一个是抗病毒。目前, 只有Lexicon和BMS两家公司活跃在这两个领域。在治疗疼痛的领域, 已取得了较大的进展, 已有化合物进行到临床Ⅱ期。虽然AAK1在病毒入侵的网格蛋白介导的内吞作用中发挥着关键性的作用, 但是, AAK1抑制剂在抗病毒领域中的研究仍不够深入。目前并没有AAK1抑制剂被批准用来治疗新出现的病毒感染, 如登革热病毒、埃博拉病毒及新型冠状病毒等。自2012年Neveu等[36]最先提出AAK1抑制剂具有抗丙型肝炎病毒的作用以来, 目前也只有屈指可数的几篇文献报道AAK1抑制剂的具有抗病毒活性。近期, 才由Lexicon医药公司新公布了两个AAK1抑制剂抗病毒的专利。
本文总结了AAK1在不同病毒中的作用机制以及专利、文献中已报道的具有抗病毒作用的AAK1小分子抑制剂, 讨论了药物分子的设计和优化等数据。文献数据表明, 优化后的AAK1抑制剂在DENV感染的原代树突状细胞中表现出非常强的活性和抗EBOV活性, AAK1的抑制剂具有广谱抗病毒的潜力。
然而AAK1抑制剂也靶向AAK1之外的多个其他激酶(包括NAKs家族的其他成员), 因此很难断定其抗病毒作用是否完全归因于对AAK1的抑制。因此寻找高选择性AAK1抑制剂并用于研究抗病毒机制是今后研究的重点和方向。由于AAK1与其他多种激酶的蛋白结构相近, 寻找高选择性、高特异性的AAK1抑制剂是药物化学家未来需要攻克的难题。而AAK1本身也是正常细胞维持必要的胞内运输的关键激酶, 如何降低AAK1抑制剂对正常细胞的不良反应也是一个挑战。在开发抗病毒的AAK1抑制剂药物时, 必须密切关注化合物的安全窗。总的来说, AAK1是一个有前景的抗病毒生物靶标。在新型冠状病毒暴发的背景下, 研发新机制和新靶点的抗病毒药物刻不容缓。期待在未来短时间内, 科学家们在AAK1抑制剂抗病毒领域取得突破性的进展, 造福人类。
作者贡献: 戚香、蒋松伟负责文献检索及论文撰写; 叶向阳和谢恬负责文章选题、指导写作; 惠子、袁滢惠、许丽负责修改及校对文章。
利益冲突: 本文无利益冲突。
| [1] |
Bozzola E, Spina G, Tozzi AE, et al. Global measles epidemic risk: current perspectives on the growing need for implementing digital communication strategies[J]. Risk Manag Healthc Policy, 2020, 13: 2819-2826. DOI:10.2147/RMHP.S201279 |
| [2] |
Tai L, Wong K, Wang L, et al. From impossible to possible: the lessons from the control of recent COVID-19 outbreaks in China[J]. Int J Biol Sci, 2021, 17: 1600-1612. DOI:10.7150/ijbs.58906 |
| [3] |
WHO. WHO Coronavirus (COVID-19) Dashboard [EB/OL]. Geneva: World Health Organization press, 2022 [2022-03-21]. https://covid19.who.int/.
|
| [4] |
Belluomini L, Caldart A, Avancini A, et al. Infections and immunotherapy in lung cancer: a bad relationship?[J]. Int J Mol Sci, 2021, 22: 42. |
| [5] |
Chudnovets A, Liu J, Narasimhan H, et al. Role of inflammation in virus pathogenesis during pregnancy[J]. J Virol, 2020, 95: e01381-19. |
| [6] |
Hsu TW, Chu CS, Tsai SJ, et al. Dengue virus infection and risk of Parkinson's disease: a nationwide longitudinal study[J]. J Parkinsons Dis, 2022, 12: 679-687. DOI:10.3233/JPD-212938 |
| [7] |
García-Cárceles J, Caballero E, Gil C, et al. Kinase inhibitors as underexplored antiviral agents[J]. J Med Chem, 2022, 65: 935-954. DOI:10.1021/acs.jmedchem.1c00302 |
| [8] |
Schor S, Einav S. Repurposing of kinase inhibitors as broad-spectrum antiviral drugs[J]. DNA Cell Biol, 2018, 37: 63-69. DOI:10.1089/dna.2017.4033 |
| [9] |
Pillaiyar T, Laufer S. Kinases as potential therapeutic targets for anti-coronaviral therapy[J]. J Med Chem, 2022, 65: 955-982. DOI:10.1021/acs.jmedchem.1c00335 |
| [10] |
Raghuvanshi R, Bharate SB. Recent developments in the use of kinase inhibitors for management of viral infections[J]. J Med Chem, 2022, 65: 893-921. DOI:10.1021/acs.jmedchem.0c01467 |
| [11] |
Barrow E, Nicola AV, Liu J. Multiscale perspectives of virus entry via endocytosis[J]. Virol J, 2013, 10: 177. DOI:10.1186/1743-422X-10-177 |
| [12] |
Smith AE, Helenius A. How viruses enter animal cells[J]. Science, 2004, 304: 237-242. DOI:10.1126/science.1094823 |
| [13] |
Mercer J, Schelhaas M, Helenius A. Virus entry by endocytosis[J]. Annu Rev Biochem, 2010, 79: 803-833. DOI:10.1146/annurev-biochem-060208-104626 |
| [14] |
Sieczkarski SB, Whittaker GR. Dissecting virus entry via endocytosis[J]. J Gen Virol, 2002, 83: 1535-1545. DOI:10.1099/0022-1317-83-7-1535 |
| [15] |
Pelkmans L, Helenius A. Insider information: what viruses tell us about endocytosis[J]. Curr Opin Cell Biol, 2003, 15: 414-422. DOI:10.1016/S0955-0674(03)00081-4 |
| [16] |
Zhou L, Yang X, Xu L, et al. Clathrin-mediated endocytosis and broad-spectrm antivirals[J]. J Int Pharm Res, 2013, 40: 43-47. |
| [17] |
Helenius A, Kartenbeck J, Simons K, et al. On the entry of semliki forest virus into BHK-21 cells[J]. J Cell Biol, 1980, 84: 404-420. DOI:10.1083/jcb.84.2.404 |
| [18] |
Wang C. Mechanism of AP-2-associated Protein Kinase 1 Regulates Rabies Virus Infection (AP-2相关蛋白激酶1调控狂犬病病毒感染的作用机制) [D]. Beijng: Chinese Academy of Agricultural Sciences, 2021.
|
| [19] |
Gu X, Yuan W. The progress of AP-2 protein regulating clathrin-mediated endocytosis[J]. Chin J Otol (中华耳科学杂志), 2015, 13: 349-354. DOI:10.3969/j.issn.1672-2922.2015.02.038 |
| [20] |
Fingerhut A, von Figura K, Honing S. Binding of AP2 to sorting signals is modulated by AP2 phosphorylation[J]. J Biol Chem, 2001, 276: 5476-5482. DOI:10.1074/jbc.M009516200 |
| [21] |
Conner SD, Schmid SL. Identification of an adaptor-associated kinase, AAK1, as a regulator of clathrin-mediated endocytosis[J]. J Cell Biol, 2002, 156: 921-929. DOI:10.1083/jcb.200108123 |
| [22] |
Ricotta D, Conner SD, Schmid SL, et al. Phosphorylation of the AP2 μ subunit by AAK1 mediates high affinity binding to membrane protein sorting signals[J]. J Cell Biol, 2002, 156: 791-795. DOI:10.1083/jcb.200111068 |
| [23] |
Conner SD, Schröter T, Schmid SL. AAK1-mediated micro2 phosphorylation is stimulated by assembled clathrin[J]. Traffic, 2003, 4: 885-890. DOI:10.1046/j.1398-9219.2003.0142.x |
| [24] |
Henderson DM, Conner SD. A novel AAK1 splice variant functions at multiple steps of the endocytic pathway[J]. Mol Biol Cell, 2007, 18: 2698-2706. DOI:10.1091/mbc.e06-09-0831 |
| [25] |
Sorensen EB, Conner SD. AAK1 regulates Numb function at an early step in clathrin-mediated endocytosis[J]. Traffic, 2008, 9: 1791-1800. DOI:10.1111/j.1600-0854.2008.00790.x |
| [26] |
Gupta-Rossi N, Ortica S, Meas-Yedid V, et al. The adaptor-associated kinase 1, AAK1, is a positive regulator of the Notch pathway[J]. J Biol Chem, 2011, 286: 18720-18730. DOI:10.1074/jbc.M110.190769 |
| [27] |
Kuai L, Ong SE, Madison JM, et al. AAK1 identified as an inhibitor of neuregulin-1/ErbB4-dependent neurotrophic factor signaling using integrative chemical genomics and proteomics[J]. Chem Biol, 2011, 18: 891-906. DOI:10.1016/j.chembiol.2011.03.017 |
| [28] |
Sorrell FJ, Szklarz M, Abdul Azeez KR, et al. Family-wide structural analysis of human Numb-associated protein kinases[J]. Structure, 2016, 24: 401-411. DOI:10.1016/j.str.2015.12.015 |
| [29] |
Bi Y, Gordon CK, Giovanni C, et al. Imidazo [1, 2-b] pyridazine-based compounds, compositions comprising them, and uses thereof: US, 2013134219 [P]. 2013-09-12.
|
| [30] |
Bi Y, Gordon CK, Giovanni C, et al. Pyrazolo [1, 5-a] pyrimidine-based compounds, compositions comprising them, and methods of their use: US, 2013134228 [P]. 2013-09-12.
|
| [31] |
Herbert LT, Katerina S, Brian Z. Inhibition of adaptor associated Kinase 1 for the treatment of pain: US, 2013134336 [P]. 2013-09-12.
|
| [32] |
Vrudhula VM, Pan S, Ramkumar R, et al. Aryl ether-base kinase inhibitors: US, 2013134036 [P]. 2013-09-12.
|
| [33] |
Kostich W, Hamman BD, Li YW, et al. Inhibition of AAK1 kinase as a novel therapeutic approach to treat neuropathic pain[J]. J Pharmacol Exp Ther, 2016, 358: 371-386. DOI:10.1124/jpet.116.235333 |
| [34] |
Lexicon Pharmaceuticals. Efficacy and safety of LX9211 in patients with postherpetic neuralgia (RELIEF-PHN1) [DB/OL]. US. National Library of Medicine database, 2021 [2021-10-05]. https://clinicaltrials.gov/ct2/show/NCT04662281.
|
| [35] |
Lexicon Pharmaceuticals. Efficacy, safety, and PK of LX9211 in patients with diabetic peripheral neuropathic pain (RELIEF-DPN 1) [DB/OL]. US. National Library of Medicine database, 2021 [2021-12-01]. https://clinicaltrials.gov/ct2/show/NCT04455633.
|
| [36] |
Neveu G, Barouch-Bentov R, Ziv-Av A, et al. Identification and targeting of an interaction between a tyrosine motif within hepatitis C virus core protein and AP2M1 essential for viral assembly[J]. PLoS Pathog, 2012, 8: e1002845. DOI:10.1371/journal.ppat.1002845 |
| [37] |
Einav S, Barouch-Bentov Rina, Neveu G, et al. Methods and composition for treating viral diseases: US, 2013086133 [P]. 2013-06-13.
|
| [38] |
Choo QL, Kuo G, Weiner AJ, et al. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome[J]. Science, 1989, 244: 359-362. DOI:10.1126/science.2523562 |
| [39] |
Goel A, Bhadauria DS, Aggarwal R. Hepatitis C virus infection and chronic renal disease: a review[J]. Indian J Gastroenterol, 2018, 37: 492-503. DOI:10.1007/s12664-018-0920-3 |
| [40] |
Lee J, Ou J. Hepatitis C virus and intracellular antiviral response[J]. Curr Opin Virol, 2022, 52: 244-249. DOI:10.1016/j.coviro.2021.12.010 |
| [41] |
Karaman MW, Herrgard S, Treiber DK, et al. A quantitative analysis of kinase inhibitor selectivity[J]. Nat Biotechnol, 2008, 26: 127-132. DOI:10.1038/nbt1358 |
| [42] |
Neveu G, Ziv-Av A, Barouch-Bentov R, et al. AP-2-associated protein kinase 1 and cyclin G-associated kinase regulate hepatitis C virus entry and are potential drug targets[J]. J Virol, 2015, 89: 4387-4404. DOI:10.1128/JVI.02705-14 |
| [43] |
Park SY, Guo X. Adaptor protein complexes and intracellular transport[J]. Biosci Rep, 2014, 34: e00123. DOI:10.1042/BSR20140069 |
| [44] |
Benedicto I, Gondar V, Molina-Jiménez F, et al. Clathrin mediates infectious hepatitis C virus particle egress[J]. J Virol, 2015, 89: 4180-4190. DOI:10.1128/JVI.03620-14 |
| [45] |
Bekerman E, Neveu G, Shulla A, et al. Anticancer kinase inhibitors impair intracellular viral trafficking and exert broad-spectrum antiviral effects[J]. J Clin Invest, 2017, 127: 1338-1352. DOI:10.1172/JCI89857 |
| [46] |
Xiao F, Wang S, Barouch-Bentov R, et al. Interactions between the hepatitis C virus nonstructural 2 protein and host adaptor proteins 1 and 4 orchestrate virus release[J]. mBio, 2018, 9: e02233-17. |
| [47] |
Green S, Rothman A. Immunopathological mechanisms in dengue and dengue hemorrhagic fever[J]. Curr Opin Infect Dis, 2006, 19: 429-436. DOI:10.1097/01.qco.0000244047.31135.fa |
| [48] |
Hou L, Ju H, Zhan P, et al. Recent advances in the discovery of dengue virus inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 669-678. |
| [49] |
Liu M, Fang E, Li Y. The latest research progress of dengue vaccine[J]. Chin Med Biotechnol (中国医药生物技术), 2019, 14: 545-548. DOI:10.3969/j.issn.1673-713X.2019.06.012 |
| [50] |
Pu SY, Xiao F, Schor S, et al. Feasibility and biological rationale of repurposing sunitinib and erlotinib for dengue treatment[J]. Antiviral Res, 2018, 155: 67-75. DOI:10.1016/j.antiviral.2018.05.001 |
| [51] |
Tongmuang N, Yasamut U, Noisakran S, et al. Suppression of µ1 subunit of the adaptor protein complex 2 reduces dengue virus release[J]. Virus Genes, 2020, 56: 27-36. DOI:10.1007/s11262-019-01710-x |
| [52] |
Verdonck S, Pu SY, Sorrell FJ, et al. Synthesis and structure-activity relationships of 3, 5-disubstituted-pyrrolo[2, 3-b]pyridines as inhibitors of adaptor-associated kinase 1 with antiviral activity[J]. J Med Chem, 2019, 62: 5810-5831. DOI:10.1021/acs.jmedchem.9b00136 |
| [53] |
Wang C, Wang J, Shuai L, et al. The serine/threonine kinase AP2-associated kinase 1 plays an important role in rabies virus entry[J]. Viruses, 2019, 12: 45. DOI:10.3390/v12010045 |
| [54] |
Zhang CX, Engqvist-Goldstein AE, Carreno S, et al. Multiple roles for cyclin G-associated kinase in clathrin-mediated sorting events[J]. Traffic, 2005, 6: 1103-1113. DOI:10.1111/j.1600-0854.2005.00346.x |
| [55] |
Luo J, Zhang Y, Wang Y, et al. Rhabdovirus infection is dependent on serine/threonine kinase AP2-associated kinase 1[J]. Life (Basel), 2020, 10: 170. |
| [56] |
Li J, Jiang X, Xu S, et al. Medicinal chemistry strategies in seeking coronavirus inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 537-553. |
| [57] |
Akbarzadeh-Khiavi M, Torabi M, Rahbarnia L, et al. Baricitinib combination therapy: a narrative review of repurposed Janus kinase inhibitor against severe SARS-CoV-2 infection[J]. Infection, 2021, 13: 1-14. |
| [58] |
Schor S, Einav S. Repurposing of kinase inhibitors as broad-spectrum antiviral drugs[J]. DNA Cell Biol, 2018, 37: 63-69. DOI:10.1089/dna.2017.4033 |
| [59] |
Richardson P, Griffin I, Tucker C, et al. Baricitinib as potential treatment for 2019-nCoV acute respiratory disease[J]. Lancet, 2020, 395: e30-e31. DOI:10.1016/S0140-6736(20)30304-4 |
| [60] |
Stebbing J, Krishnan V, de Bono S, et al. Mechanism of baricitinib supports artificial intelligence-predicted testing in COVID-19 patients[J]. EMBO Mol Med, 2020, 12: e12697. |
| [61] |
Stebbing J, Phelan A, Griffin I, et al. COVID-19: combining antiviral and anti-inflammatory treatments[J]. Lancet Infect Dis, 2020, 20: 400-402. DOI:10.1016/S1473-3099(20)30132-8 |
| [62] |
Zhang X, Zhang Y, Qiao W, et al. Baricitinib, a drug with potential effect to prevent SARS-CoV-2 from entering target cells and control cytokine storm induced by COVID-19[J]. Int Immunopharmacol, 2020, 86: 106749. DOI:10.1016/j.intimp.2020.106749 |
| [63] |
Martinez-Gualda B, Schols D, De Jonghe S. A patent review of adaptor associated kinase 1 (AAK1) inhibitors (2013-present)[J]. Expert Opin Ther Pat, 2021, 31: 911-936. DOI:10.1080/13543776.2021.1928637 |
| [64] |
Bamborough P, Drewry D, Harper G, et al. Assessment of chemical coverage of kinome space and its implications for kinase drug discovery[J]. J Med Chem, 2008, 51: 7898-7914. DOI:10.1021/jm8011036 |
| [65] |
Bi Y, Kumi G. Inhibitors of adaptor associated kinase 1, compositions compring them, and methods of their use: US, 2015142714 [P]. 2015-09-24.
|
| [66] |
Gopinathan S, Tyle P, Yang Q, et al. 4-(3-(Pyridin-3-yl)pyrazolo[1, 5-a]pyrilmidin-5-yl)piperazine for use in the treatment of CoV-229E or CoV-OC43 coronaviruses infections: US, 2021216454 [P]. 2021-10-28.
|
| [67] |
Luo G, Chen L, Dzierba CD, et al. Biaryl kinase inhibitors: US, 2015153720 [P]. 2015-10-08.
|
| [68] |
Gopinathan S, Tyle P, Yang Q, et al. AAK1 inhibitors for use in treating viral infections: US, 2021216441 [P]. 2021-10-28.
|
 2022, Vol. 57
2022, Vol. 57


