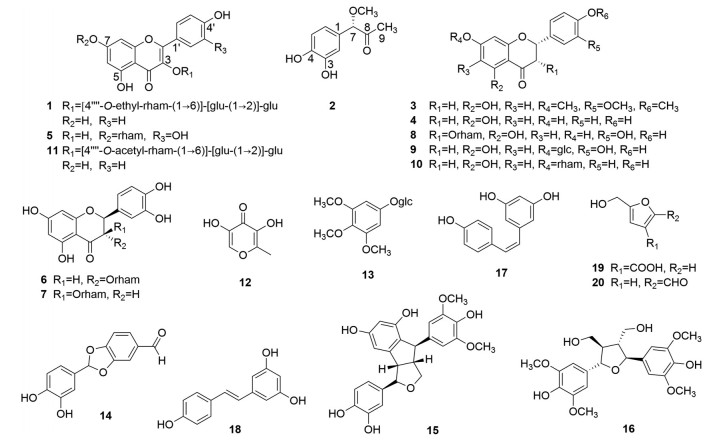
土茯苓药材为百合科Liliaceae菝葜属(Smilax) 光叶菝葜植物(Smilax glabra Roxb.) 干燥根茎, 可药食两用, 无不良反应[1]。《本草纲目》、《本草蒙筌》、《本草真诠》及《本草正义》等多部古籍均有土茯苓解重金属汞中毒的记载, 分析了其中医病机, 并论述了其机制[2-5]。有关土茯苓解重金属中毒的现代药理研究也有部分报道, 显示土茯苓对重金属引发的体内氧化应激损伤具有保护作用[6-8]。《中国药典》2020版一部记载土茯苓功效有解毒、除湿、通利关节, 用于梅毒及汞中毒所致的肢体拘挛、筋骨疼痛[9], 从法典的角度肯定了土茯苓解重金属汞中毒的功效。然而, 土茯苓解重金属毒的物质基础研究目前几乎空白。据以上述现状, 本课题组选择汞和铅为重金属代表, 对土茯苓解其毒的药效物质基础进行相关研究。前期研究显示, 土茯苓的乙酸乙酯化学部位为解毒的活性部位, 进而对乙酸乙酯有效部分进行系统的化学成分研究[10]。本文报道从中分离鉴定出的20个化合物, 包括10个黄酮(1、3~11)、8个酚类(2、12~18) 和2个呋喃衍生物(19、20), 结构见图 1。化合物1、2为新化合物, 3~5、9~12、14、19和20均首次从该植物中分离得到。新化合物1和2具有一定的抗炎活性, IC50值分别为56.8和29.5 μmol·L-1。
|
Figure 1 Structures of compounds 1-20 |
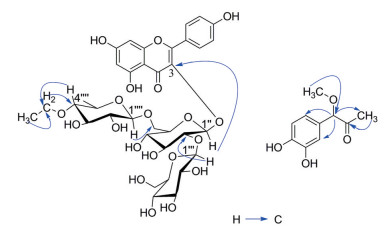
化合物1 黄色粉末(甲醇), 溶于甲醇, AlCl3反应呈阳性, 提示化合物可能为黄酮类化合物。UV显示黄酮特征吸收(210、285、326 nm), 进一步验证了上述推论。HR-ESI-MS [M+H]+ m/z 785.251 6 (计算值785.250 4), 确定化合物分子式为C35H44O20, 不饱和度为13。在1H NMR中(表 1), 显示两个邻位偶合的芳香质子[6.38 (1H, d, 1.5 Hz)、6.18 (1H, d, 1.5 Hz)], 归属为黄酮A环H-6和H-8; 显示AA′BB′耦合系统的4个芳香质子[8.01 (2H, d, 8.5 Hz)、6.88 (2H, d, 8.5 Hz)], 归属为黄酮B环H-2′, 6′和H-3′, 5′, 提示化合物为山柰酚衍生物; 显示鼠李糖C-6特征的甲基信号[1.07 (3H, d, 6.0 Hz)]; 还显示1个乙基片段[1.16 (3H, t, 7.0 Hz)、3.59 (2H, q, 7.0 Hz)]。在13C NMR中(表 1), 显示35个碳, 其中包括15个黄酮母核碳信号、3个糖端基碳信号、14个连氧碳信号、1个归属于鼠李糖C-6位特征甲基信号(δC 18.0) 及1个乙基片段(δC 18.5和58.6), 提示化合物1为具乙基取代的黄酮三糖苷衍生物。再根据糖残基的化学位移, 三糖应由2个葡萄糖和1个鼠李糖组成, 并参照文献[11]水解后, GC-MS分析验证了上述结论。通过上述分析, 化合物1的核磁共振谱数据与已知化合物11 (山柰酚3-O-[4′′′′′-O-乙酰基-α-L-鼠李糖基-(1→6)]-[β-D-吡喃葡萄糖基-(1→2)]-β-D-吡喃葡萄糖苷)[12]的数据非常相似, 不同的是化合物11的鼠李糖C-4连接乙酰基消失, 而由乙基取而代之, 高分辨质谱同样支持了上述推论。根据HMBC谱(图 2) 推测糖与苷元、糖与糖和乙基的连接位置: 葡萄糖端基氢[5.34 (H-1′′)] 与黄酮C-3 (134.9) 有远程耦合, 提示内端葡萄糖单元连接在C-3; 鼠李糖端基氢[4.46 (H-1′′′′)] 与内端葡萄糖C-6′′ (68.3) 有相关, 提示鼠李糖连接在内端葡萄糖的C-6′′位; 末端葡萄糖端基氢[4.76 (H-1′′′)] 与内端葡萄糖C-2′′ (82.1) 相关, 提示末端葡萄糖连接于内端葡萄糖的C-2; 另外, 乙基的亚甲基质子(3.59) 与鼠李糖C-4′′′′ (74.9) 相关, 鼠李糖H-4′′′′ (4.70) 与乙基连氧碳(58.6) 有相关, 提示乙基与鼠李糖C-4相连。综上分析, 化合物1鉴定为kaempferol-3-O-[4′′′′-O-ethyl-α-L-rhamnopyranosyl-(1-6)]-[β-D-glucopyranosyl-(1-2)]-β-D-glucopyranoside, 确定为新化合物, 命名为土茯苓苷A。
| Table 1 1H NMR (600 MHz, CD3OD) and 13C NMR (150 MHz, CD3OD) spectral data of compounds 1 and 2 |
|
Figure 2 Key HMBC spectra of compounds 1 and 2 |
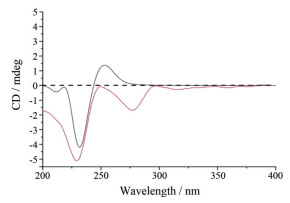
化合物2 白色无定形粉末, 溶于甲醇。[α]D20-22.8 (c 0.25, MeOH); HR-ESI-MS [M+Na]+ m/z = 219.062 6 (计算值219.063 3); UV (MeOH) λmax: 215, 285 nm, 确定化合物分子式为C10H12O4, 不饱和度为5。1H NMR (表 1) 显示具ABX耦合的3个芳香质子: δH 6.74 (d, 1.9 Hz)、6.75 (d, 8.0 Hz)、6.69 (dd, 1.9, 8.0 Hz), 提示化合物具苯环1、3、4三取代。另外, 显示1个甲基质子信号δH 2.03 (3H, s) 及1个甲氧基质子信号δH 3.27 (3H, s)。在13C NMR谱中(表 1), 显示10个碳信号, 包括6个芳香碳信号δC 128.3、116.5、147.1、146.9、115.3、120.6, 一个羰基碳信号δC 208.4, 1个连氧碳信号δC 89.8, 1个甲基碳信号δC 25.7和1个甲氧基碳信号δC 56.8, 提示化合物为具甲氧基取代的苯丙素衍生物。甲氧基取代在C-7位及羰基碳为C-8由HMBC谱推定(图 2): OCH3 (δH 3.27) 与C-7 (δC 89.8) 有远程相关, δH H-7 (4.64) 与C-1 (δC 128.3)、C-2 (δC 116.5)、C-6 (δC 120.6)、C-8 (δC 208.4)、C-9 (δC 25.7) 和甲氧基(δC 56.8) 有远程相关。根据以上结果分析, 化合物平面结构为1-(3, 4-二羟基苯基)-1-甲氧基丙烷-2-酮。化合物2的立体构型通过测定CD与理论计算进行比较(图 3), 与S构型一致, 故化合物2鉴定为7S-(3, 4-二羟基苯基)-1-甲氧基丙烷-2-酮, 确定为新化合物, 命名为土茯苓酮A。
|
Figure 3 Calculated (—) and experimental ECD (—) spectra of compound 2 |
采用抑制一氧化氮(NO) 生成实验, 评价新化合物1和2的抗炎活性。化合物1和2的IC50值分别为56.8和29.5 μmol·L-1 (阳性药N-monomethyl-larginine, IC50值为9.8 μmol·L-1), 提示化合物显示一定的抗炎活性。
实验部分LCQ DECAXP plus质谱仪(美国Thermo公司); Bruker AM 600 MHz型核磁共振仪(TMS为内标, 瑞士Bruker公司); LC 3000 Ⅰ型高效液相色谱仪(北京钢臣科技有限公司); 薄层色谱硅胶(青岛海洋化工厂); Sephadex LH-20 (美国Pharmacia公司); 柱色谱硅胶(青岛海洋化工厂); 大孔树脂AB-8 (东鸿化工有限公司); ODS柱色谱材料和C18半制备型色谱柱(日本YMC公司); N-1100型旋转蒸发仪(东京理化仪器有限公司); BSZ-100型自动部分收集器(上海沪西分析仪器厂); BS224S型电子天平(北京赛多利斯仪器系统有限公司)。水为超纯水。试剂均为分析纯或色谱纯(西陇科学股份有限公司)。
土茯苓药材购自广西壮族自治区玉林市, 经江西中医药大学付小梅教授鉴定为百合科植物光叶菝葜[Smilax glabra Roxb.] 的干燥根茎, 凭证标本(20190225) 收藏于江西中医药大学现代中药制剂教育部重点实验室。
1 提取分离将干燥的土茯苓(22.5 kg) 碎成小块, 用80%乙醇回流提取3次(3、2、2 h), 合并提取液并回收溶剂, 得干浸膏(3.74 kg), 将3 kg浸膏加入适量水溶解, 再用石油醚、乙酸乙酯、正丁醇依次萃取, 得到石油醚部位89 g, 乙酸乙酯部位848 g, 正丁醇部位539 g。前期研究结果显示, 乙酸乙酯部位是土茯苓解Pb毒作用的有效部位, 故选取乙酸乙酯部位进行系统的化学成分研究。取乙酸乙酯部位800 g经大孔树脂AB-8, 依次以3倍柱体积的纯水、30%乙醇、60%乙醇、95%乙醇溶剂梯度洗脱, 得水部位70 g, 30%乙醇部位241 g, 60%乙醇部位370 g, 95%乙醇部位82 g。取30%乙醇洗脱部位241 g, 经硅胶柱色谱, 以二氯甲烷-甲醇(100∶0→0∶100) 梯度洗脱, 薄层色谱检测, 合并得到13个部分Fr.T1~T13。Fr.T5 (1.5 g) 利用Sephadex LH-20柱色谱(甲醇) 进行分离, TLC指导合并后得到3个流分Fr.T5.1~5.3, Fr.T5.1 (201 mg) 再经半制备HPLC (甲醇-水, 20∶80) 得到化合物1 (2.5 mg, tR = 13.1 min)。Fr.T6 (1.0 g) 经Sephadex LH-20柱色谱(甲醇) 分离, TLC指导合并后得到3个流分Fr.T6.1~6.3。Fr.T6.1 (105 mg) 经重结晶(甲醇) 得到化合物12 (12.4 mg), Fr.T6.2 (96 mg) 经半制备HPLC (甲醇-水, 25∶75) 得到化合物4 (16.8 mg, tR = 20.4 min)。Fr.T8 (2.3 g) 经Sephadex LH-20柱色谱(甲醇) 分离, TLC指导合并后得到2个流分Fr.T8.1~8.2。Fr.T8.1 (112 mg) 经半制备HPLC (甲醇-水, 30∶70) 得到化合物3 (3.5 mg, tR = 23.6 min)。Fr.T9 (3.2 g) 用硅胶柱色谱进行分离, 二氯甲烷-甲醇(15∶1→8∶1) 为洗脱剂进行洗脱, 得12个流分Fr.T9.1~9.12, Fr.T9.2 (207 mg) 经Sephadex LH-20柱色谱(甲醇) 分离, 得到5个流分Fr.T9.2.1~9.2.5, Fr. T9.2.4 (82 mg) 经半制备HPLC (甲醇-水, 13∶87) 得到化合物13 (9.3 mg, tR = 9.7 min)。Fr.T10 (1.9 g) 经Sephadex LH-20柱色谱(甲醇) 进行分离, TLC指导合并后得到3个流分Fr.T10.1~10.3。Fr.T10.1 (458 mg) 再经Sephadex LH-20柱色谱(甲醇) 进行分离, 得到5个流分Fr.T10.1.1~10.1.5。Fr.T10.1.5 (228 mg) 经半制备HPLC (甲醇-水, 25∶75) 得到化合物14 (109 mg, tR = 17.4min)。Fr.T11 (2.5 g) 利用Sephadex LH-20柱色谱(甲醇) 进行分离, 得到8个流分Fr.T11.1~11.8。Fr.T11.6 (66 mg) 经过半制备HPLC (甲醇-水, 24∶76) 得到化合物15 (23.3 mg, tR = 28.7 min)。Fr.T12 (3.7 g) 利用Sephadex LH-20柱色谱(甲醇) 进行分离, 得到9个流分Fr.T12.1~12.9。Fr.T12.4 (404 mg) 用反相硅胶柱色谱进行分离, 以30%甲醇进行洗脱, 得到10个流分Fr.T12.4.1~12.4.10。Fr.T12.4.3 (98 mg) 经半制备HPLC (甲醇-水, 15∶85) 得到化合物19 (6.1 mg, tR = 7.8 min); Fr.T12.6 (125 mg) 利用Sephadex LH-20柱色谱(甲醇) 进行分离, 得到化合物2 (14 mg); Fr. T12.7 (95 mg) 利用Sephadex LH-20柱色谱(甲醇) 进行分离, 得到化合物11 (9 mg)。Fr.T13 (1.9 g) 经过重结晶(甲醇) 后得到化合物落新妇苷(109.6 mg); Fr.T13母液再经半制备HPLC (乙腈-0.1%甲酸水, 19∶81) 得到化合物6 (35.0 mg)、7 (58.9 mg)、8 (21.0 mg)。Fr. T14 (687 mg) 经半制备HPLC (甲醇-水, 48∶52) 得到化合物5 (5.6 mg, tR = 17.5 min) 和9 (6.4 mg, tR = 20.4 min)。取60%乙醇洗脱部位370 g, 经硅胶柱色谱, 以二氯甲烷-甲醇(100∶0→0∶100) 梯度洗脱, 薄层色谱检测, 合并得到21个部分Fr.S1~S21。Fr.S8 (2.4 g) 通过重结晶(甲醇) 得到化合物10 (156.0 mg), 剩余母液经过半制备HPLC (甲醇-水, 15∶85) 得到化合物20 (3.7 mg, tR = 11.2 min)。Fr.S15 (1.1 g) 经过半制备HPLC (甲醇-水, 35∶65) 得到化合物16 (2.7 mg, tR = 23.3 min)、17 (8.9 mg, tR = 31.6 min)、18 (3.1 mg, tR = 34.8 min)。
2 结构鉴定化合物1 黄色粉末(甲醇), [α]D20-39.8 (c 0.16, MeOH); UV(MeOH) λmax: 210, 285, 326 nm; HR-ESI-MS [M+H]+ m/z = 785.251 6 (计算值785.250 4), 分子式C35H44O20。1H NMR (600 MHz, CD3OD) 和13C NMR (150 MHz, CD3OD) 数据见表 1。
化合物2 白色无定形粉末, [α]D20-22.8 (c 0.25, MeOH); UV(MeOH) λmax: 215, 285 nm; HR-ESI-MS [M+Na]+ m/z = 219.062 6 (计算值219.063 3), 分子式C10H12O4。1H NMR (600 MHz, CD3OD) 和13C NMR (150 MHz, CD3OD) 数据见表 1。
化合物3 淡黄色粉末(甲醇), ESI-MS m/z: 331.1 [M+H]+, 分子式C18H18O6。1H NMR (600 MHz, CD3OD) δH: 6.77 (1H, d, J = 2.1 Hz, H-2'), 6.68 (1H, d, J = 8.2 Hz, H-5'), 6.63 (1H, dd, J = 2.1, 8.2 Hz, H-6'), 5.93 (1H, d, J = 2.0 Hz, H-8), 5.90 (1H, d, J = 2.0 Hz, H-6), 5.18 (1H, dd, J = 12.8, 3.4 Hz, H-62), 3.90 (3H, s, OCH3-7), 3.86 (3H, s, OCH3-3'), 3.80 (3H, s, OCH3-4'), 3.22 (1H, dd, J = 16.8, 12.6 Hz, H-3a), 3.05 (1H, dd, J =16.8, 3.4 Hz, H-3b)。以上数据对照文献[13], 鉴定化合物3为5-羟基-3′, 4′, 7-三甲氧基二氢黄酮。
化合物4 亮白色无定形粉末(甲醇), ESI-MS m/z: 273.1 [M+H]+, 分子式C15H13O5。1H NMR (600 MHz, CD3OD) δH: 7.30 (2H, d, J = 8.3 Hz, H-2′, 6′), 6.81 (2H, d, J = 8.3 Hz, H-3′, 5′), 5.89 (1H, br s, H-6), 5.88 (1H, br s, H-8), 5.31 (1H, dd, J = 13.0, 2.5 Hz, H-2), 3.09 (1H, dd, J = 17.0, 13.0 Hz, H-3a), 2.67 (1H, dd, J = 17.0, 2.5 Hz, H-3b)。以上数据对照文献[14], 鉴定化合物4为柚皮素。
化合物5 黄色无定形粉末(甲醇), ESI-MS m/z: 449.1 [M+H]+, 分子式C21H20O11。1H NMR (600 MHz, CD3OD) δH: 6.88 (1H, d, J = 1.9 Hz, H-2′), 6.76 (1H, dd, J = 8.1, 1.9 Hz, H-6′), 6.70 (1H, d, J = 8.1 Hz, H-5′), 6.67 (1H, d, J = 2.1 Hz, H-8), 6.29 (1H, d, J = 2.1 Hz, H-6), 5.28 (1H, br s, H-1′′), 1.23 (3H, d, J = 6.2 Hz, H-6′′); 13C NMR (150 MHz, CD3OD) δC: 149.5 (C-2), 137.8 (C-3), 177.4 (C-4), 161.4 (C-5), 101.2 (C-6), 162.9 (C-7), 95.7 (C-8), 157.5 (C-9), 105.8 (C-10), 123.0 (C-1′), 116.7 (C-2′), 146.3 (C-3′), 149.2 (C-4′), 116.6 (C-5′), 121.4 (C-6′), 100.4 (C-1′′), 71. 6 (C-2′′), 72.0 (C-3′′), 72.7 (C-4′′), 71.0 (C-5′′), 17.9 (C-6′′)。以上数据对照文献[15], 鉴定化合物5为槲皮素7-O-α-L-鼠李糖苷。
化合物6 灰绿色粉末(甲醇), ESI-MS m/z: 451.3 [M+H]+, 分子式C21H22O11。1H NMR (600 MHz, CD3OD) δH: 6.98 (1H, s, H-2′), 6.81 (2H, s, H-5′, 6′), 5.91 (1H, br s, H-8), 5.88 (1H, br s, H-6), 5.16 (1H, br s, H-1′′), 4.96 (1H, d, J =11.4 Hz, H-2), 4.63 (1H, d, J = 11.4 Hz, H-3), 4.03 (1H, br s, H-2′′), 3.40 (1H, dd, J = 2.9, 9.5 Hz, H-3′′), 3.20 (1H, t, J = 9.5 Hz, H-4′′), 2.28 (1H, dq, J = 6.2, 9.5 Hz, H-5′′), 0.90 (1H, d, J = 6.2 Hz, H-6′′); 13C NMR (150 MHz, CD3OD) δC: 83.7 (C-2), 77.0 (C-3), 197.7 (C-4), 165.5 (C-5), 97.6 (C-6), 168.8 (C-7), 96.4 (C-8), 164.3 (C-9), 102.9 (C-10), 130.1 (C-1′), 116.4 (C-2′), 146.6 (C-3′), 147.5 (C-4′), 115.6 (C-5′), 121.1 (C-6′), 102.1 (C-1′′), 72.0 (C-2′′), 72.0 (C-3′′), 73.5 (C-4′′), 70.4 (C-5′′), 18.0 (C-6′′)。以上数据对照文献[16], 鉴定化合物6为新落新妇苷。
化合物7 淡绿色粉末(甲醇), ESI-MS m/z: 451.3 [M+H]+, 分子式C21H22O11。1H NMR (600 MHz, CD3OD) δH: 6.98 (1H, s, H-2′), 6.85 (1H, dd, J =1.6, 8.2 Hz, H-6′), 6.83 (1H, dd, J = 1.6, 8.2 Hz, H-5′), 5.93 (1H, br s, H-6), 5.90 (1H, br s, H-8), 5.33 (1H, br s, H-2), 4.23 (1H, br s, H-3), 4.05 (1H, br s, H-1′′), 3.70 (1H, d, J = 9.6 Hz, H-3′′), 3.51 (1H, br s, H-2′′), 3.33 (1H, overlap, H-4′′), 3.30 (1H, overlap, H-5′′), 0.92 (1H, d, J = 6.2 Hz, H-6′′); 13C NMR (150 MHz, CD3OD) δC: 82.3 (C-2), 78.4 (C-3), 193.9 (C-4), 166.1 (C-5), 97.4 (C-6), 168.8 (C-7), 96.2 (C-8), 164.5 (C-9), 102.6 (C-10), 128.6 (C-1′), 116.3 (C-2′), 146.4 (C-3′), 146.8 (C-4′), 115.3 (C-5′), 119.6 (C-6′), 102.2 (C-1′′), 71.6 (C-2′′), 72.1 (C-3′′), 73.8 (C-4′′), 70.6 (C-5′′), 17.6 (C-6′′)。以上数据对照文献[16], 鉴定化合物7为新异落新妇苷。
化合物8 白色粉末(甲醇), ESI-MS m/z: 451.3 [M+H]+, 分子式C21H22O11。1H NMR (600 MHz, CD3OD) δH: 6.94 (1H, s, H-2′), 6.83 (1H, d, J = 7.9 Hz, H-5′), 6.80 (1H, d, J = 7.9 Hz, H-6′), 5.98 (1H, br s, H-6), 5.92 (1H, br s, H-8), 5.42 (1H, br s, H-2), 4.96 (1H, br s, H-1′′), 4.18 (1H, br s, H-3), 3.67 (1H, br s, H-2′′), 3.52 (1H, m, H-3′′), 3.20 (1H, t, J = 9.5 Hz, H-4′′), 2.46 (1H, m, H-5′′), 0.93 (1H, d, J = 6.2 Hz, H-6′′); 13C NMR (150 MHz, CD3OD) δC: 82.2 (C-2), 75.7 (C-3), 194.4 (C-4), 166.3 (C-5), 97.5 (C-6), 168.9 (C-7), 96.3 (C-8), 164.6 (C-9), 101.9 (C-10), 128.8 (C-1′), 116.4 (C-2′), 146.5 (C-3′), 146.8 (C-4′), 115.3 (C-5′), 119.5 (C-6′), 100.3 (C-1′′), 72.1 (C-2′′), 72.2 (C-3′′), 73.4 (C-4′′), 70.5 (C-5′′), 17.9 (C-6′′)。以上数据对照文献[16], 鉴定化合物8为异落新妇苷。
化合物9 黄白色粉末(甲醇), ESI-MS m/z: 450.1 [M+H]+, 分子式C21H22O11。1H NMR (600 MHz, CD3OD) δH: 6.95 (1H, br s, H-2′), 6.83 (1H, d, J = 8.1 Hz, H-5′), 6.79 (1H, d, J = 8.1 Hz, H-6′), 6.21 (1H, br s, H-8), 6.20 (1H, br s, H-6), 5.98 (1H, d, J = 7.4 Hz, H-1′′), 5.30 (1H, dd, J = 13.2, 3.0 Hz, H-2), 3.12 (1H, dd, J = 16.8, 13.2 Hz, H-3a), 2.82 (1H, dd, J = 16.8, 3.0 Hz, H-3b); 13C NMR (150 MHz, CD3OD) δC: 81.0 (C-2), 44.2 (C-3), 198.9 (C-4), 164.9 (C-5), 98.4 (C-6), 167.2 (C-7), 97.4 (C-8), 164.8 (C-9), 105.2 (C-10), 131.7 (C-1′), 115.2 (C-2′), 146.6 (C-3′), 146.8 (C-4′), 116.7 (C-5′), 119.8 (C-6′), 101.6 (C-1′′), 75.0 (C-2′′), 78.5 (C-3′′), 71.4 (C-4′′), 78.1 (C-5′′), 62.3 (C-6′′)。以上数据对照文献[17], 鉴定化合物9为圣草酚-7-O-β-D-葡萄糖苷。
化合物10 白色粉末(甲醇), ESI-MS m/z: 435.4 [M+H]+, 分子式C21H22O10。1H NMR (600 MHz, CD3OD) δH: 7.34 (2H, d, J = 8.4 Hz, H-2′, 6′), 6.85 (2H, d, J = 8.4 Hz, H-3′, 5′), 5.97 (1H, s, H-6), 5.90 (1H, s, H-8), 5.49 (1H, br s, H-2), 4.98 (1H, br s, H-1ʺ), 4.18 (1H, s, H-3), 3.68 (1H, br s, H-2′′), 3.44 (1H, dd, J = 3.4, 9.6 Hz, H-3′′), 3.21 (1H, t, J = 9.6 Hz, H-4′′), 2.42 (1H, m, H-5′′), 0.92 (1H, d, J = 6.2 Hz, H-6′′); 13C NMR (150 MHz, CD3OD) δC: 82.1 (C-2), 75.4 (C-3), 193.1 (C-4), 164.6 (C-5), 98.9 (C-6), 165.8 (C-7), 96.5 (C-8), 162.0 (C-9), 103.4 (C-10), 128.1 (C-1′), 129.1 (C-2′, 6′), 116.3 (C-3′, 5′), 158.8 (C-4′), 100.0 (C-1′′), 73.2 (C-2′′), 71.9 (C-3′′), 72.0 (C-4′′), 70.3 (C-5′′), 17.8 (C-6′′)。以上数据对照文献[18], 鉴定化合物10为香橙素-7-O-α-L-鼠李糖苷。
化合物11 黄色无定形粉末(甲醇), ESI-MS m/z: 798.2 [M+H]+, 分子式C35H42O21。1H NMR (400 MHz, CD3OD) δH: 8.05 (2H, d, J = 8.9 Hz, H-2′, 6′), 6.89 (2H, d, J = 8.9 Hz, H-3′, 5′), 6.38 (1H, d, J = 2.1 Hz, H-6), 6.19 (1H, d, J = 2.1 Hz, H-8), 5.40 (1H, d, J = 7.5 Hz, H-1′′), 4.77 (1H, d, J = 7.0 Hz, H-1′′′), 4.50 (1H, d, J = 1.4 Hz, H-1′′′′); 13C NMR (100 MHz, CD3OD) δC: 158.7 (C-2), 134.8 (C-3), 179.4 (C-4), 163.0 (C-5), 100.8 (C-6), 166.0 (C-7), 94.9 (C-8), 158.4 (C-9), 105.2 (C-10), 122.9 (C-1′), 132.4 (C-2′, 6′), 116.2 (C-3′, 5′), 161.4 (C-4′), 100.8 (C-6), 99.9 (C-1′′), 82.0 (C-2′′), 77.1 (C-3′′), 71.4 (C-4′′), 74.7 (C-5′′), 66.6 (C-6′′), 105.7 (C-1′′′), 73.8 (C-2′′′), 78.2 (C-3′′′), 72.1 (C-4′′′), 76.9 (C-5′′′), 62.2 (C-6′′′), 102.1 (C-1′′′′), 69.7 (C-2′′′′), 71.0 (C-3′′′′), 72.3 (C-4′′′′), 68.1 (C-5′′′′), 17.8 (C-6′′′′), 174.9 (CH3CO), 22.0 (CH3CO)。以上数据对照文献[12], 鉴定化合物11为山柰酚3-O-[4′′′′′-O-乙酰基-α-L-鼠李糖基-(1→6)]-[β-D-吡喃葡萄糖基-(1→2)]-β-D-吡喃葡萄糖苷。
化合物12 棕黄色方晶(甲醇∶二氯甲烷), ESI-MS m/z: 143.1 [M+H]+, 分子式C6H6O4。1H NMR (600 MHz, DMSO-d6) δH: 8.94 (1H, s, 5-OH), 8.77 (1H, s, 3-OH), 7.94 (1H, s, H-6), 2.22 (3H, s, H-7); 13C NMR (150 MHz, DMSO-d6) δC: 149.1 (C-2), 144.2 (C-3), 168.4 (C-4), 141.1 (C-5), 138.9 (C-6), 14.4 (C-7)。以上数据对照文献[19], 鉴定化合物12为5-羟基麦芽酚。
化合物13 灰白色粉末(甲醇), ESI-MS m/z: 347.1 [M+H]+, 分子式C15H22O9。1H NMR (600 MHz, CD3OD) δH: 6.49 (2H, s, H-2′, 6′), 4.81 (1H, d, J = 7.4 Hz, H-1), 3.91 (1H, dd, J = 12.0, 2.2 Hz, H-6b), 3.81 (6H, s, 3', 5'-OCH3), 3.70 (3H, s, 4'-OCH3), 3.65 (1H, dd, J = 12.0, 6.7 Hz, H-6a), 3.40~3.46 (4H, m, H-2, 3, 4, 5); 13C NMR (150 MHz, CD3OD) δC: 103.2 (C-1), 74.9 (C-2), 78.0 (C-3), 71.7 (C-4), 78.4 (C-5), 62.7 (C-6), 156.0 (C-1′), 96.0 (C-2′), 154.8 (C-3′), 134.4 (C-4′), 154.8 (C-5′), 96.4 (C-6′), 56.5 (3', 5'-OCH3), 61.3 (4'-OCH3)。以上数据对照文献[20], 鉴定化合物13为3, 4, 5-三甲氧基苯基-1-O-β-D-吡喃葡萄糖苷。
化合物14 棕色油状(甲醇), ESI-MS m/z: 259.1 [M+H]+, 分子式C14H10O5。1H NMR (600 MHz, CD3OD) δH: 9.68 (1H, s, H-10), 7.31 (1H, d, J = 7.6 Hz, H-6), 7.30 (1H, s, H-4), 6.90 (1H, d, J = 7.6 Hz, H-7), 6.85 (1H, s, H-2'), 6.74 (2H, like t, J = 8.0 Hz, H-5', 6'), 5.21 (1H, s, H-2); 13C NMR (150 MHz, CD3OD) δC: 104.8 (C-2), 115.3 (C-4), 130.8 (C-5), 126.4 (C-6), 116.2 (C-7), 147.2 (C-8), 153.7 (C-9), 193.1 (C-10), 146.6 (C-1′), 114.8 (C-2′), 146.1 (C-3′), 131.0 (C-4′), 115.8 (C-5′), 119.4 (C-6′)。以上数据对照文献[21], 鉴定化合物14为2-(3′, 4′-二羟基苯基)-1, 3-苯骈二氧戊环-5-甲醛。
化合物15 淡黄色粉末(甲醇), ESI-MS m/z: 453.2 [M+H]+, 分子式C25H24O8。1H NMR (600 MHz, CD3OD) δH: 6.85 (1H, d, J = 1.8 Hz, H-10), 6.77 (1H, d, J = 8.0 Hz, H-13), 6.75 (1H, dd, J = 8.0, 1.7 Hz, H-14), 6.32 (2H, s, H-2′, 6′), 6.24 (1H, d, J = 1.2 Hz, H-6), 6.18 (1H, d, J = 1.2 Hz, H-4), 4.65 (1H, d, J = 4.5 Hz, H-8), 4.47 (1H, like t, J = 8.1 Hz, H-9′a), 4.13 (1H, br s, H-7′), 3.76 (1H, dd, J = 8.4, 4.5 Hz, H-7), 3.73 (2H, s, H-3′, 5′-OCH3), 3.54 (1H, t, J = 8.5 Hz, H-9′b), 3.03 (1H, qd, J = 8.1, 1.5 Hz, H-8′); 13C NMR (150 MHz, CD3OD) δC: 148.6 (C-1), 123.0 (C-2), 156.3 (C-3), 102.8 (C-4), 160.1 (C-5), 103.2 (C-6), 59.8 (C-7), 89.4 (C-8), 135.2 (C-9), 114.5 (C-10), 146.0 (C-11), 146.5 (C-12), 116.3 (C-13), 119.0 (C-14), 137.9 (C-1′), 105.4 (C-2′), 149.1 (C-3′), 134.6 (C-4′), 149.1(C-5′), 105.4 (C-6′), 52.1 (C-7′), 56.5(C-8′), 75.0 (C-9′), 56.6 (3′, 5′-OCH3)。以上数据对照文献[22], 鉴定化合物15为kompasinol A。
化合物16 白色粉末(甲醇), ESI-MS m/z: 419.2 [M+H]+, 分子式C22H26O8。1H NMR (600 MHz, CD3OD) δH: 6.74 (4H, s, H-2, 2′, 6, 6′), 4.96 (2H, d, J = 8.1 Hz, H-7, 7′), 3.87 (12H, s, 3, 3′, 5, 5′-OCH3), 3.72 (2H, dd, J = 11.2, 2.6 Hz, H-9'), 3.63 (2H, dd, J = 10.9, 4.6 Hz, H-9), 2.32~2.52 (2H, m, H-8, 8′); 13C NMR (150 MHz, CD3OD) δC: 134.2 (C-1, 1′), 104.8 (C-2, 2′, 6, 6′), 149.3 (C-3, 3′, 5, 5′), 136.1 (C-4, 4′), 84.6 (C-7, 7′), 55.1 (C-8, 8′), 61.6 (C-9, 9′), 56.8 (3, 3′, 5, 5′-OCH3)。以上数据对照文献[23], 鉴定化合物16为icariol A2。
化合物17 淡白色粉末(甲醇), ESI-MS m/z: 229.1 [M+H]+, 分子式C14H12O3。1H NMR (600 MHz, CD3OD) δH: 7.08 (2H, d, J = 7.9 Hz, H-2′, 6′), 6.62 (2H, d, J = 7.9 Hz, H-3′, 5′), 6.41 (1H, d, J = 12.2 Hz, H-a), 6.32 (1H, d, J = 12.2 Hz, H-b), 6.21 (2H, br s, H-4); 13C NMR (150 MHz, CD3OD) δC: 141.2 (C-1), 108.2 (C-2, 6), 159.4 (C-3, 5), 102.3 (C-4), 129.2 (C-a, b), 130.9 (C-1′), 131.4 (C-2′, 6′), 115.8 (C-3′, 5′), 157.7 (C-4′)。以上数据对照文献[24], 鉴定化合物17为顺式白藜芦醇。
化合物18 白色粉末(甲醇), ESI-MS m/z: 229.1 [M+H]+, 分子式C14H12O3。1H NMR (600 MHz, CD3OD) δH: 7.34 (2H, d, J = 7.8 Hz, H-2′, 6′), 6.95 (1H, d, J = 16.3 Hz, H-a), 6.80 (1H, d, J = 16.3 Hz, H-b), 6.76 (2H, d, J = 7.8 Hz, H-3′, 5′), 6.45 (2H, br s, H-2, 6), 6.16 (1H, br s, H-4); 13C NMR (150 MHz, CD3OD) δC: 141.3 (C-1), 105.8 (C-2, 6), 159.6 (C-3, 5), 102.6 (C-4), 127.0 (C-a), 129.4 (C-b), 130.4 (C-1′), 128.8 (C-2′, 6′), 116.5 (C-3′, 5′), 158.3 (C-4′)。以上数据对照文献[24], 鉴定化合物18为反式白藜芦醇。
化合物19 淡黄色油状液体(甲醇), ESI-MS m/z: 143.1 [M+H]+, 分子式C6H6O4。1H NMR (600 MHz, CD3OD) δH: 7.96 (1H, s, H-2), 6.50 (1H, s, H-4), 4.41 (2H, s, H-7); 13C NMR (150 MHz, CD3OD) δC: 141.0 (C-2), 147.4 (C-3), 110.7 (C-4), 170.4 (C-5), 176.9 (C-6), 61.2 (C-7)。以上数据对照文献[25], 鉴定化合物19为flufuran。
化合物20 白色无定形粉末(甲醇), ESI-MS m/z: 127.1 [M+H]+, 分子式C6H6O3。1H NMR (600 MHz, CD3OD) δH: 9.54 (1H, s, H-1), 7.39 (1H, br s, H-3), 6.59 (1H, br s, H-4), 4.61 (2H, s, H-6); 13C NMR (150 MHz, CD3OD) δC: 163.2 (C-2), 124.9 (C-3), 110.9 (C-4), 153.8 (C-5), 179.7 (C-1), 57.6 (C-6)。以上数据对照文献[26], 鉴定化合物20为5-羟甲基糠醛。
3 抗炎活性实验参照文献方法, 以小鼠巨噬细胞为模型, 通过检测一氧化氮生成量, 评价化合物的抗炎活性[27]。简要实验步骤如下: ①使用含10%胎牛血清培养液配制浓度约每100 μL 2×105个单个小鼠巨噬细胞悬液, 取100 μL置于96孔板。②培养24 h后, 每孔加入25 μmol·L-1的待测化合物和1 μg·mL-1的LPS。③ 37 ℃培养18 h后, 分别加Griess A和B溶液各100 μL。继续孵育5 min。④在570 nm波长下, 测定光吸收值, 并以浓度为横坐标, 细胞存活率为纵坐标绘制细胞生长曲线, 应用两点法计算化合物的IC50值。
作者贡献: 彭财英负责化合物的结构鉴定及初稿撰写; 程双负责提取与分离; 熊艳芬负责抗炎生物活性测定相关实验; 刘建群参与样品的提取、负责核磁谱图分析; 黄慧莲参与稿件修改等工作; 舒积成是本文的通讯作者, 负责实验设计及把关, 提供本文思路, 参与稿件修改等工作。
利益冲突: 本文不存在任何利益冲突。
| [1] |
Nanjing University of Traditional Chinese Medicine. The Dictionary of Chinese Medicine (中药大辞典)[M]. Shanghai: Shanghai Science and Technology Press, 1986: 91-92.
|
| [2] |
Li SZ (明). Compendium of Materia Medica (本草纲目)[M]. Beijing: The Peoples Medical Publishing House, 1977.
|
| [3] |
Chen JM (明). Materia Medica Companion (本草蒙筌)[M]. Beijing: The Peoples Medical Publishing House, 1988: 168.
|
| [4] |
Yang ZK (明). Materia Medica Interpretation (本草真诠)[M]. Beijing: Xueyuan Press, 2011: 165.
|
| [5] |
Zhang DY (清). Materia Medica Meaning (本草正义)[M]. Fuzhou: Fujian Science and Technology Press, 2006: 302.
|
| [6] |
Xia DZ, Wang HM, Yang J, et al. Therapeutic effects of traditional Chinese herbal formula with Smilax glabra on mice's lead poisoning[J]. J Chin Med Mater (中药材), 2009, 32: 404-406. |
| [7] |
Xin HS, Fu HZ, Qi XY, et al. The effects of Smila glabra Roxb on liver enzyme of rat poisoned by TAA[J]. J Zhenjiang Med Coll (镇江医学院学报), 1998, 8: 165-168. |
| [8] |
Bao HM, Wang DC. Effect of traditional Chinese medicine on human glomerular mesangial cells in vitro[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2006, 22: 32-35. |
| [9] |
Chinese Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2020 Ed. Vol 1. Beijing: China Medical Science Press, 2020: 19.
|
| [10] |
Cheng S, Ma YY, Peng CY, et al. Chemical constituents from the ethyl acetate effective partsof Smilacis glabrae rhizome[J]. J Chin Med Mater (中药材), 2021, 44: 79-83. |
| [11] |
Peng CY, Huang YZ, Liu JQ, et al. A new triterpenoid from roots of Psidium guajava[J]. Acta Pharm Sin (药学学报), 2017, 52: 1731-1736. |
| [12] |
Gao DF, Xu M, Zhao P, et al. Kaempferol acetylated glycosides from the seed cake of Camellia oleifera[J]. Food Chem, 2011, 124: 432-436. DOI:10.1016/j.foodchem.2010.06.048 |
| [13] |
Wang CQ, Wang L, Li BJ, et al. Chemical constituents from leaves of Llex latifolia[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 258-261. |
| [14] |
Li ZL, Li DY, Li X, et al. A new alkaloid from the husk of Xanthoceras sorbifolia[J]. Acta Pharm Sin (药学学报), 2006, 41: 1197-1200. |
| [15] |
Li Y, Zhou BP, Zhang WJ, et al. Chemical constituents from aerial parts of Ribes mandshuricum[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 772-779. |
| [16] |
Yuan JZ, Dou DQ, Chen YJ, et al. Studies on dihydroflavonol glycosides from rhizome of Smilax glabra[J]. China J Chin Mater Med (中国中药杂志), 2004, 29: 867-870. |
| [17] |
Jiang WJ, Wu JC, Wang J, et al. Chemical constituents from the aerial part of Miao medicine Balanophora subcupularis fresh herb[J]. J Chin Med Mater (中药材), 2021, 44: 1623-1627. |
| [18] |
Zhu W, Qiu J, Zeng YR, et al. Cytotoxic phenolic constituents from Hypericum japonicum[J]. Phytochemistry, 2019, 164: 33-40. DOI:10.1016/j.phytochem.2019.04.012 |
| [19] |
Cui ZX, Xu W, Yang XW, et al. Chemical constituents of lipophilic parts in water extract from stem of Mahonia fortune[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 80-89. |
| [20] |
Shimomura H, Sashida Y, Oohara M, et al. Phenolic glucosides from Parabenzoin praecox[J]. Phytochemistry, 1988, 27: 644-646. DOI:10.1016/0031-9422(88)83166-2 |
| [21] |
Tagashira M, Ohtake Y. A new antioxidative 1, 3-benzodioxole from Melissa officinalis[J]. Planta Med, 1998, 64: 555-558. DOI:10.1055/s-2006-957513 |
| [22] |
Kobayashi M, Mahmud T, Yoshioka N, et al. Indonesian medicinal plants. XVⅢ. Kompasinol A, a new stibeno-phenylpropanoid from the bark of Koompassia malaccensis (Fabaceae)[J]. Chem Pharm Bull, 1996, 44: 2249-2253. DOI:10.1248/cpb.44.2249 |
| [23] |
Zhu J, Huang QL, Zhang CL, et al. Chemical constituents of Uvaria grandiflora[J]. J China Pharm Univ (中国药科大学学报), 2019, 50: 666-671. |
| [24] |
Cheng L, Ning DS, Xia MW, et al. Chemical constituents from EtOAc fraction of Sophora dunnii[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 4428-4432. |
| [25] |
Qi Chao, Zhen CF, Li Y, et al. Isolation and identification of chemical constituents from Paeonia veitchii[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2020, 26: 152-157. |
| [26] |
Yang Y, Zhang Y, Ren FX, et al. Chemical constituents from the roots of Angelica polymorpha Maxim[J]. Acta Pharm Sin (药学学报), 2013, 48: 718-722. |
| [27] |
Yuan CM, Tang GH, Zhang Y, et al. Bioactive limonoid and triterpenoid constituents of Turraea pubescens[J]. J Nat Prod, 2013, 76: 1166-1174. DOI:10.1021/np400276q |
 2022, Vol. 57
2022, Vol. 57


