铁是机体新陈代谢的重要物质基础, 在能量供给、物质转化、生长发育、神经反射等众多生命过程中必不可少, 但同时铁也是支持病原体生长的重要物质之一。所以铁对机体免疫反应的状态和属性, 特别是对于免疫微环境中“人-病”的整合相互作用具有重大的、双向的影响。面对外界和人体组织器官的复杂刺激, 维系微环境中铁的相对稳态对于生理功能执行和疾病干预治疗具有重大意义。
人体主要通过循环机制对体内所储存的铁进行反复利用, 使铁调节处于吸收、利用、储存、释放[1]的动态平衡中, 即形成了铁稳态。铁稳态通过对氧化还原状态、线粒体功能、炎症因子分泌等的精细调节[2], 进一步与炎症“促进-消散”稳态紧密关联, 具体体现在: ①铁调控是机体实现抗原清除的重要手段: 在病原体感染的情况下, 机体通过铁稳态调节, 降低血液中铁的可用性, 抑制病原体的增殖, 维持体内免疫稳态。如在血色素沉着症小鼠模型中, 限制铁的含量可以有效控制小鼠伤寒沙门氏菌感染[3]; ②铁是触发炎症反应、维系促炎水平的重要标志: 铁在细胞内的浓度水平与微环境的炎症状态呈正相关关系, 特别是铁的胞内过载会上调免疫细胞的炎症水平和加重炎症损伤的状态, 成为包括癌症、神经退行性疾病等多种器官损伤的重要病理机制[4]。在这一过程中, 铁对免疫环境的影响取决于铁的含量及参与的免疫细胞的类型, 如铁过载会通过增殖、程序性死亡等途径对不同的T细胞亚群产生广泛的影响, 抑制TH1细胞主转录因子T-BET及B细胞抗体IgG的表达, 扰乱TH1/TH2平衡, 并间接影响粒细胞的募集和NK细胞的活化[5]; 此外, 铁也会通过细胞代谢、表观遗传等调节巨噬细胞表型转化, 发挥促炎或抑炎功能。综上可知, 铁稳态与炎症稳态彼此偶联、双向互动, 构成机体生命活动协同整合的功能单元, 成为机体内环境稳态调节的核心要素。在众多铁的稳态调节机制中, 铁的吸收及释放(转运) 平衡是维持铁稳态的关键步骤, 也是细胞利用铁进行生命活动的前提与保障, 更是进行疾病干预和稳态重塑的可行途径。
巨噬细胞是机体重要的天然免疫细胞, 广泛参与了抗原摄取、递呈、免疫杀伤、组织修复等过程。在炎症反应中, 巨噬细胞对于炎症“促进-消散”平衡具有双向、动态的调控特征, 其功能表型具有极强的可塑性和矛盾性。
铁稳态和铁转运平衡中, 巨噬细胞同样发挥着核心的调控作用: 人体内铁主要通过红细胞血红蛋白进行循环利用, 人体内大约有4 g铁, 其中2.5 g的铁存在于血红蛋白中[6], 被红细胞运输到达全身各处, 红细胞受损或衰老后由巨噬细胞进行识别并触发红细胞吞噬程序; 血液中破裂的红细胞释放出的游离血红蛋白和血红素进入巨噬细胞。与之相对应, 人体大概每秒产生250万红细胞, 此生成过程需要消耗大量的铁, 其中约90%的铁来自被巨噬细胞回收的衰老、破坏的红细胞[7]。另外, 当巨噬细胞膜铁转运蛋白(ferroportin-1, FPN1) 发生铁转出异常时, 机体将出现明显的铁稳态失稳, 巨噬细胞成为铁释放的重要来源[8]。这对铁在体内的高效循环利用、平衡有序代谢及可用性调节具有重要意义[9, 10]。
基于上述巨噬细胞在免疫和铁稳态中的双重核心作用, 现在研究表明: 巨噬细胞介导的铁转运平衡是“铁-炎”稳态偶联机制中的关联节点。铁在巨噬细胞中转运的相对平衡与巨噬细胞介导的炎症“促-消”稳态紧密整合。聚焦巨噬细胞, 充分梳理其中参与铁转运平衡的分子机制, 对于理解“铁-炎”稳态、发掘铁转运平衡对于炎症性疾病的治疗价值具有重要意义。
1 巨噬细胞与铁转运平衡巨噬细胞是铁转运平衡的典型代表性细胞类型, 在机体铁稳态调节中发挥了核心性作用, 具体表现为: ①在铁的细胞转入过程中, 巨噬细胞通过特异性铁运输通道, 成为摄取利用铁的代表性细胞类群, 负责对机体内半数以上的铁进行回收利用, 在机体铁稳态的调节中扮演着最为重要的角色[6]; ②在铁的细胞转出过程中, 巨噬细胞表面的FPN1相关分子体系是重要的介导机制。巨噬细胞内的铁被释放入血并以转铁蛋白(transferrin, Tf) 结合的方式进行循环, 经需铁细胞表面的转铁蛋白受体1 (transferrin receptor 1, TfR1) 作用进入细胞。铁在巨噬细胞中的转入、转出平衡共同构成了巨噬细胞的铁转运平衡。巨噬细胞的铁转运途径大致分为以下两个部分。
1.1 巨噬细胞的铁转入巨噬细胞与其他需铁细胞摄取铁的途径不同, 大致遵循两条途径将铁摄入胞内并加以利用: ①摄取血红素铁: 血红素铁是与血红蛋白及肌红蛋白中的卟啉结合而形成的铁。可通过细胞膜表面的CD91 (热休克蛋白的共同受体)、CD163 (血红蛋白清道夫受体富含半胱氨酸超家族的成员)、血红素载体蛋白1等被摄入细胞[11]; ②摄取非血红素铁: 非血红素铁指含于蛋白质或蛋白质复合体中血红素形态以外的铁离子。主要通过吞噬受损或衰老的红细胞对铁进行分离并回收利用[11, 12], 或通过TfR1、二价金属转运蛋白1 (divalent metal transporter 1, DMT1)、天然抗性相关的巨噬细胞蛋白1对非血红素铁进行摄入[13]。此外, 人们还发现了一种名为脂质运载蛋白-2 (lipocalin-2, Lcn-2) 的载体蛋白, 它既可以与铁进行结合转入巨噬细胞, 又可以部分与细菌的铁载体进行结合。巨噬细胞在机体发生感染时可上调Lcn-2的表达, 增强对细菌铁的隔离作用[14]。Lcn-2的铁转运作用独立于Tf存在[15], 二者承载的铁虽在进入胞内后经历的加工方式及位置有所区别, 但皆可实现巨噬细胞对铁的回收利用[16]。
在上述途径的紧密协同配合下, 铁处于“机体内部循环利用(对膳食中铁的依赖性较低)、双向动态平衡调节(对吸收-释放具有双向调节作用)”的状态。巨噬细胞在吞噬受损或衰老的红细胞后, 红细胞被活性氧类和水解酶解离, 释放血红蛋白和血红素, 在血红素加氧酶1 (heme oxygenase-1, HO-1) 的作用下将血红素消化成等摩尔数量的铁、一氧化碳和胆绿素, 完成对红细胞内铁的回收[6]。除此之外, 在以TfR1与DMT1为代表的铁转入靶点研究中, 血清中的大部分铁与Tf结合, 以饱和转铁蛋白的形式将结合铁传递给TfR1, 携载的Fe3+经金属还原酶还原为Fe2+, 再由DMT1将其运输进入细胞[17]。在细胞发生缺氧或缺铁的情况下, 缺氧诱导因子(hypoxia inducible factor, HIF)-缺氧反应元件(hypoxia-response elements, HRE) 系统、铁调节蛋白(iron regulatory proteins, IRPs)-铁响应元件(iron response element, IRE) 系统积极响应以诱导TfR1基因转录[18], 促进其表达量增加, 加强细胞对铁的摄取。DMT1的表达不仅受IRPs-IRE系统的影响, 还会受到泛素-蛋白酶体系统的调控[19]。当细胞铁缺乏时, 泛素-蛋白酶体系统与DMT1之间的相互作用降低, 如Nedd家族相互作用蛋白Ndfip1和Ndfip2被泛素连接酶WWP2募集的能力下降, 减弱DMT1泛素化及溶酶体、蛋白酶体的降解, 使DMT1的数量、活性升高, 增强铁的摄入能力[20]。
1.2 巨噬细胞的铁储存在巨噬细胞的铁储存机制中, IRPs与IRE的相互作用是核心机制, 尤其对铁蛋白和不稳定铁池(labile intracellular iron pool, LIP) 的调控成为巨噬细胞铁储存的重要枢纽[21]。进入巨噬细胞中的铁储存在铁蛋白或不稳定铁池中[8]。铁蛋白是体内铁的主要储存形式, Fe2+在蛋白质外鞘中与分子氧反应被氧化为Fe3+, Fe3+向空腔表面移动形成铁核并逐渐增大[22], 当胞内铁含量较低时, IRPs与IRE结合, 增加TfR mRNA, 降低铁蛋白mRNA; LIP中储存游离的铁离子, 是一种快速响应细胞对铁的需求的形式, IRPs和IRE的相互作用也可以作为LIP的传感器, 避免过量的“游离”铁存于胞内[8]。综上所述, IRPs与IRE的结合是巨噬细胞铁储存的重要通路。
1.3 巨噬细胞的铁转出FPN1是目前唯一已知的哺乳动物细胞铁输出蛋白[21, 23], 需要在膜铁转运辅助蛋白的辅助下将输出细胞的Fe2+氧化为Fe3+, 以方便与Tf结合并进行下一步的转运。FPN1在铁转运平衡中的作用不可忽视, 其表达主要受到hepcidin和IRPs两方面的影响[21]。一方面, 当机体的铁含量较低时, hepcidin的表达量会减少, 放松对FPN1蛋白功能的抑制, 可使铁由胞内向外持续转运; 当机体的铁含量较高时, hepcidin的表达量将会增加, hepcidin与FPN1大量结合, 使FPN1的蛋白功能降低, 过多的FPN1被内吞并进一步在溶酶体里发生降解, 从而维持细胞铁转运平衡[24]。另一方面, 铁的转出同样会受到IRPs的监控, IRP1和IRP2具有感知细胞质内铁的浓度和修饰其靶基因mRNA的功能, 在胞内低铁条件下, IRPs与FPN和铁蛋白的IRE mRNA相结合, 诱导其降解, 减少铁的输出以维持铁的转运平衡[25]。
通过上述分析可知: 在铁稳态调控的众多分子机制中, IRPs-IRE系统成为贯穿铁转运全过程的重要调控途径之一, 是机体铁稳态中不可或缺的关键靶点。在研究中发现[26], 缺乏IRPs的小鼠会导致早期胚胎死亡, 而肠道或肝脏特异性缺乏IRPs的小鼠在出生后会发生铁吸收受阻或肝脏铁超载和脂肪性肝炎, 最终因肠道营养吸收不良或肝脏衰竭发生死亡。在与IRPs-IRE系统缺陷具有直接相关关系的疾病中, 如遗传性高铁蛋白血症-白内障综合征, 同样出现了与铁相关的异常表现[26]。
2 巨噬细胞介导的铁转运对炎症稳态的影响及其在临床治疗中的复杂性巨噬细胞的铁转运会通过“铁-炎”稳态偶联关系对炎症反应“促-消”稳态产生重要的影响, 在多种炎症相关疾病的治疗中, 铁稳态与炎症稳态之间表现出极强的矛盾性及复杂性, 调控巨噬细胞的铁转运或许可以为此类疾病提供新的治疗思路。
2.1 巨噬细胞铁转运平衡与炎症稳态的关联巨噬细胞铁转运平衡与机体的炎症反应“促-消”稳态密切相关, 巨噬细胞可降低血液中铁的可用性, 阻止病原体的生长。且进入巨噬细胞的铁存储在铁蛋白中, 参与巨噬细胞内过氧化物酶等与炎症防御相关的蛋白的产生[11]。上述过程共同构成了机体免疫系统对外界和自身抗原有效防御、积极对抗的重要诱发机制。铁转运失衡将不利于炎症稳态的维持及疾病的痊愈[27], 铁的转运失衡大致分为两种情况: ① “转出远大于转入”: 此种情况下, 巨噬细胞内铁的含量降低, 将通过Toll样受体4/β干扰素TIR结构域衔接蛋白(Toll-like receptor 4/TIR-domain-containing adapter-inducing interferon-β, TLR4/TRIF) 传递信号[28]或降低胞内线粒体乌头酸酶和琥珀酸脱氢酶B的蛋白质水平[29]减少TNF-α、IL-6等炎症因子的产生。但受阻的TfR1会抑制淋巴细胞的增殖, 导致人的联合免疫缺陷[30]。有研究认为铁含量过低的巨噬细胞是自身免疫性脑脊髓炎、关节炎等疾病的致病原因[31]; ② “转入远大于转出”: 此种情况下, 巨噬细胞内表现为铁超载现象, 会促进活性氧(reactive oxygen species, ROS)、NO的生成[32], 引发脂质过氧化, 导致线粒体碎裂、线粒体膜电位改变及ATP耗尽[33], 诱导花生四烯酸通过COX/LOX/CYP450三条途径催化为前列腺素、白细胞三烯、脂氧素类、羟十二烷酸、环氧三烯酸等炎症介质[34], 进一步加重炎症症状。如具有铁超载特征的巨噬细胞在慢性静脉性腿部溃疡中被发现是促进炎症发展的关键因素[31]。
2.2 巨噬细胞铁转运平衡与功能表型极化的关联巨噬细胞的免疫功能和属性受到组织器官免疫微环境的严密调控, 进而诱导功能表型的极化状态: 当机体受到病原体、促炎因子等刺激时, 巨噬细胞极化为M1型, 释放TNF-α、IL-1β、IL-6、IL-12和IL-23等炎症因子, 直接抑杀病原体并激活适应性免疫。与之对应, M2型巨噬细胞主要由IL-4、IL-13等刺激活化, 促进炎症消散, 防止机体过度损伤, 促进组织修复[35]。病理状态下, 失衡的M1、M2极化分别与组织器官炎症病理性损伤和免疫失能、免疫逃逸紧密相关。因此, 改变极化失衡状态, 诱导极化平衡重塑, 是免疫微环境生理功能维系和复稳的机制基础。
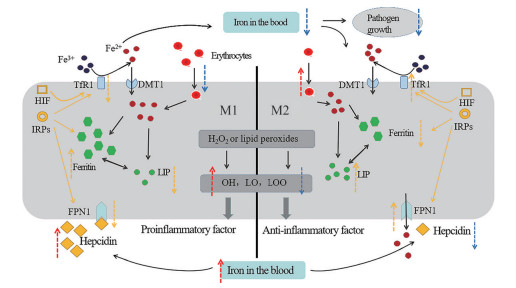
在巨噬细胞极化调控的众多机制中, 与铁的转运平衡存在双向关联、动态可塑的调控特征(图 1)。
|
Figure 1 Relationship between iron transport balance and polarization of macrophages. M1-type macrophages show the expression of high iron transfer-related protein, high ferritin and low ferroportin-1 (FPN1) expression, while M2-type macrophages show the opposite state. Macrophages recycle iron by phagocytic red blood cells to reduce the availability of iron in the blood and inhibit the growth of pathogens. However, iron in cells will react with H2O2 or lipid peroxides to produce highly active OH or LO, LOO, triggering inflammation. Iron regulatory proteins (IRPs), hypoxia inducible factor (HIF) and hepcidin act on transferrin receptor 1 (TfR1), ferritin and FPN1 to regulate iron transport in macrophages to maintain iron homeostasis |
巨噬细胞发生铁超载时, 细胞中的铁与过氧化氢(H2O2) 或脂质过氧化物反应产生高活性羟基自由基(OH) 或脂质自由基(如LO和LOO)。除此之外, ROS大量生成, 使得巨噬细胞内p53乙酰化转移酶(p300/CBP) 活性增强, 从而增加p53乙酰化, 巨噬细胞向M1型极化[36], 显著增高iNOS、TNF-α的表达, 而TGF-β1的表达却明显降低[37]。由巨噬细胞释放的大量自由基会增加黏膜和血管的通透性, 触发中性粒细胞的募集、NF-κB的激活及炎症因子和趋化因子的转录[6]。M1型巨噬细胞虽能促进机体清除入侵的病原体, 但同时会激活TH1、TH17细胞以及释放ROS、活性氮, 引发过度炎症反应对组织细胞造成损伤, 若不能实现M1型巨噬细胞应答的“令行禁止”, 将会导致机体免疫损伤的持续积累和修复失能, 这一情况常见于慢性炎症疾病及自身免疫性疾病[38]。上述病理特征在多种炎症性疾病中广泛存在, 如慢性下肢静脉溃疡[39]及慢性多发性硬化症[40]均存在铁超载触发M1型极化失衡的病理特征。
此外, 铁还可通过表观遗传调控M1型巨噬细胞极化。有研究指出, 当胞内铁超载时, 可升高miR-214的表达, 促使巨噬细胞向M1型极化。且铁可以增加JMJD3、HR23A酶的活性, 通过H3K27me3、H4K20me3去甲基化, 促使巨噬细胞M1型极化。而胞内铁缺失时, 可能会导致H3K9Ac、H3K4me3缺失或增加HDAC1、HDAC3与相关基因的结合, 降低巨噬细胞向M1型极化的诱导强度[41]。
在上述M1极化失衡状态下, 为避免巨噬细胞的炎性反应对组织造成损伤, 机体会自发启动免疫自稳机制, 对M1为主的极化表型特征进行纠偏, 诱导微环境加强M2极化功能的诱导。
2.2.2 巨噬细胞铁转运与M2表型的关联当巨噬细胞内铁的含量下降时, 低铁储存量、高FPN1表达的特征使其表现为M2表型[42]。与之相对应, 当胞内铁超载时, 铁可降低miR-29a的表达, 阻断STAT6信号通路, 抑制M2型巨噬细胞极化[41]。M2型巨噬细胞通过释放细胞因子及生长因子、吞噬作用等促进受损组织的修复、血管生成[38]。且有研究发现, 体内急性铁下调会增强糖酵解过程, 减弱氧化磷酸化, 增加巨噬细胞衣康酸与琥珀酸的比例, 从而降低巨噬细胞依赖性新月肾小球肾炎的炎症程度[43]。另外, 低铁水平诱导M2型巨噬细胞极化还可能抑制TLR4/TRAM/TRIF通路、HIF-1通路、IL-6通路等信号传导途径, 减少脂多糖诱导的促炎因子表达[28], 下调iNOS的产生[42], 降低炎症反应水平。
2.3 巨噬细胞在铁稳态中具有主动调控作用巨噬细胞不仅被动地接受微环境中铁的调控, 精准调控免疫促-消的属性(铁决定免疫状态), 还能够基于自身的免疫促-消状态, 主动且精细地调控对铁的摄取、储存和释放, 成为微环境铁含量调控的主动参与者(免疫状态改变铁)。研究者发现, M1型巨噬细胞能够增强铁蛋白、hepcidin和Lcn-2的mRNA水平, 倾向于将铁积聚于铁蛋白中, 增加铁在胞内的积累, 抑制细胞外细菌的增殖; 与之相对应, 在M2巨噬细胞中上述mRNA表达水平无明显变化, 胞内铁多储存于LIP中, 但FPN1和TfR的mRNA表达水平上调, 倾向于将铁输出, 实现铁的有效代谢和释放, 促进组织修复[44, 45]。上述机制充分地揭示出“铁-炎”稳态偶联的双向调节关系, 成为机体微环境稳态维系的重要内容。
2.4 基于“铁-炎”稳态偶联在临床治疗中的矛盾与复杂性铁稳态与炎症稳态具有紧密的联系, 必然影响炎症性疾病的疾病进程[46], 在动脉粥样硬化(atherosclerosis, AS)[47]、慢性肝病[48]、帕金森病[49]等疾病中, 巨噬细胞铁超载被认为是一种危险的信号, 如在AS中, 巨噬细胞中铁含量的升高导致其多极化为M1型, M1型巨噬细胞会通过脂质积累转化为泡沫细胞, 这一变化是AS发生的关键步骤, 而当巨噬细胞内铁的含量降低后, 机体内炎症反应随之减少, 是抗AS的有效途径[47]。
不可忽视的是, 在炎症性疾病微环境中, 往往由于慢性失血或免疫系统激活导致铁的可用性和摄取减少, 进一步发展为慢性病贫血(anemia of chronic disease, ACD)[46]。在炎症疾病中, 缺铁性贫血(iron deficiency anemia, IDA) 最为常见[24]。如在炎症性肠病(inflammatory bowel disease, IBD) 中, 约有3/4的患者因肠道出血和肠道炎症抑制铁吸收而出现铁缺乏的现象, IDA成为IBD最常见的血液并发症, 严重影响了患者的生活质量[24]。因此, 患者通常需要通过口服或注射进行补铁。然而, 这同样引发了众多问题, 成为铁炎稳态偶联治疗复杂性的代表性案例: ①口服补铁: 口服补铁剂通常以硫酸亚铁、葡萄糖酸亚铁等亚铁盐的形式为人体补充铁, 但是亚铁化合物会在肠腔或黏膜内被氧化, 释放活化的羟基自由基攻击肠壁, 引发一系列的胃肠道症状[40]; ②静脉补铁: 静脉补铁与口服补铁相比, 具有更好的增强血红蛋白及铁储备、减少胃肠反应的作用[50]。但是, 补充的铁会通过氧化还原反应催化ROS的形成, ROS通过细胞膜脂质过氧化增强黏膜损伤, 损害细胞完整性, 影响能量状态, 并会发生中性粒细胞的募集及NF-кB的激活, 加重肠道炎症反应[6]。除此之外, 进入血液的铁将有助于病原体生长。单一的补铁治疗会使机体陷入“炎症-缺铁-补铁-促炎”的恶性循环中。
上述治疗矛盾鲜明地提示, 目前单一补铁或单向抗炎的治疗方法不能实现铁与炎症真正意义上的偶联调节。这一问题极大地限制了炎症性疾病的有效治疗, 弱化了其药物干预价值。在这一背景下, 以加强机体平衡维系机制的有效运作代替对机体铁或炎的单向干预, 并将铁稳态与炎症稳态关联耦合, 形成整体、整合干预, 才能安全有效地控制炎症反应, 同时重塑炎症状态下的铁转运平衡。
综上所述, 维持巨噬细胞铁转运平衡有利于通过铁与炎症之间的稳态偶联关系维持炎症反应“促-消”稳态及炎症性疾病的转归。减轻因巨噬细胞铁超载现象为炎症反应平衡带来的影响可以为IBD、AS等疾病的治疗提供新的研究思路或药物研发策略。
3 铁稳态对炎症性疾病的治疗探讨通过上述讨论已明确铁的转运平衡可以有效调控炎症反应“促-消”稳态; 维持巨噬细胞的铁转运平衡可作为部分炎症性疾病的潜在治疗靶点, 对于疾病免疫微环境的复稳具有重要药物干预价值。目前, 巨噬细胞的铁转运平衡在炎症稳态中的治疗价值未引起足够的重视, 现有的代表性案例不够充分, 所以, 本文就铁转运相关蛋白及机体铁稳态的调节药物进行归纳和讨论, 发掘其在炎症稳态中的治疗价值, 为药物的开发及利用提供新的思路。
在上述论述中, 巨噬细胞的铁转运途径最关键的是对受损或衰老红细胞的吞噬作用及FPN1的转运作用[11, 12]。除此之外, 与铁转运过程关系最为密切的蛋白还有TfR1和DMT1[17]。铁转运相关蛋白所受的调控机制主要为IRPs-IRE系统、HIF-HRE系统及hepcidin-FPN1轴。IRPs、HIF、hepcidin的表达可直接影响铁转运相关蛋白的活性, 并进一步调控铁转运平衡以治疗炎症性相关疾病。其中, IRPs-IRE系统在铁代谢中的重要性虽已引起人们重视, 并围绕此靶点进行的病理研究已得到临床前实验的证实, 但其在炎症性相关疾病中的应用较少, 且多数抗炎药未涉及关于铁转运的探究、讨论, 故此处仅介绍基于调节HIF-HRE系统、hepcidin-FPN1轴的代表性药物在部分炎症性疾病中治疗应用。
3.1 具有HIF调控活性的炎症调节相关药物在低氧环境下, HIF与TfR1启动子中的特定元件结合, 诱导TfR1基因表达[18], 从而通过铁转运途径影响“铁-炎”稳态。HIF家族中发挥最关键作用的为HIF-1α[51], 现将具有HIF调控活性的炎症调节相关药物按中西药两类分别总结如下: ①中药: 红景天提取物及红景天苷可以稳定HIF-1α的表达, 激活mTOR通路, 刺激旁分泌功能, 促进血管新生[52], 在脓毒症、败血症、哮喘、胃溃疡等炎症性疾病中发挥明显的抗炎作用[53]; 低剂量的枸杞多糖显著抑制HIF-1α, 利于慢性阻塞性肺病的恢复, 但具体的影响机制仍未明确[54]; 大黄素下调组织中HIF-1α蛋白的表达, 降低炎症因子的生成, 通过mTOR/HIF-1α/VEGF信号通路减轻急性肺损伤的肺部炎症反应[55]; ②西药: 吖啶黄素可以有效抑制HIF-1α的积累, 在病毒性角膜基质炎中改善了中性粒细胞对浸润感染角膜的程度, 缓解了疾病的发展[56]; 地高辛通过调节PKM2/HIF-1α轴通路, 减弱HIF-1α的持续活性和氧化应激反应, 抑制肝损伤及炎症的发展[57]。
HIF与铁转入相关蛋白TfR1及DMT1的表达息息相关, 具有HIF调控活性的炎症调节相关药物在多种炎症性疾病中的研究均未涉及其与铁转运的关系, 但良好的治疗效果提示此类药物可能借助铁转运途径发挥抗炎疗效, 这有待进一步研究说明。
3.2 具有hepcidin调控活性的炎症调节相关药物在影响铁转运平衡的众多靶点中, FPN1是铁输出细胞的唯一通道[23], 调控FPN1的蛋白功能成为最不可忽视的环节。有研究[58]认为hepcidin-FPN轴是FPN1发挥蛋白功能的关键, 使用hepcidin的激动剂和拮抗剂可以有效通过FPN1影响铁的转出。胞内铁含量降低时, 需要抑制FPN1的蛋白功能, 可以使用激动剂增大hepcidin的表达量, 如大豆异黄酮染料木素被证实可以通过STAT/SMAD途径增强hepcidin的表达[59], 进一步抑制FPN1的蛋白功能, 减少细胞铁的输出。相反, hepcidin的拮抗剂可以使FPN1的蛋白功能上调, 如PRS-080#22可以与hepcidin结合从而阻断hepcidin-FPN的相互作用[60], 进一步增强FPN1的蛋白功能, 提高细胞铁的输出的能力。在IBD[61]、类风湿关节炎[62]等炎症性疾病中均发现hepcidin的表达增加, 抑制hepcidin的表达对疾病的治疗及愈后具有重要的指导意义。
当归多糖是中药材当归的水溶性活性物质之一, 具有抗肿瘤、免疫调节等药理作用。在关节炎大鼠模型中, 当归多糖可以明显抑制hepcidin的表达, 使FPN1的蛋白功能不再受阻, 上调血清中铁的含量, 减少炎症细胞因子的产生, 从而控制炎症及炎症性贫血的发生发展[63]。所以, 当归多糖可以基于调控hepcidin应用于临床上炎症性疾病的治疗。
复方脑泰方是由黄芪、川芎、僵蚕和地龙组成的中药复方, 包含黄芪甲苷、川芎嗪、阿魏酸等药效成分, 具有益气、活血、通络的功效, 有研究认为其功效与抑制神经细胞铁超载、增强抗氧化能力有关[64]。复方脑泰方可以抑制脑神经细胞铁超载, 减轻脑缺血后炎症反应, 从而对脑组织发挥保护功能[65]。有研究提出这一疗效是由于复方脑泰方可以促进FPN1表达, 防止铁在胞内发生聚集而有效地保护神经元[66]。
3.3 其他相关调控药物调节细胞铁转运过程的药物研究尚未引起足够的重视, 在现有的铁与炎症的稳态关系讨论中, 多以调节机体的铁稳态为主要研究对象, 缺乏与炎症稳态之间的关联, 现对其进行部分梳理(表 1)[67-96]。
| Table 1 Iron homeostasis related regulatory agents |
可以减少细胞铁的含量的药物又被称为“铁螯合剂”, 用于治疗铁超载相关疾病。它可以有效减少IBD等疾病中发生的自由基损伤[92]。铁螯合剂可以降低IBD的肠道炎症症状并调节铁稳态趋向于不利于病原体生长的状态, 这也明确地提示了铁稳态与炎症之间的关系。但是这也恰恰说明了目前IBD等炎症性疾病的治疗中的不足: 铁稳态与炎症稳态处于一个矛盾的恶性循环的关系中。对于缺铁的炎症性疾病而言, 补铁是必需的, 但是单一的补铁仅能解决机体缺铁的问题, 却对最需要关注的炎症本身起到了反作用。利用铁螯合剂虽可以减轻补铁对炎症的不良反应, 却又无法保证机体能否获取足够的铁。因此, 研究者需要提出一种新的治疗方案, 打破铁稳态与炎症稳态之间的恶性循环。
4 总结与展望通过上述分析, 并基于近年来铁代谢与炎症调节的最新研究成果, 可以明确得出如下结论: ①机体铁稳态与炎症稳态紧密关联, 彼此互作, 协同配合, 是调节机体内环境稳定的整合功能单元; ②铁转运平衡是实现铁稳态进而维系微环境炎症稳态的机制基础, 是铁稳态与炎症稳态偶联的桥梁单元; ③基于铁转运平衡的调节, 是以IBD、AS等为代表的炎症相关疾病微环境稳态重塑的重要治疗靶点, 包括铁螯合剂在内的多种药物在其中已经显示出明确的治疗价值, 并预测出良好的应用前景; ④在机体微环境整合联动的视角下, 基于铁与炎症稳态偶联关系的药物治疗策略具有明确的复杂性, 成为未来“铁-炎”稳态研究的重点和临床转化应用的关键。
以ACD为代表的贫血疾病是临床炎症性疾病中最常见的并发症, 患者在疾病中对补铁具有急迫的需求和必要性。但单纯补铁往往造成疾病微环境中铁浓度异常升高, 进一步诱发铁过载, 加剧病灶组织炎症反应水平, 持续炎性病理损伤。上述治疗矛盾, 是临床治疗实际应用中“铁-炎”稳态冲突的代表性案例, 困扰临床用药, 迁延疾病病程, 极大地限制了基于铁-炎联动的炎症性疾病的治疗应用, 成为提升此领域在炎症相关疾病中治疗和应用水平的关键瓶颈。
基于铁与炎症的紧密偶联关系, 此类疾病在治疗用药中需以补铁为救急, 以时时顾护“铁-炎”稳态为核心, 进行多靶点联合论治。巨噬细胞深度参与炎症性疾病进展, 密切调节机体铁的转运平衡, 是维系“铁-炎”稳态的关键桥梁, 亦是打破上述矛盾的有效平台。但目前对此关注尚有不足, 主要表现在: ①在慢性炎症性出血疾病的治疗中, 仍单一依赖降低铁含量以调控炎症, 忽视其单一靶点的抑制对于病灶微环境的级联恶化。如铁螯合剂广泛应用于IBD、全身炎症反应综合征等疾病以达到抗炎目的[6, 46], 而使用铁螯合剂后容易加重炎症性贫血; ②对于巨噬细胞在ACD等疾病中的作用, 其关注重点仅在炎症调节或促进组织修复层面, 而对巨噬细胞可逆转铁系统性失衡作用的认识尚且不足; ③在已发现的可调节铁转运相关蛋白的药物中, 缺乏对IRPs-IRE系统的调节和对巨噬细胞铁转运平衡和铁稳态影响的研究探讨; ④ Hepcidin已被发现在脾脏、肝脏和十二指肠等处对FPN1的调控表现出组织特异性[97], 不同组织的FPN1具有不同的hepcidin阈值, 或许“铁-炎”稳态的调节效率不能一概而论。因此, 对于以ACD为代表的疾病, 未来应立足于以“免疫复稳”联动“铁复稳”的治疗策略; 以调节巨噬细胞为代表的免疫调节制剂与铁剂联合使用的用药原则, 多层次共同论治; 围绕IRPs-IRE的临床前实验进行临床应用转化, 不断开发可调节铁转运相关蛋白的药物, 并发掘其在巨噬细胞铁转运与机体铁代谢中的调节作用; 在药物的基础上突破组织特异性对铁、炎症稳态复稳的阻碍, 实现高效治疗。
值得注意的是, 上述铁-炎稳态偶联机制不仅对炎症相关疾病产生影响, 更在多种代谢性疾病中凸显其核心作用。非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)、2型糖尿病(type 2 diabetes, T2D)、AS等代谢性疾病具有典型的炎症失衡性特征, 是代谢与免疫失稳的代表性疾病。而其中炎症失衡的重要诱因之一是铁代谢的失稳。巨噬细胞可以在此类疾病中显著地调控“铁-炎”稳态, 通过改变自身极化状态进而对代谢性疾病产生理想的治疗价值。不同疾病中的特异性巨噬细胞在铁-炎调控方面的价值也得到了验证, 如在NAFLD中, 被招募的单核细胞来源的巨噬细胞通过维持铁稳态可以有效地调控其极化状态并减轻NAFLD中发生的肝脏炎症及损伤[27]; T2D主要是由肥胖引发的胰岛素抵抗导致的, 肥胖促使脂肪组织巨噬细胞(adipose tissue macrophages, ATMs) 表现为M1表型, M1巨噬细胞分泌炎症细胞因子导致脂肪组织的胰岛素抵抗, 干预T2D患者的铁水平可以影响ATMs极化方向, 有效改善疾病状态并阻止其并发症的发生发展[98]; 同样地, 在AS斑块中, M1型巨噬细胞被认为在炎症及AS中发挥促进作用, 靶向巨噬细胞的铁代谢对AS具有一定的治疗作用[99]。综上, 聚焦于组织特异性的巨噬细胞极化调控, 铁稳态是多种代谢性疾病进展、治疗、转归的核心要素, 也成为未来基于铁-炎稳态偶联开展药物干预的潜在靶点, 具有明确的应用价值。
综上所述, 在炎症性相关疾病、代谢性疾病等多种机体复杂系统性疾病的治疗中, 铁-炎稳态不仅揭示出驱动疾病进展的病理基础, 更指引出治疗的可行方向。这一领域的药物研发, 应通过多靶点联合干预, 以维系稳态代替单向补充, 突出平衡调节的核心价值。而与西药相比, 中医药多成分、多途径、多靶点联合干预、重视平衡调节的治疗特色恰恰符合铁-炎相关疾病的治疗所需。这一思路有望突破补铁与促炎之间的矛盾关系, 解决铁与炎症关联治疗的瓶颈, 强化临床应用有效性和安全性的关键途径。“加强铁-炎治疗联动、实现稳态紧密偶联”, 亦是本综述撰写的理论主线, 希望能够引发读者在这一领域的深度思考。
作者贡献: 杨丽娜负责选题、图表制作和文章撰写; 杜欣珂、刘丽和李曼菁负责文章的撰写和修改; 冉庆森、孙立东、杨庆、李玉洁和陈颖参与了文章的修改并检查了图表内容; 朱晓新研究员对稿件版本进行了评论; 李琦副研究员负责文章的选题和思路, 提出框架及文章的修改, 为该文章的主要负责人。所有作者批阅并准许了最终稿件。
利益冲突: 所有作者均声明本论文与其他人或机构无任何利益冲突。
| [1] |
Zhang DL, Ghosh MC, Rouault TA. The physiological functions of iron regulatory proteins in iron homeostasis-an update[J]. Front Pharmacol, 2014, 5: 124. |
| [2] |
Mu QD, Chen LY, Gao XT, et al. The role of iron homeostasis in remodeling immune function and regulating inflammatory disease[J]. Sci Bull, 2021, 66: 1806-1816. DOI:10.1016/j.scib.2021.02.010 |
| [3] |
Nairz M, Theurl I, Schroll A, et al. Absence of functional Hfe protects mice from invasive Salmonella enterica serovar Typhimurium infection via induction of lipocalin-2[J]. Blood, 2009, 114: 3642-3651. |
| [4] |
Xu S, Min JX, Wang FD. Ferroptosis: an emerging player in immune cells[J]. Sci Bull, 2021, 66: 2257-2260. DOI:10.1016/j.scib.2021.02.026 |
| [5] |
Nairz M, Weiss G. Iron in infection and immunity[J]. Mol Aspects Med, 2020, 75: 100864. DOI:10.1016/j.mam.2020.100864 |
| [6] |
Chieppa M, Galleggiante V, Serino G, et al. Iron chelators dictate immune cells inflammatory ability: potential adjuvant therapy for IBD[J]. Curr Pharm Des, 2017, 23: 2289-2298. |
| [7] |
Slusarczyk P, Mleczko-Sanecka K. The multiple facets of iron recycling[J]. Genes (Basel), 2021, 12: 1364. DOI:10.3390/genes12091364 |
| [8] |
Camaschella C, Nai A, Silvestri L. Iron metabolism and iron disorders revisited in the hepcidin era[J]. Haematologica, 2020, 105: 260-272. DOI:10.3324/haematol.2019.232124 |
| [9] |
Hvidberg V, Maniecki MB, Jacobsen C, et al. Identification of the receptor scavenging hemopexin-heme complexes[J]. Blood, 2005, 106: 2572-2579. |
| [10] |
Sabelli M, Montosi G, Garuti C, et al. Human macrophage ferroportin biology and the basis for the ferroportin disease[J]. Hepatology, 2017, 65: 1512-1525. DOI:10.1002/hep.29007 |
| [11] |
Jiang H, Li MQ, Hu JN, et al. Regulation of iron metabolism by macrophages[J]. Med Sci)(南通大学学报医学版, 2021, 41: 344-348. |
| [12] |
Hentze MW, Muckenthaler MU, Galy B, et al. Two to tango: regulation of Mammalian iron metabolism[J]. Cell, 2010, 142: 24-38. DOI:10.1016/j.cell.2010.06.028 |
| [13] |
Soe-Lin S, Apte SS, Mikhael MR, et al. Both Nramp1 and DMT1 are necessary for efficient macrophage iron recycling[J]. Exp Hematol, 2010, 38: 609-617. DOI:10.1016/j.exphem.2010.04.003 |
| [14] |
Xiao X, Yeoh BS, Vijay-Kumar M. Lipocalin 2: an emerging player in iron homeostasis and inflammation[J]. Annu Rev Nutr, 2017, 37: 103-130. DOI:10.1146/annurev-nutr-071816-064559 |
| [15] |
Yang J, Goetz D, Li JY, et al. An iron delivery pathway mediated by a lipocalin[J]. Mol Cell, 2002, 10: 1045-1056. DOI:10.1016/S1097-2765(02)00710-4 |
| [16] |
Paragas N, Qiu A, Hollmen M, et al. NGAL-siderocalin in kidney disease[J]. Biochim Biophys Acta, 2012, 1823: 1451-1458. DOI:10.1016/j.bbamcr.2012.06.014 |
| [17] |
Kawabata H. Transferrin and transferrin receptors update[J]. Free Radic Biol Med, 2019, 133: 46-54. DOI:10.1016/j.freeradbiomed.2018.06.037 |
| [18] |
Gammella E, Buratti P, Cairo G, et al. The transferrin receptor: the cellular iron gate[J]. Metallomics, 2017, 9: 1367-1375. DOI:10.1039/C7MT00143F |
| [19] |
Yanatori I, Kishi F. DMT1 and iron transport[J]. Free Radic Biol Med, 2019, 133: 55-63. DOI:10.1016/j.freeradbiomed.2018.07.020 |
| [20] |
Foot NJ, Dalton HE, Shearwin-Whyatt LM, et al. Regulation of the divalent metal ion transporter DMT1 and iron homeostasis by a ubiquitin-dependent mechanism involving Ndfips and WWP2[J]. Blood, 2008, 112: 4268-4275. |
| [21] |
Gao G, Li J, Zhang Y, et al. Cellular iron metabolism and regulation[J]. Adv Exp Med Biol, 2019, 1173: 21-32. |
| [22] |
Liu BJ, Zhang WB. Structure, function and expression regulation of ferritin[J]. 饲料工业, 2009, 30: 42-47. |
| [23] |
Oh CK, Park SH, Kim J, et al. Non-mutagenic suppression of enterocyte ferroportin 1 by chemical ribosomal inactivation via p38 mitogen-activated protein kinase (MAPK)-mediated regulation: evidence for environmental hemochromatosis[J]. J Biol Chem, 2016, 291: 19858-19872. DOI:10.1074/jbc.M116.722520 |
| [24] |
Stein J, Hartmann F, Dignass AU. Diagnosis and management of iron deficiency anemia in patients with IBD[J]. Nat Rev Gastroenterol Hepatol, 2010, 7: 599-610. DOI:10.1038/nrgastro.2010.151 |
| [25] |
Cappellini MD, Musallam KM, Taher AT. Iron deficiency anaemia revisited[J]. J Intern Med, 2020, 287: 153-170. DOI:10.1111/joim.13004 |
| [26] |
Wilkinson N, Pantopoulos K. The IRP/IRE system in vivo: insights from mouse models[J]. Front Pharmacol, 2014, 5: 176. |
| [27] |
Handa P, Thomas S, Morgan-Stevenson V, et al. Iron alters macrophage polarization status and leads to steatohepatitis and fibrogenesis[J]. J Leukoc Biol, 2019, 105: 1015-1026. DOI:10.1002/JLB.3A0318-108R |
| [28] |
Wang L, Harrington L, Trebicka E, et al. Selective modulation of TLR4-activated inflammatory responses by altered iron homeostasis in mice[J]. J Clin Invest, 2009, 119: 3322-3328. |
| [29] |
Pereira M, Chen TD, Buang N, et al. Acute iron deprivation reprograms human macrophage metabolism and reduces inflammation in vivo[J]. Cell Rep, 2019, 28: 498-511. DOI:10.1016/j.celrep.2019.06.039 |
| [30] |
Jabara HH, Boyden SE, Chou J, et al. A missense mutation in TFRC, encoding transferrin receptor 1, causes combined immunodeficiency[J]. Nat Genet, 2016, 48: 74-78. DOI:10.1038/ng.3465 |
| [31] |
Recalcati S, Locati M, Gammella E, et al. Iron levels in polarized macrophages: regulation of immunity and autoimmunity[J]. Autoimmun Rev, 2012, 11: 883-889. DOI:10.1016/j.autrev.2012.03.003 |
| [32] |
Sindrilaru A, Peters T, Wieschalka S, et al. An unrestrained proinflammatory M1 macrophage population induced by iron impairs wound healing in humans and mice[J]. J Clin Invest, 2011, 121: 985-997. DOI:10.1172/JCI44490 |
| [33] |
Battaglia AM, Chirillo R, Aversa I, et al. Ferroptosis and cancer: mitochondria meet the "iron maiden" cell death[J]. Cells, 2020, 9: 1505. DOI:10.3390/cells9061505 |
| [34] |
Wang T, Fu X, Chen Q, et al. Arachidonic acid metabolism and kidney inflammation[J]. Int J Mol Sci, 2019, 20: 3683. DOI:10.3390/ijms20153683 |
| [35] |
Ruan JY, Chen BC, Zhang XL, et al. Progress in signaling pathways of macrophage M1/2 polarization[J]. 免疫学杂志, 2015, 31: 911-917. |
| [36] |
Zhou Y, Que KT, Zhang Z, et al. Iron overloaded polarizes macrophage to proinflammation phenotype through ROS/acetyl-p53 pathway[J]. Cancer Med, 2018, 7: 4012-4022. DOI:10.1002/cam4.1670 |
| [37] |
Ueda N, Takasawa K. Role of hepcidin-25 in chronic kidney disease: anemia and beyond[J]. Curr Med Chem, 2017, 24: 1417-1452. |
| [38] |
Gong TT, Huang SG, Zhang Y, et al. Polarization and functional regulation of macrophages[J]. 解剖学报, 2017, 48: 106-110. |
| [39] |
Gillen KM, Mubarak M, Nguyen TD, et al. Significance and in vivo detection of iron-laden microglia in white matter multiple sclerosis lesions[J]. Front Immunol, 2018, 9: 255. DOI:10.3389/fimmu.2018.00255 |
| [40] |
Millar AD, Rampton DS, Blake DR. Effects of iron and iron chelation in vitro on mucosal oxidant activity in ulcerative colitis[J]. Aliment Pharmacol Ther, 2000, 14: 1163-1168. DOI:10.1046/j.1365-2036.2000.00828.x |
| [41] |
Xia Y, Li Y, Wu X, et al. Ironing out the details: how iron orchestrates macrophage polarization[J]. Front Immunol, 2021, 12: 669566. DOI:10.3389/fimmu.2021.669566 |
| [42] |
Zhu L, Zhao Q, Yang T, et al. Cellular metabolism and macrophage functional polarization[J]. Int Rev Immunol, 2015, 34: 82-100. DOI:10.3109/08830185.2014.969421 |
| [43] |
Zhang L, Jiang Y, He JY, et al. Effects of iron deposition on mRNA expression of TGF-β1, iNOS and TNF-α in macrophages [C]// The 14th National Conference on Hepatobiliary Diseases (全国第十四次肝胆病学术会议). Shanghai: China Association of Traditional Chinese Medicine, 2010: 232-238.
|
| [44] |
Corna G, Campana L, Pignatti E, et al. Polarization dictates iron handling by inflammatory and alternatively activated macrophages[J]. Haematologica, 2010, 95: 1814-1822. DOI:10.3324/haematol.2010.023879 |
| [45] |
Li YQ, Liang L, Gan ZS, et al. Polarized activation affects iron metabolism in macrophages[J]. 生理学报, 2021, 73: 244-252. |
| [46] |
Lehmann C, Islam S, Jarosch S, et al. The utility of iron chelators in the management of inflammatory disorders[J]. Mediators Inflamm, 2015, 2015: 516740. |
| [47] |
Abulimiti A, ·Yisimitila T, ·Nijiati M. The emerging role of iron in the progression of arteriosclerosis[J]. 医学综述, 2021, 27: 4593-4597. |
| [48] |
Wallace DF, Subramaniam VN. Co-factors in liver disease: the role of HFE-related hereditary hemochromatosis and iron[J]. Biochim Biophys Acta, 2009, 1790: 663-670. DOI:10.1016/j.bbagen.2008.09.002 |
| [49] |
Graham JM, Paley MN, Grünewald RA, et al. Brain iron deposition in Parkinson's disease imaged using the PRIME magnetic resonance sequence[J]. Brain, 2000, 123 Pt 12: 2423-2431. |
| [50] |
Hu P, Tao H, Wan CC, et al. Meta analysis of the effect of oral and intravenous iron supplementation on anemia caused by inflammatory bowel disease[J]. 湖北医药学院学报, 2018, 37: 232-237. |
| [51] |
Zhao SH, Li HY. Advances in role of hypoxia-inducible factor 1α in inflammation[J]. 中国免疫学杂志, 2020, 36: 2809-2814. |
| [52] |
Li Y, Pham V, Bui M, et al. Rhodiola rosea L.: an herb with anti-stress, anti-aging, and immunostimulating properties for cancer chemoprevention[J]. Curr Pharmacol Rep, 2017, 3: 384-395. DOI:10.1007/s40495-017-0106-1 |
| [53] |
Pu WL, Zhang MY, Bai RY, et al. Anti-inflammatory effects of Rhodiola rosea L.: a review[J]. Biomed Pharmacother, 2020, 121: 109552. DOI:10.1016/j.biopha.2019.109552 |
| [54] |
Chen LJ, Xu W, Li YP, et al. Lycium barbarum polysaccharide inhibited hypoxia-inducible factor 1 in COPD patients[J]. Int J Chron Obstruct Pulmon Dis, 2020, 15: 1997-2004. DOI:10.2147/COPD.S254172 |
| [55] |
Li X, Shan C, Wu Z, et al. Emodin alleviated pulmonary inflammation in rats with LPS-induced acute lung injury through inhibiting the mTOR/HIF-1α/VEGF signaling pathway[J]. Inflamm Res, 2020, 69: 365-373. DOI:10.1007/s00011-020-01331-3 |
| [56] |
Rao P, Suvas S. Development of inflammatory hypoxia and prevalence of glycolytic metabolism in progressing herpes stromal keratitis lesions[J]. J Immunol, 2019, 202: 514-526. DOI:10.4049/jimmunol.1800422 |
| [57] |
Zhao P, Han SN, Arumugam S, et al. Digoxin improves steatohepatitis with differential involvement of liver cell subsets in mice through inhibition of PKM2 transactivation[J]. Am J Physiol Gastrointest Liver Physiol, 2019, 317: G387-G397. DOI:10.1152/ajpgi.00054.2019 |
| [58] |
Agarwal AK, Yee J. Hepcidin[J]. Adv Chronic Kidney Dis, 2019, 26: 298-305. DOI:10.1053/j.ackd.2019.04.005 |
| [59] |
Zhen AW, Nguyen NH, Gibert Y, et al. The small molecule, genistein, increases hepcidin expression in human hepatocytes[J]. Hepatology, 2013, 58: 1315-1325. DOI:10.1002/hep.26490 |
| [60] |
Renders L, Budde K, Rosenberger C, et al. First-in-human phase Ⅰ studies of PRS-080#22, a hepcidin antagonist, in healthy volunteers and patients with chronic kidney disease undergoing hemodialysis[J]. PLoS One, 2019, 14: e0212023. DOI:10.1371/journal.pone.0212023 |
| [61] |
Zhang L. The Clinical Study on Serum Hepcidin in Patients with Inflammatory Bowel Disease (血清铁调素在炎症性肠病患者中的临床研究) [D]. Suzhou: Soochow University, 2017.
|
| [62] |
Tang L, Zhang Y, Zhang HY. Correlation of the hepcidin content with iron metabolism, inflammatory response and immune response in patients with rheumatoid arthritis combined with anemia[J]. 海南医学院学报, 2018, 24: 1479-1482. |
| [63] |
Li MM, Wu J, Zhang QL, et al. Inhibitory effects of Angelica sinensis polysaccharide on hepcidin expression in SD rats with anemia of chronic disease[J]. 中国医院药学杂志, 2016, 36: 639-643. |
| [64] |
Mi ZD, LAN Bin, Cheng SW, et al. Association analysis of pharmacological effects and effective components in Naotai Fang, a compound Chinese herbal medicine[J]. 世界科学技术-中医药现代化, 2021, 23: 1997-2005. |
| [65] |
Zeng JS. To Study the Pathological Mechanism of Secondary Brain Injury after Intracerebral Hemorrhage and the Intervention Effect of Naotaifang based on Iron Death (基于铁死亡研究脑出血后继发性脑损伤病理机制及脑泰方的干预作用) [D]. Changsha: Hunan University of Chinese Medicine, 2020.
|
| [66] |
Liao J, Xia X, Wang GZ, et al. Naotaifang extract treatment results in increased ferroportin expression in the hippocampus of rats subjected to cerebral ischemia[J]. Mol Med Rep, 2015, 11: 4047-4052. DOI:10.3892/mmr.2015.3309 |
| [67] |
Zhao Y, Li Y, Zhang R, et al. The role of erastin in ferroptosis and its prospects in cancer therapy[J]. Onco Targets Ther, 2020, 13: 5429-5441. DOI:10.2147/OTT.S254995 |
| [68] |
Sui X, Zhang R, Liu S, et al. RSL3 drives ferroptosis through GPX4 inactivation and ROS production in colorectal cancer[J]. Front Pharmacol, 2018, 9: 1371. DOI:10.3389/fphar.2018.01371 |
| [69] |
Cotticelli MG, Xia S, Lin D, et al. Ferroptosis as a novel therapeutic target for Friedreich's ataxia[J]. J Pharmacol Exp Ther, 2019, 369: 47-54. DOI:10.1124/jpet.118.252759 |
| [70] |
Li ZJ, Dai HQ, Huang XW, et al. Artesunate synergizes with sorafenib to induce ferroptosis in hepatocellular carcinoma[J]. Acta Pharmacol Sin, 2021, 42: 301-310. DOI:10.1038/s41401-020-0478-3 |
| [71] |
Yu H, Yang C, Jian L, et al. Sulfasalazine-induced ferroptosis in breast cancer cells is reduced by the inhibitory effect of estrogen receptor on the transferrin receptor[J]. Oncol Rep, 2019, 42: 826-838. |
| [72] |
Efferth T. From ancient herb to modern drug: Artemisia annua and artemisinin for cancer therapy[J]. Semin Cancer Biol, 2017, 46: 65-83. DOI:10.1016/j.semcancer.2017.02.009 |
| [73] |
Yamaguchi Y, Kasukabe T, Kumakura S. Piperlongumine rapidly induces the death of human pancreatic cancer cells mainly through the induction of ferroptosis[J]. Int J Oncol, 2018, 52: 1011-1022. |
| [74] |
Lv HH, Zhen CX, Liu JY, et al. PEITC triggers multiple forms of cell death by GSH-iron-ROS regulation in K7M2 murine osteosarcoma cells[J]. Acta Pharmacol Sin, 2020, 41: 1119-1132. DOI:10.1038/s41401-020-0376-8 |
| [75] |
Guan Z, Chen J, Li X, et al. Tanshinone IIA induces ferroptosis in gastric cancer cells through p53-mediated SLC7A11 down-regulation[J]. Biosci Rep, 2020, 40: BSR20201807. DOI:10.1042/BSR20201807 |
| [76] |
Lin PL, Tang HH, Wu SY, et al. Saponin formosanin C-induced ferritinophagy and ferroptosis in human hepatocellular carcinoma cells[J]. Antioxidants (Basel), 2020, 9: 682. DOI:10.3390/antiox9080682 |
| [77] |
Chen P, Wu Q, Feng J, et al. Erianin, a novel dibenzyl compound in Dendrobium extract, inhibits lung cancer cell growth and migration via calcium/calmodulin-dependent ferroptosis[J]. Signal Transduct Target Ther, 2020, 5: 51. DOI:10.1038/s41392-020-0149-3 |
| [78] |
Ou HY, Ye XP, Li S, et al. Study on medication rules of herbs in the regulation of ferroptosis based on network pharmacology and data mining[J]. 中国现代应用药学, 2019, 36: 2317-2324. |
| [79] |
Tian YY, Yang AL, Chen XN, et al. Effect of Huaier aqueous extract on growth and metastasis of human non-small cell lung cancer NCI-H1299 cells and its underlying mechanisms[J]. 中国中药杂志, 2020, 45: 3700-3706. |
| [80] |
Kasukabe T, Honma Y, Okabe-Kado J, et al. Combined treatment with cotylenin A and phenethyl isothiocyanate induces strong antitumor activity mainly through the induction of ferroptotic cell death in human pancreatic cancer cells[J]. Oncol Rep, 2016, 36: 968-976. DOI:10.3892/or.2016.4867 |
| [81] |
Fang X, Cai Z, Wang H, et al. Loss of cardiac ferritin H facilitates cardiomyopathy via SLC7A11-mediated ferroptosis[J]. Circ Res, 2020, 127: 486-501. DOI:10.1161/CIRCRESAHA.120.316509 |
| [82] |
Fan BY, Pang YL, Li WX, et al. Liproxstatin-1 is an effective inhibitor of oligodendrocyte ferroptosis induced by inhibition of glutathione peroxidase 4[J]. Neural Regen Res, 2021, 16: 561-566. DOI:10.4103/1673-5374.293157 |
| [83] |
Yao X, Zhang Y, Hao J, et al. Deferoxamine promotes recovery of traumatic spinal cord injury by inhibiting ferroptosis[J]. Neural Regen Res, 2019, 14: 532-541. DOI:10.4103/1673-5374.245480 |
| [84] |
Vermylen C. What is new in iron overload?[J]. Eur J Pediatr, 2008, 167: 377-381. DOI:10.1007/s00431-007-0604-y |
| [85] |
Manabe E, Ito S, Ohno Y, et al. Reduced lifespan of erythrocytes in Dahl/Salt sensitive rats is the cause of the renal proximal tubule damage[J]. Sci Rep, 2020, 10: 22023. DOI:10.1038/s41598-020-79146-9 |
| [86] |
Zilka O, Poon JF, Pratt DA. Radical-trapping antioxidant activity of copper and nickel bis(thiosemicarbazone) complexes underlies their potency as inhibitors of ferroptotic cell death[J]. J Am Chem Soc, 2021, 143: 19043-19057. DOI:10.1021/jacs.1c08254 |
| [87] |
Bergeron RJ, Wiegand J, McManis JS, et al. Desferrithiocin: a search for clinically effective iron chelators[J]. J Med Chem, 2014, 57: 9259-9291. DOI:10.1021/jm500828f |
| [88] |
Perez CA, Wei Y, Guo M. Iron-binding and anti-fenton properties of baicalein and baicalin[J]. J Inorg Biochem, 2009, 103: 326-332. DOI:10.1016/j.jinorgbio.2008.11.003 |
| [89] |
Liu B, Zhao C, Li H, et al. Puerarin protects against heart failure induced by pressure overload through mitigation of ferroptosis[J]. Biochem Biophys Res Commun, 2018, 497: 233-240. DOI:10.1016/j.bbrc.2018.02.061 |
| [90] |
Shan X, Lv ZY, Yin MJ, et al. The protective effect of cyanidin-3-glucoside on myocardial ischemia-reperfusion injury through ferroptosis[J]. Oxid Med Cell Longev, 2021, 2021: 8880141. |
| [91] |
Wang Y, Quan F, Cao Q, et al. Quercetin alleviates acute kidney injury by inhibiting ferroptosis[J]. J Adv Res, 2020, 28: 231-243. |
| [92] |
Minaiyan M, Mostaghel E, Mahzouni P. Preventive therapy of experimental colitis with selected iron chelators and anti-oxidants[J]. Int J Prev Med, 2012, 3 Suppl 1: S162-S169. |
| [93] |
Tang X, Ding H, Liang M, et al. Curcumin induces ferroptosis in non-small-cell lung cancer via activating autophagy[J]. Thorac Cancer, 2021, 12: 1219-1230. DOI:10.1111/1759-7714.13904 |
| [94] |
Cao CC. Study on The Active Components of Enhancing Iron Absorption of Donkey-hide Gelatin and Its Iron Chelate on Blood Tonic Effect (阿胶促铁吸收的活性成分及其铁螯合物的补血作用研究) [D]. Wuxi: Jiangnan University, 2021.
|
| [95] |
Wu DJ, Wen XW, Liu WB, et al. Iron metabolism regulation effect of Bushen Huoxue Formula in aplastic anemia mouse complicated with iron overload[J]. 中华中医药杂志, 2021, 36: 3856-3862. |
| [96] |
Wang J, Jia LQ, Song N, et al. Sijunzi decoction improves lipid deposition in atherosclerotic mice via iron death pathway[J]. 解剖科学进展, 2021, 27: 75-78. |
| [97] |
Katsarou A, Gkouvatsos K, Fillebeen C, et al. Tissue-specific regulation of ferroportin in wild-type and Hjv-/- mice following dietary iron manipulations[J]. Hepatol Commun, 2021, 5: 2139-2150. DOI:10.1002/hep4.1780 |
| [98] |
Paeschke S, Baum P, Toyka KV, et al. The role of iron and nerve inflammation in diabetes mellitus type 2-induced peripheral neuropathy[J]. Neuroscience, 2019, 406: 496-509. DOI:10.1016/j.neuroscience.2019.03.005 |
| [99] |
Cornelissen A, Guo L, Sakamoto A, et al. New insights into the role of iron in inflammation and atherosclerosis[J]. EBioMedicine, 2019, 47: 598-606. DOI:10.1016/j.ebiom.2019.08.014 |
 2022, Vol. 57
2022, Vol. 57


