2. 北京中医药大学中药学院中药现代研究中心, 北京 100029;
3. 中药材规范化生产教育部工程研究中心, 北京 100102
2. Modern Research Center for Traditional Chinese Medicine, School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100029, China;
3. Engineering Research Center of Good Agricultural Practice for Chinese Crude Drugs of Ministry of Education, Beijing 100102, China
三七(Panax notoginseng) 是我国特有的药食两用名贵中药[1]。三七具有显著的活血化瘀、消肿定痛的功效[2], 并具有防止心脑血管疾病、抗心律失常、防止动脉粥样硬化、降血压、抗休克、抗癌、降血脂等功能[3], 被称为“参中之王”。云南省是三七道地产区[4], 云南省位于高原季风气候区, 易形成“焚风效应”[5]。受全球气候变暖和厄尔尼诺事件影响, 云南省已连续5年以上遭受干旱[6]。三七在干旱胁迫下生长发育迟缓, 产量降低, 并且连年干旱气候已对三七种植生产及品质造成了严重影响[7]。三七生长周期长, 生长环境苛刻, 喜温暖稍阴湿的环境, 忌严寒和酷暑, 对高温干旱敏感[8]。土壤中所含的盐分与植物的生长有直接联系, 当土壤含盐量处于0.2%~0.5%时, 会延缓植物的生长发育[9]。当土壤含盐量大于0.5%时, 植物生长发育则会受到抑制。当棉花种植土壤含盐量大于0.5%时, 棉花干物质的积累量急剧下降[10]。如果土壤盐分超出其耐受程度, 也会使三七生长发育延缓。三七种植区内部海拔变化较大, 当换季时, 低温灾害时有发生[11]。因此通过转录组数据分析、实时荧光定量PCR分析、转基因技术等分子生物学技术寻找与三七干旱胁迫、盐胁迫、低温胁迫的相关基因, 有利于丰富三七防御反应机制的研究, 同时通过基因工程等手段为选育三七抗逆优良品种, 提高三七产量和品质提供有利的科学支撑。
MYB转录因子是含有MYB结构域的一类转录因子, 是植物特有的一大类转录因子家族[12, 13]。MYB转录因子N端含保守的DNA结合结构域—MYB结构域[14], 它具有特异性, 该结构域一般包括1~4个大约52个氨基酸的序列重复(R), 每个重复形成3个α螺旋。其中每个重复的第二和第三个α螺旋构成了一个螺旋-转角-螺旋(HTH) 结构。根据MYB结构域数目, MYB转录因子家族可分为4个亚类[15]: 第一亚类含有一个MYB结构域(1R-MYB亚类); 第二亚类含有两个MYB结构域(R2R3-MYB亚类); 第三亚类是含有3个MYB结构域的R1R2R3-MYB亚类; 第四亚类是包含4个MYB结构域的MYB亚类, 含有4个类似R1/R2的重复结构域。4个亚类中每个MYB结构折叠成螺旋-转角-螺旋(HTH) 的形式与DNA结合[16]。随着基因组测序技术的发展, 逐渐在多种植物中鉴定了1R-MYB亚类转录因子, 如玉米[17]、山楂[18]、葡萄[19]等植物。研究表明1R-MYB转录因子在植物防御中起到重要作用。如大豆的GmMYB174基因在脱落酸(abscisic acid, ABA) 和干旱处理下其表达量下调, 盐胁迫下其表达量上调, 表明不同胁迫下该基因表达模式不相同[20]; 重金属镉胁迫及冷、热胁迫均能够显著抑制三叶草中TrMYB1R1的表达量[21]; 除此之外, 低温亦能够显著诱导蒙古沙冬青的AmMYB1R的表达[22]。
Li等[23]、Ma等[24]研究表明1R-MYB转录因子在植物防御反应中起到重要的作用。三七主根为三七药材的主要药用部位, 具有“活血化瘀、消肿止痛”的功效, 因此筛选主根中与植物防御反应相关的1R-MYB转录因子对提高三七产量和抗胁迫能力具有重要作用。但是目前在三七中关于1R-MYB转录因子抵御逆境胁迫的研究较少。本研究从三七中扩增得到一个1R-MYB转录因子PnMYB1R1, 并对其进行生物信息学分析、原核表达分析、亚细胞定位、转录活性分析及在不同非生物胁迫下的表达分析, 有利于丰富1R-MYB转录因子在植物防御反应中的重要作用研究, 为后续的三七抗胁迫机制研究奠定基础。
材料与方法材料 两年生三七栽培种苗于2021年4月从云南省文山壮族苗族自治州文山市德厚镇乐龙村移植, 种植于北京中医药大学中药学院温箱, 温箱环境为温度25 ℃, 湿度40%, 弱光照, 光照时长14 h。成活后于2021年4月选取3株三七新鲜植株, 用蒸馏水清洗3次后, 用75%乙醇对其消毒, 分别采集三七的主根、须根、茎、叶新鲜样品提取总RNA, 检测PnMYB1R1在不同器官中的特异性表达。并选取长势相同的三七, 采用水培的方法, 对其进行干旱(2% PEG6000)、盐(NaCl 150 mmol·L-1)、低温(4 ℃) 3种非生物胁迫处理, 在处理后0、12、24、36、48 h提取RNA作为样品检测PnMYB1R1基因在各种处理下的表达差异, 每组3个样品, 实验重复3次。其中, 每个处理组培养液用量均为1 L, 干旱胁迫PEG6000用量为20 g, 盐胁迫中NaCl用量为8.76 g。所用的菌种为大肠杆菌(Escherichia coli) DH5α、BL21 (DE3) 购自北京全式金科技有限公司, pET28a、pGBKT7、pCAMBIA1300-35S-GFP载体, Y2H Gold菌株购自武汉生物转导实验室有限公司。pMD19-T、LA-Taq聚合酶、KPn Ⅰ、BamH Ⅰ、Xoh Ⅰ、EcoR Ⅰ和Pst Ⅰ限制性内切酶(TaKaRa, 中国), 琼脂糖(Biowest Agrose, 西班牙), 核酸Marker和核酸染料购自(北京拜尔迪生物科技有限公司), 引物由北京六合华大基因科技有限公司合成。
仪器 冷冻高速离心机(TGL-16, 湘仪离心机仪器有限公司), 电热恒温水浴锅(HH-S4A, 北京科伟永兴仪器有限公司), 涡旋器(GL-88B, 海门市其林贝尔仪器制造有限公司), 电子天平(PL602E, METTLER TOLEDO), 凝胶成像仪(WD-9413B, 北京六一生物科技有限公司), 电泳仪(JY300E, 北京君意东方电泳设备有限公司), 超微量分光光度计(NanoDrop one, Thermo Fisher), PCR仪(T100, Bio-Rad), 激光共聚焦显微镜(FV10), 实时荧光定量PCR仪(CFX96, Bio-Rad), 恒温震荡培养箱(HZQ-211C, 上海一恒)。
三七主根、须根、茎及叶中RNA的提取和cDNA的合成 按照植物RNA提取试剂盒(Tiangen, 中国) 实验操作步骤进行植物总RNA提取, 利用NanoDrop one检测RNA浓度, 同时利用1.2%琼脂糖凝胶电泳检测RNA的完整性和质量。利用GoScript Reverse Transcription System反转录试剂盒(Promega, 美国) 将三七总RNA反转录为第一链(cDNA), 反转录条件按照说明书进行。
三七PnMYB1R1基因序列全长克隆 从三七主根高通量测序结果中, 筛选得到一个表达量较高的由表达序列标签拼接而成的序列, 经注释分析发现为具有完整开放阅读框的PnMYB1R1基因, 依据两端序列设计特异性引物PnMYB1R1-F1、PnMYB1R1-R1, 序列见表 1。以三七主根cDNA为模板, 按照下列体系对PnMYB1R1基因进行扩增: cDNA 1 μL、10×LA-Taq buffer 5 μL、dNTP Mix (2.5 mmol·L-1) 4 μL、LA-Taq (2.5 U·μL-1) 0.5 μL、10 μmol·L-1正反引物各1 μL, 终体积为50 μL。反应程序: 94 ℃预变性5 min; 然后进行30个循环, 94 ℃ 1 min, 55 ℃ 30 s, 72 ℃ 1 min, 循环结束后72 ℃延伸反应10 mim, 4 ℃保存。1%的琼脂糖凝胶电泳检测PCR产物, 凝胶成像分析系统检测, 目的片段回收和纯化按照产物纯化试剂盒(Vazyme, 中国) 进行。将回收后的PCR产物与pMD19-T连接, 转化到DH5α菌株, 在氨苄抗性的平板上进行筛选, 并经过菌落PCR检测后送北京六合华大有限公司测序。
| Table 1 Primers sequences. The red flag means the restriction enzyme sites, blue marking suggested translation initiation codon ATG |
三七PnMYB1R1生物信息学分析 通过在线软件ProtParam (https://web.expasy.org/protparam/) 预测蛋白结构, 分析目的基因编码蛋白质的氨基酸组成、蛋白质分子质量、理论等电点及稳定性等参数; 通过ExPASY中的SOPMA工具(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html) 分析蛋白质序列的二级结构; 利用软件TMHMM 2.0 (https://services.healthtech.dtu.dk/service.php?TMHMM-2.0) 进行蛋白质跨膜结构分析; 将所获得的PnMYB1R1基因编码的氨基酸序列在GenBank数据库中进行Blast P分析, 选取排名前5即相似性最高的5条序列进行分析。利用DNAMAN对PnMYB1R1、茶(Camellia sinensis) CsMYB41、河岸葡萄(Vitis riparia) VtMYB17、胡桃(Juglans regia) JrMYB17基因编码的氨基酸序列进行同源性分析; 通过MEGA 6.0软件构建Neighbor-joining系统进化树, 进化距离的计算采用泊松校正法, Bootstrap重复次数为1 000次。
三七PnMYB1R1的亚细胞定位 为探究PnMYB1R1的亚细胞定位情况, 利用引物PnMYB1R1-F2、PnMYB1R1-R2 (表 1) 扩增PnMYB1R1基因全长, 利用KPn Ⅰ和BamH Ⅰ双酶切包含有目的基因PnMYB1R1的PCR产物及双元载体pCAMBIA1300-35S-GFP, 酶切产物纯化后, 利用T4 DNA连接酶, 将酶切PCR产物与酶切载体连接, 连接产物转入大肠杆菌DH5ɑ感受态细胞。转化后挑取单克隆菌斑进行菌落PCR、测序鉴定, 对测序鉴定正确的菌斑进行摇菌扩大培养, 提取质粒pCAMBIA1300-35S-GFP-PnMYB1R1, 将重组质粒与细胞核标记物(Osghd7[25]) 共转化拟南芥原生质体, 弱光下培养8~10 h, 利用激光共聚焦显微镜检测拟南芥原生质体中融合蛋白的分布。
三七PnMYB1R1原核表达载体的构建及异源表达 利用引物PnMYB1R1-F3、PnMYB1R1-R3扩增PnMYB1R1基因的全长(表 1)。利用BamH Ⅰ和Xoh Ⅰ双酶切包含有目的基因的PCR产物及表达载体pET-28a, 酶切产物经过纯化后, 利用T4连接酶进行连接, 连接产物转化大肠杆菌DH5ɑ感受态细胞, 经菌落PCR、测序后提取质粒pET28a-PnMYB1R1, 将质粒转化大肠杆菌BL21 (DE3) 感受态细胞。挑取单菌落接种于含有卡那霉素的LB液体培养基中, 37 ℃活化过夜, 然后按照1:100比例加入新鲜的含有卡那霉素的LB液体培养基中, 37 ℃振荡培养至OD600为0.4~0.6, 调节温度为16 ℃, 加入异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside, IPTG) 后振荡培养24 h。之后4 ℃、12 000 r·min-1离心收集大肠杆菌, 悬浮于40 mmol·L-1 KPB缓冲液(pH 7.9, 含有100 mmol·L-1 NaCl, 5 mmol·L-1咪唑) 中。将菌体放置于冰上, 利用超声破碎仪(Colo Parmer) 破碎细胞, 之后4 ℃、12 000 r·min-1离心30 min以上。取上清液, 利用镍离子亲和色谱纯化PnMYB1R1蛋白, 先以20 mmol·L-1 KPB缓冲液(pH 7.9, 含有500 mmol·L-1 NaCl和40 mmol·L-1咪唑) 洗脱目的蛋白, 利用SDS-PAGE检测重组蛋白表达。
三七PnMYB1R1转录活性分析 利用引物PnMYB1R1-F4、PnMYB1R1-R4 (表 1) 扩增PnMYB1R1基因全长, 利用EcoR I和Pst I双酶切包含有目的基因PnMYB1R1的PCR产物及pGBKT7载体, 酶切产物纯化后, 利用T4 DNA连接酶, 将酶切PCR产物与酶切载体连接, 连接产物转入大肠杆菌DH5ɑ感受态细胞, 挑取经过菌落PCR、测序鉴定正确的单克隆, 提取质粒pGBKT7-PnMYB1R1, 将重组质粒转化酵母菌Y2H Gold酵母菌感受态细胞, 同时将阴性对照pGBKT7及阳性对照pGBKT7-53转入Y2H Gold酵母菌感受态细胞中, 30 ℃培养2~3天后进行菌落PCR, 以确定pGBKT7-PnMYB1R1成功转入酵母菌中。将含有重组质粒的酵母菌于SD/-Ade/-His/-Trp/X-α-gal上划线, 观察其菌斑颜色情况。
三七PnMYB1R1基因在不同组织和不同胁迫处理下的表达分析 利用实时荧光定量PCR (quantitative real-time PCR, qRT-PCR) 的方法检测三七PnMYB1R1基因在主根、须根、茎、叶中和干旱胁迫、盐胁迫、低温胁迫处理下的表达情况, 每组3个样品, 重复3次。分析使用SYBR Green I荧光染料法, 在qRT-PCR仪上进行。选取三七PnAct2基因作为目标基因定量表达的内参基因, 引物序列见表 1。反应体系中含有10 μL STBR Premix Ex Taq酶、上下游引物(10 μmol·L-1) 各0.4 μL、模板0.5 μL, 总体系为20 μL。反应程序是: 95 ℃预变性3 min, 95 ℃变性30 s, 60 ℃退火/延伸30 s (每次循环后采集荧光), 40个循环后, 95 ℃变性10 s, 65~95 ℃做熔解曲线分析, 每个温度以每步0.5 ℃上升, 每个温度停留5 s。根据熔解曲线判断RT-PCR产物的特异性, 相对定量分析采用2-ΔΔCt方法进行分析。
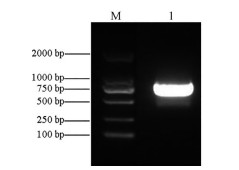
结果与分析 1 三七PnMYB1R1基因全长cDNA的克隆本研究筛选了一个在主根中表达量最高并包含完整开放阅读框(ORF) 的1R-MYB转录因子序列, 以三七主根的cDNA为模板进行扩增, 利用RT-PCR方法扩增后得到约750 bp片段, 扩增结果见图 1。将PCR产物连接到pMD19-T载体上, 测序结果经过NCBI的BLAST比对, 确定该扩增产物是1R-MYB类转录因子基因的全长, 基因命名为PnMYB1R1, 其序列长度为738 bp, 编码245个氨基酸。
|
Figure 1 PCR amplification of PnMYB1R1. M: DNA marker |
通过Protparam软件预测PnMYB1R1基因编码的蛋白理化性质。推测PnMYB1R1编码的蛋白分子式为C1180H1813N329O381S9, 总原子数为3 712, 相对分子质量为26 992.89, 理论等电点为5.23, 不稳定系数为58.51, 属于不稳定蛋白, 总亲水性为-0.490, 为亲水性蛋白。利用TMHMM2.0预测三七PnMYB1R1蛋白含有一个跨膜区域。
2.2 PnMYB1R1蛋白的二级结构分析采用ExPASY中的SOPMA工具预测PnMYB1R1基因编码蛋白的二级结构, 结果显示PnMYB1R1蛋白的二级结构是由49.80%的随机卷曲(random coil)、39.18%的α-螺旋(α-helices)、8.98%的延伸链(extended strand) 和2.04%的β-折叠(β-turn) 组成(图 2), 推测随机卷曲是其最多二级结构元件, 而α-螺旋、延伸链和β-折叠散布于整个蛋白中。

|
Figure 2 Predicted secondary structure of PnMYB1R1 protein with SOPMA. α: α-Helices; β: β-Turn; E: Extended strand; R: Random coil |
将三七PnMYB1R1氨基酸序列在GenBank数据库中进行Blast P分析, 选取排名前5即相似性最高的5条序列进行分析(图 3)。多重序列比对发现三七PnMYB1R1中含有一个保守的R3结构域, 符合第一类转录因子的特征, 属于1R-MYB型转录因子; PnMYB1R1与茶(Camellia sinensis) CsMYB41、河岸葡萄(Vitis riparia) VtMYB17、胡桃(Juglans regia) JrMYB17的相似性分别为65%、64%和63% (图 3)。除此之外, 为进一步了解三七PnMYB1R1在植物1R-MYB家族中的进化位置, 从拟南芥数据库(https://www.arabidopsis.org/) 下载拟南芥中所有的1R-MYB氨基酸序列, 利用MEGA6.0软件将其与PnMYB1R1序列构建系统进化树(图 4), 参考拟南芥MYB-related类转录因子的分类依据[26], PnMYB1R1属于TRF-like类蛋白。

|
Figure 3 Multiple sequence alignment of PnMYB1R1 and MYB from other plants. Black shading indicates amino acid identities, red and blue shading indicates amino acid with different similarity. The conserved R3 domain of MYB proteins are shown with black line. Pn: Panax notoginseng; Cs: Camellia sinensis; Vr: Vitis riparia; Jr: Juglans regia; Dz: Durio zibethinus; Si: Sesamum indicum |

|
Figure 4 Phylogenetic analysis of PnMYB1R1and 1R-MYB proteins from Arabidopsis thaliana |
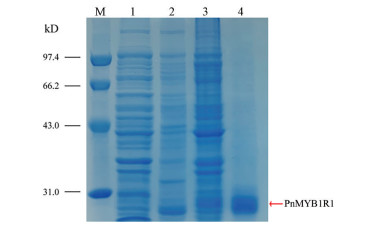
将原核表达载体pET28a-PnMYB1R1质粒转化大肠杆菌BL21 (DE3) 后, 于0.8 mmol·L-1 IPTG、16 ℃诱导24 h后进行蛋白的原核表达诱导。由于重组PnMYB1R1蛋白的氨基酸序列N端带有一个6个His (组氨酸) 的标签, 通过镍离子亲和色谱纯化PnMYB1R1蛋白, 利用SDS-PAGE检测发现在27 kD左右出现一条PnMYB1R1蛋白纯化条带(图 5)。
|
Figure 5 SDS-PAGE analysis of recombinant PnMYB1R1 protein. M: Marker; 1: Uninduced E. coli containing pET28a-PnMYB1R1; 2: Soluble protein from induced E. coli containing pET28a-PnMYB1R1; 3: Insoluble fraction from the induced E. coli containing pET28a-PnMYB1R1; 4: The purified recombinant PnMYB1R1protein |
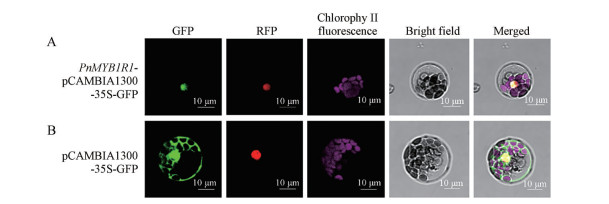
为了探究三七PnMYB1R1的作用位置, 对其进行亚细胞定位的考察。Li等[26]研究表明Osghd7定位在细胞核, 本研究将其作为细胞核标记物, 并将其与红色荧光蛋白序列融合。结果显示PnMYB1R1-pCAMBIA1300-35S-GFP融合蛋白主要分布于细胞核中, 能够与Osghd7共定位于细胞核, 而含有gfp基因的pCAMBIA1300-35S-GFP载体注射后荧光分布在细胞核、细胞质和细胞上(图 6), 这些结果表明PnMYB1R1主要定位于植物细胞的细胞核中。
|
Figure 6 Subcellular localization of pCAMBIA1300-35S-GFP-PnMYB1R1 fusion proteins in Arabidopsis thaliana leaves. A: pCAMBIA1300-35S-GFP-PnMYB1R1; B: pCAMBIA1300-35S-GFP. Bars = 10 μm |
为了研究三七PnMYB1R1的转录活性, 构建PnMYB1R1-pGBKT7重组质粒。将pGBKT7、pGBKT7-53、PnMYB1R1-pGBKT7质粒成功转入Y2H Gold酵母菌中; 之后以pGBKT7为阴性对照, pGBKT7-53为阳性对照, 在SD/-Trp-His-Ade+X-α-gal的培养基上进行培养, 实验结果表明, 含有阳性对照pGBKT7-53及PnMYB1R1-pGBKT7重组质粒酵母菌均可SD/-Trp-His-Ade+X-α-gal培养基生长并且变蓝, 含有pGBKT7的阴性对照酵母菌不能在该培养基上生长, 这些结果说明PnMYB1R1可以激活下游报告基因his3和Laz的表达, 即PnMYB1R1蛋白具有转录激活活性(图 7)。

|
Figure 7 Transcription activity of pGBKT7-PnMYB1R1 fusion proteins in Y2H Gold |
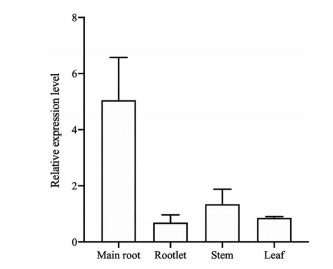
利用荧光定量PCR检测PnMYB1R1基因的组织特异性表达, 结果显示PnMYB1R1基因在三七所有组织中均有表达, 在主根中表达最高, 茎次之, 在须根和叶中表达最低, 分别为主根的13.61%和16.94%, 说明PnMYB1R1基因表达具有器官特异性(图 8)。
|
Figure 8 Relative expression level of PnMYB1R1gene in different tissue. Repeat 3 samples, each for 3 times |
为验证三七PnMYB1R1在植物防御反应中的作用, 对两年生三七分别进行盐、干旱及低温处理。以0 h处理的三七样品为对照, 不同时间点取样提取三七主根、须根、茎、叶的RNA后进行实时荧光定量PCR分析, 检测PnMYB1R1的表达水平。盐胁迫能够显著影响PnMYB1R1表达, 主根中PnMYB1R1的表达水平在36 h内显著上升, 36 h达到最高, 是0 h该基因表达量的3.1倍; 须根、茎、叶PnMYB1R1基因的表达量在12 h内显著升高, 并在12 h达到最高水平, 分别为0 h表达量的4.3倍、9.7倍和4.6倍, 随后表达量降低(图 9A)。低温胁迫下, 主根中PnMYB1R1基因表达水平在24 h内显著升高, 并在24 h表达量达到最高, 是0 h表达量的2.3倍; 须根PnMYB1R1基因的表达量在12 h内达到最高, 是0 h表达量的5.6倍, 之后表达水平逐渐降低; 茎中PnMYB1R1基因的表达量在12 h达到最高, 是0 h该基因表达量5.4倍, 之后逐渐降低, 在48 h时表达量又显著上升, 呈现双峰现象; 叶片中PnMYB1R1基因的表达量在24 h内逐渐降低, 之后在36 h上升到最高, 然后逐渐降低(图 9B)。干旱胁迫下, 主根和茎中PnMYB1R1基因的表达量在24 h内逐渐降低, 36 h升高, 并达到表达量最高, 之后逐渐降低; 须根中PnMYB1R1基因的表达量在12 h内降低, 之后逐渐升高, 36 h显著升高并达到表达量最高, 之后逐渐降低; 叶中PnMYB1R1基因的表达量在24 h内逐渐降低, 之后逐渐升高, 并在48 h显著升高达到最高, 为0 h该基因的表达量3.1倍(图 9C)。这些实验结果表明盐、冷和干旱胁迫均能够影响主根、须根、茎和叶中PnMYB1R1基因的表达量, 其中盐胁迫能够显著影响主根、须根、茎和叶中PnMYB1R1基因的表达水平。

|
Figure 9 Relative expression level of PnMYB1R1 gene under different abiotic stresses (A: Salt stress; B: Cold stress; C: Drought stress) in Panax notoginseng. Note: Repeat 3 samples, each for 3 times, * indicates the means are significantly different between 0 h and other treatments at P < 0.05, which evaluated by one way ANOVA in SPSS |
MYB转录因子家族作为植物中一类重要的转录因子家族[27], 其在植物生长发育、次生代谢调控及植物防御反应中起到重要的作用。根据MYB保守结构域的数目, 将其分为4个亚类[15], 目前研究最多的是R2R3-MYB型转录因子, 关于1R-MYB转录因子的研究相对比较少。随着基因组学研究的进步, 1R-MYB转录因子逐渐从多个植物中鉴定出来, 如马缨杜鹃[28]中鉴定了85个1R-MYB转录因子, 山楂[18]中鉴定了35个1R-MYB转录因子, 葡萄[19]中鉴定了109个1R-MYB转录因子。Deng[12]发现R2R3-MYB转录因子在三七皂苷生物合成过程中起到重要作用[29], 但是关于三七中1R-MYB转录因子的研究尚未见报道。本研究根据转录组测序结果, 通过RT-PCR从三七主根中克隆到PnMYB1R1的全长cDNA序列。PnMYB1R1含有一个保守的R3结构域, 属于1R-MYB转录因子, 与茶(Camellia sinensis)、河岸葡萄(Vitis riparia)、胡桃(Juglans regia) 1R-MYB转录因子具有较高的同源性。首次在大肠杆菌中异源表达了三七PnMYB1R1蛋白, 重组蛋白以可溶性蛋白存在, 为进一步研究PnMYB1R1的生物学功能奠定了基础。
大量证据表明1R-MYB蛋白定位于植物细胞核。例如漆树TvMYB1[23]的TvMYB1、掌叶大黄RpMYB4[30]等都能够定位于植物的细胞核中。本研究中将PnMYB1R1构建到含有GFP的双元表达载体上, 利用拟南芥瞬时表达系统实验证明PnMYB1R1主要定位于细胞核中。MYB转录因子具有转录激活活性或者转录抑制活性, 如拟南芥AtMYBR-57和白菜BcMYB1R203均为1R-MYB转录因子, 具有转录激活活性[31]; 大豆GmMYBZ2对目的蛋白的转录活性具有抑制作用[32]。将PnMYB1R1序列构建到载体pGBKT7上, 转化酵母菌株, 结果表明PnMYB1R1具有转录激活活性, 可以与下游基因启动子结合, 调控下游基因的表达。不同植物MYB转录因子在不同组织器官中具有不同的表达模式, 基因的表达模式可以预测基因的功能。如小麦中1R-MYB转录因子TaLHY在叶、茎和茎尖中的表达量相似, 但是在根中表达量最低, 说明TaLHY主要在叶、茎和茎尖中发挥功能[33]。在本研究中, 三七PnMYB1R1基因也具有器官特异性, 在主根中三七表达量最高, 茎、叶次之, 须根中PnMYB1R1表达量最少, 因此PnMYB1R1基因主要在主根中发挥作用。
1R-MYB转录因子在植物防御反应中起到重要作用。如小麦中1R-MYB转录因子TaLHY在抗条锈菌中起到重要作用[33]; 鹰嘴豆中的1R-MYB转录因子TUS38128在干旱胁迫下表达量显著上升[34]; 当水稻中OsMYB48基因过表达时, 植株抗旱性增强, 促进体内内源基因的积累[35]。近期的研究也表明不同胁迫下1R-MYB转录因子的表达具有器官特异性, 如干旱处理可使漆树根中TvMYB1的表达量先增高后降低, 但茎、叶中的表达量却呈现先下降后升高的趋势[23]; 核桃1R-MYB类转录因子JrEFM1受到干旱胁迫、低温胁迫等非生物胁迫影响显著; 但不同器官受到影响程度不同, 在低温下, 核桃根中JrEFM1表达量随处理时间增加, 呈现显著升高的趋势, 但叶中的JrEFM1表达量却呈现先降低后升高的趋势[24]。虽然植物中很多1R-MYB转录因子在植物防御反应中的功能被研究, 但是三七中1R-MYB转录因子的功能还未见报道。盐、干旱和低温胁迫是三七生长过程中最常见的非生物胁迫, 能够影响三七的生长发育和产量。本研究发现非生物胁迫下PnMYB1R1表达在不同组织和器官中出现了差异性表达, 盐胁迫能够显著提高三七主根、须根、茎、叶PnMYB1R1基因的表达水平; 低温胁迫能够显著提高三七主根、茎中PnMYB1R1基因的表达水平; 干旱胁迫, 能够显著提高三七须根中PnMYB1R1基因的表达量。本研究丰富了R1-MYB转录因子在植物防御反应中的功能研究, 为后续三七1R-MYB转录因子的功能研究和利用基因工程手段改变不同器官中1R-MYB转录因子表达量, 从而选育三七抗逆的优良品种, 提高胁迫下三七产量和品质提供良好的理论支撑。
作者贡献: 石玥负责PnMYB1R1转录活性验证、亚细胞定位、器官特异性分析及论文初稿撰写; 满金辉负责PnMYB1R1克隆和生物信息学分析、PnMYB1R1基因不同胁迫下的表达分析及论文的初步撰写; 江伟业、张靖晗、张志飞参与进行PnMYB1R1生物信息学分析; 尹光耀、王馨、黄钰莹负责RNA的提取; 张媛负责三七样品的收集。魏胜利、王晓晖负责论文思路设计, 指导实验, 论文撰写与修改。所有作者参与论文修改。
利益冲突: 无相关利益冲突。
| [1] |
Ma N, Gao MJ, Zeng J, et al. Comparison of the content of saponins in fresh Panax notoginseng and dried Panax notoginseng[J]. Chin Tradit Herb Drugs (中草药), 2004, 35: 92-93. |
| [2] |
China Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of Chin (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2020.
|
| [3] |
Ou XH, Wang L, Guo LP, et al. Soil-plant metal relations in Panax notoginseng: an ecosystem health risk assessment[J]. Int J Environ Res Public Health, 2016, 13: 1-14. |
| [4] |
Tian M, Li LN, Yang YG, et al. Rapid characterization of saponins in fresh and steamed notoginseng root slices by liquid extraction, surface analysis-mass spectrometry[J]. Acta Pharm Sin (药学学报), 2020, 55: 123-130. |
| [5] |
Shi Y, Pu RF, Guo LP, et al. Formula fertilization of nitrogen and potassium fertilizers reduces cadmium accumulation in Panax notoginseng[J]. Arch Agron Soil Sci, 2020, 66: 343-357. DOI:10.1080/03650340.2019.1616176 |
| [6] |
Cao XJ, Shen XY, Shen Q, et al. Responses of forests to pest and drought disturbance in mojiang county, yunnan province[J]. J Cent South Univ Forest Technol (中南林业科技大学学报), 2018, 38: 57-63. |
| [7] |
Zhao SY, Xing HN, Yang QL. Effect of regulated deficit irrigation in the vegetative growth stage on the growth of Panax notoginseng and the microenvironment of its root zone[J]. J Hunan Agric Univ Nat Sci (湖南农业大学学报·自然科学版), 2019, 45: 94-98. |
| [8] |
Meng XX, Huang LF, Dong LL, et al. Analysis of global ecology of Panax notoginseng in suitability and quality[J]. Acta Pharm Sin (药学学报), 2011, 51: 1483-1493. |
| [9] |
Fan R. Several problems that should be hold in saline-alkali land greening construction[J]. J Nouth Agric (北方农业学报), 2006, 7: 225-226. |
| [10] |
Zhang Y, Wang LH, Chen CL, et al. Soil salinity effect on germination rate and seedling growth of cotton[J]. China Cotton (中国棉花), 2009, 36: 13-16. |
| [11] |
Zheng QT, Yang ZQ, Wang MT, et al. Effects of low temperature stress on photosynthetic characteristics of Panax notoginseng[J]. North Hort (北方园艺), 2020, 451: 127-134. |
| [12] |
Deng B. Molecular Cloning and Functional Study of PnMYB 1 Transcription Factor Involved in Biosynthetic Regulation of Panax notoginseng Saponins (调控三七皂苷生物合成PnMYB1转录因子的克隆与功能研究)[D]. Kunming: Kunming University of Science and Technology, 2017.
|
| [13] |
Chen J, Tang XH, Ren CX, et al. Cloning and expression analysis of MYB transcription factor genes in safflower[J]. Acta Pharm Sin (药学学报), 2018, 53: 144-149. |
| [14] |
Xie DJ, Ye YJ, Yang DM, et al. Identification and analysis of the R2R3-MYB transcription factor based on a transcriptome database in Morinda officinalis[J]. Acta Pharm Sin (药学学报), 2020, 55: 160-167. |
| [15] |
Wang L, Huang Q, Zhang L, et al. Genome-wide characterization and comparative analysis of MYB transcription factors in Ganoderma species[J]. G 3-Genes Genomes Genetics, 2020, 10: 2653-2660. |
| [16] |
Liu SJ, Wan HJ, Ye QJ, et al. Progress of studies on MYB transcription factor family in plants[J]. Mol Plant Breed (分子植物育种), 2011, 9: 1835-1843. |
| [17] |
Jia G, Li B, Zhang DF, et al. Cloning and characterization of a novel R1-MYB transcription factor in maize[J]. Prog Nat Sci-Mater, 2009, 19: 1089-1096. DOI:10.1016/j.pnsc.2009.02.004 |
| [18] |
Li XY, Yang ZY, Ji W, et al. Excavation and comparative analysis of MYB family based on hawthorn flowers with different colors[J]. J Nucl Agric Sci (核农学报), 2021, 35: 55-65. |
| [19] |
Hou HM, Wang H, Yin XJ, et al. Expression and functional analysis of VpMYBR1 gene resistant to uncinula necator from Vitis pseudoreticulata[J]. Chin Agric Sci (中国农业科学), 2013, 46: 1408-1418. |
| [20] |
Wang F, Chen HW, Li QT, et al. GmWRKY27 interacts with GmMYB174 to reduce expression of GmNAC29 for stress tolerance in soybean plants[J]. Plant J, 2015, 83: 224-236. DOI:10.1111/tpj.12879 |
| [21] |
Jia T, Sainan MA, Yong B, et al. The clone of TrMYB1R1 from white clover and gene expression analysis[J]. Pratac Sci (草业科学), 2019, 36: 190-199. |
| [22] |
Ren M, Li M, Jia J, et al. Cloning and expression analysis of AmMYB1R in 1R-MYB gene from Ammopiptanthus mongolicus[J]. Mol Plant Breed (分子植物育种), 2018, 16: 1468-1474. |
| [23] |
Li MG, Huang XH, Li DP, et al. Identification of the TvMYB1 gene of toxicodendron vernicifluum and analysis of its drought response potential[J]. Acta Bot Boreali-Occid Sin (西北植物学报), 2021, 41: 392-397. |
| [24] |
Ma KH, Li ZY, Li DP, et al. On expresion paters of walnut R1-MYB transcription factor JrEFM1 responses to diferent streses and plant hormones[J]. J Southwest China Norm Univ (西南师范大学学报(自然科学版)), 2019, 44: 46-53. |
| [25] |
Chen Y, Yang X, He K, et al. The MYB transcription factor superfamily of Arabidopsis: expression analysis and phylogenetic comparison with the rice MYB family[J]. Plant Mol Biol, 2006, 60: 107-124. DOI:10.1007/s11103-005-2910-y |
| [26] |
Li L, He Y, Zhang Z, et al. OsNAC109 regulates senescence, growth and development by altering the expression of senescence- and phytohormone-associated genes in rice[J]. Plant Mol Biol, 2021, 105: 637-654. DOI:10.1007/s11103-021-01118-y |
| [27] |
Gao JJ, Shen XF, Zhang Z, et al. The myb transcription factor MdMYB6 suppresses anthocyanin biosynthesis in transgenic Arabidopsis[J]. Plant Cell Tiss Organ Cult, 2011, 106: 235-242. DOI:10.1007/s11240-010-9912-4 |
| [28] |
Zhang WX, Wang ZB, Qian CJ, et al. Genome-wide identification and bioinformatics analysis of MYB transcriptions in Rhododendron delavayi franch[J]. Mol Plant Breed (分子植物育种), 2018, 16: 34-40. |
| [29] |
Gu CM, Zhao CL, Zang LF, et al. Longitudinal changes of transcriptional levels of bHLH, MYB and WD40 and their relationships with total anthocyanin contents in the green-purple aerial stems of Panax notoginseng[J]. J Yunnan Agric Univ Nat Sci (云南农业大学学报: 自然科学版), 2020, 581-590. |
| [30] |
Li YM, Zhang N, Li H, et al. Cloning and expression characteristics of a transcription factor gene RpMYB4 in Rheum palmatum L.[J]. Acta Pharm Sin (药学学报), 2021, 56: 1190-1177. |
| [31] |
Shen XP. Transcriptome Analysis of Flower Buds and Characterization of Two MYB Transcription Factors Involved in Pollen Development in Brassica campestris (白菜花蕾转录组分析及两个花粉发育相关MYB转录因子的功能鉴定)[D]. Hangzhou: Zhejiang University, 2019.
|
| [32] |
Zhou ML, Hou HL, Zhu XM, et al. Soybean transcription factor GmMYBZ2 represses catharanthine biosynthesis in hairy roots of Catharanthus roseus[J]. Appl Microbiol Biotechnol, 2011, 91: 1095-1105. DOI:10.1007/s00253-011-3288-1 |
| [33] |
Zhang Z, Chen J, Su Y, et al. TaLHY, a 1R-MYB transcription factor, plays an important role in disease resistance against stripe rust fungus and ear heading in wheat[J]. PLoS One, 2015, 10: 1-13. |
| [34] |
Abirami R, Himabindu K, Pazhamala LT, et al. Gene expression and yeast two-hybrid studies of 1R-MYB transcription factor mediating drought stress response in Chickpea (Cicer arietinum L.)[J]. Front Plant Sci, 2015, 6: 1-10. |
| [35] |
Xiong HY, Li JJ, Liu PL, et al. Overexpression of OsMYB48-1, a novel MYB-related transcription factor, enhances drought and salinity tolerance in rice[J]. PLoS One, 2014, 9: e92913. DOI:10.1371/journal.pone.0092913 |
 2022, Vol. 57
2022, Vol. 57


