2. 中药材规范化生产教育部工程研究中心, 北京 102488;
3. 河北橘井药业有限公司, 河北 安国 071000
2. Engineering Research Center of Standardized Production of Chinese Medicinal Materials, Ministry of Education, Beijing 102488, China;
3. Hebei Jujing Pharmaceutical Co., Ltd., Anguo 071000, China
大柴胡汤始载于医圣张仲景所著《伤寒论》, 由柴胡、黄芩、芍药、半夏(洗)、枳实(炙)、大黄、大枣、生姜组成, 具有和解少阳、内泻热结之功。其常用于治疗胆囊炎、胰腺炎等消化系统疾病, 疗效明晰。然而, 现有研究多集中于临床[1]及药理探究[2], 质量研究[3]相对薄弱。为提升大柴胡汤质量标准, 合理的评价指标亟待明确。
2016年, 刘昌孝院士首次提出质量标志物的概念, 认为质量标志物是构建中药质量追溯系统、保证生产质量的关键因素。其以“五原则”为核心, 关联质量控制与药效, 进而表征方剂的整体功效[4]。而特征图谱具有整体性与动态性的特点, 能够客观反映汤剂所含成分, 可揭示成分的特征性、溯源性及可测性。网络药理学可从“药物-疾病-靶点”全方位解析方剂成分-药效的关联, 从而体现成分的有效性及配伍的合理性。基于此, 本研究以特征图谱结合网络药理学模式确定大柴胡汤的质量标志物, 为其质量控制及临床应用提供科学依据。思路图如图 1所示。
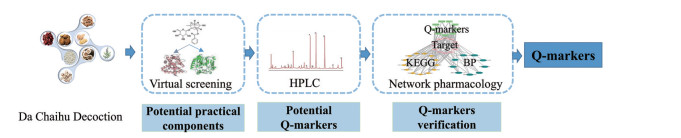
|
Figure 1 Technical route of the discovery of Da Chaihu decoction Q-markers. HPLC: High-performance liquid chromatography; KEGG: Kyoto encyclopedia of genes and genomes; BP: Biological process; Q-markers: Quality markers |
实验仪器 ACCHROM 6000高效液相色谱仪(北京华谱科仪科技有限公司); KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司); Sartorious BT25S型电子分析天平(北京塞利多斯仪器有限公司); YP6002B电子天平(上海力辰邦西仪器科技有限公司); A60型液体加热器(潮州市潮安区康雅顺电器有限公司)。
试剂与药材 柴胡皂苷b2 (批号DST191020-010, 99.41%)、柚皮苷(批号DSTDY009901, 98.50%)、橙皮苷(批号DSTDC003801, 98.84%)、新橙皮苷(批号DST200817-039, 98.63%)、黄芩苷(批号DST200227-023, 98.66%) 均购于成都德思特生物技术有限公司; 芍药苷(批号PS000825, 99.74%) 购于成都普思生物科技股份有限公司; 芍药内酯苷(批号O31GB166251, 91.40%)、柴胡皂苷b1 (批号A22GB146239, 99.70%)、汉黄芩苷(批号R31M9F62605, 98.9%)、没食子酸(批号C17D10C105977, 99.06%) 购于上海源叶生物科技有限公司。甲醇、乙腈、磷酸, 色谱级(美国Thermo Fisher Scientific公司); 纯净水(屈臣氏)。
各饮片由河北橘井药业、河北仁心药业、甘肃九州天润中药产业有限公司、云南旭禾姜业提供, 均经过北京中医药大学刘春生教授鉴定。采用随机数表法对各饮片进行随机组合并排序, 制备15批大柴胡汤标准煎液供试品, 其组合信息见表 1。P1~P6、P8~P10、P13、P14的北柴胡来自河北, P7、P11、P12、P15来自山西; P1、P5~P7、P9~P13的黄芩来自内蒙古, P2、P4、P8、P15来自山西, P3、P14来自河北; P1、P4、P6~P9、P12~P15的白芍来自安徽, P2、P3、P5、P10、P11来自浙江; P1、P2、P4、P7、P9、P10、P12、P13、P15的大黄来自四川, P3、P5、P6、P8、P11、P14来自甘肃; P1、P4、P7、P10的炒枳实来自重庆, P2、P3、P5、P6、P9、P13~P15来自江西, P8、P11、P12来自四川; P1、P9、P12、P15的姜半夏来自甘肃, P2~P8、P10、P11、P13、P14来自河北; P1~P4、P6、P8、P10、P11、P14、P15的大枣来自新疆, P5、P7、P9、P12来自河北, P13来自山东; P1~P15的生姜来自云南。
| Table 1 Fifteen batches of decoction pieces corresponding to the material reference of Da Chaihu decoction |
大柴胡汤潜在药效成分获取 本研究利用中药系统药理学数据库(TCMSP, http://lsp.nwu.edu.cn/tcmsp.php)[5]结合文献检索大柴胡汤各中药成分。后利用Discovery Studio 4.0 (DS 4.0) 对成分进行预处理。通过Minimize ligands模块在CHARMm力场下采用最陡下降法和共轭梯度法相结合的能量优化算法, 对成分进行能量最小化分析。随后对分子进行多构象的生成, 选择BEST模式, 生成255个构象, 从而构建大柴胡汤成分三维结构数据库。基于DS 4.0软件中Pharma DB数据库(共2 676个靶标, 5 780个晶体结构的基于受体结构药效团模型) 进行反向找靶研究, 搜索方式选择柔性搜索。选取打分值在0.9以上的匹配结果, 保留所有与大柴胡汤成分具有潜在相互作用的靶点[6]。
将反向找靶获得的靶点上传至Cytoscape 3.8.1, 构建蛋白互作网络(protein-protein interaction network, PPIN)。运用cyto Hubba插件, 计算PPIN节点的节点度、紧密度、介质性[7], 得到关键靶点。构建大柴胡汤成分-关键靶点网络图, 取度值排名靠前的35个成分作为大柴胡汤的关键潜在药效成分。
大柴胡汤特征图谱建立 为进一步确定成分的可测性、特有性及溯源性, 研究利用HPLC, 建立大柴胡汤的特征图谱, 对特征峰进行归属, 并经对照品进行指认。
色谱条件 Agilent ZORBAX SB-C18色谱柱: (250 mm × 4.6 mm, 5 μm); 流动相乙腈(A)-0.05%磷酸水(B); 梯度洗脱(0~5 min, 3%~3% A; 5~10 min, 3%~10% A; 10~15 min, 10%~12% A; 15~25 min, 12%~16% A; 25~30 min, 16%~16% A; 30~50 min, 16%~20% A; 50~55 min, 20%~20% A; 55~75 min, 20%~25% A; 75~85 min, 25%~46% A; 85~90 min, 46%~85% A; 90~100 min, 85%~85% A); 流速: 1.0 mL·min-1; 检测波长: 240 nm; 柱温: 30 ℃; 进样体积: 10 μL。
对照品溶液的制备 精密称取对照品芍药内酯苷10.01 mg、芍药苷11.30 mg、柚皮苷11.26 mg、橙皮苷11.30 mg、新橙皮苷10.90 mg、黄芩苷11.55 mg、汉黄芩苷5.30 mg、柴胡皂苷b2 5.36 mg、柴胡皂苷b1 5.89 mg、没食子酸5.21 mg置于10 mL量瓶内, 加甲醇溶解, 作为储备液。精密移取上述储备液置10 mL量瓶中, 甲醇定容, 摇匀, 即得混合对照品溶液。
供试品溶液的制备 依据古籍记载制备大柴胡汤煎液。取北柴胡110.4 g、黄芩41.4 g、白芍41.4 g、大黄27.6 g、生姜69.0 g、姜半夏60.0 g、炒枳实58.3 g、大枣55.2 g, 加水2 400 mL, 武火煮至沸腾转文火煎煮110 min, 得1 200 mL煎液。去渣滓后文火煎煮180 min, 得煎液600 ± 10 mL。将大柴胡汤标准煎液定容于1 000 mL量瓶中, 精密量取1 mL, 置10 mL量瓶内, 加入一定量的纯甲醇, 摇匀, 超声提取10 min (频率40 kHz, 功率300 W), 静置, 放冷, 用甲醇定容至刻度线, 摇匀, 过0.22 μm微孔滤膜, 取续滤液, 即得供试品溶液。同法制备单味药及阴性供试品溶液。
方法学考察 新橙皮苷为大柴胡汤的主要活性成分, 其保留时间稳定居中、峰面积适中, 故将其定为参照峰。
精密度 精密吸取同一供试品溶液, 按“色谱条件”项下操作, 连续进样测定6次, 以新橙皮苷为参照峰, 计算各共有峰的相对峰面积和相对保留时间RSD值。
重复性 按照“供试品溶液的制备”项下平行制备6份大柴胡汤供试品溶液, 按“色谱条件”项下进样测定, 计算各共有峰的相对峰面积和相对保留时间RSD值。
稳定性 精密吸取同一供试品溶液, 在0、2、4、8、10、12和24 h后按“色谱条件”项下进样测定, 计算各共有峰的相对峰面积和相对保留时间RSD值。
特征图谱的建立及分析 将15批大柴胡汤的图谱以cdf格式导入中药色谱指纹图谱相似度评价系统(2012A), 以S1的图谱为参照谱图, 采用中位数法, 设置时间窗宽度为0.2 min, 进行多点校正和色谱峰匹配, 得叠加特征图谱。并将特征图谱与单味药、阴性供试品比对, 对特征峰进行归属。
网络药理学分析 大柴胡汤为治疗胆囊炎的首选方剂, 研究利用网络药理学技术手段, 构建大柴胡汤潜在质量标志物治疗胆囊炎的蛋白互作网络, 以明确大柴胡汤潜在质量标志物的有效性及准确性。
大柴胡汤成分靶点及疾病靶点交集获取 以慢性胆囊炎(chronic cholecystitis)、急性胆囊炎(acute cholecystitis)、胆囊炎(cholecystitis) 为关键词, 分别检索OMIM (https://www.omim.org/)[8]、MalaCards (https://www.malacards.org/)[9]、GeneCards (https://www.genecards.org/)[10]数据库, 获得疾病靶点。并基于前期反向找靶结果获取大柴胡汤潜在质量标志物的作用靶点。利用Venny (https://bioinfogp.cnb.csic.es/tools/venny/index.html) 平台将大柴胡汤成分靶点映射到胆囊炎作用靶点中, 得到大柴胡汤治疗胆囊炎的潜在靶点。
大柴胡汤成分-胆囊炎网络构建 将成分与疾病交集靶点上传至STRING11.0数据库(http://string-db.org/)[11], 选择置信度大于0.4, 构建PPIN, 并在Cytoscape 3.8.1中进行可视化。
节点拓扑参数、基因功能 (GO) 富集与通路 (KEGG) 富集分析 为明确潜在质量标志物作用胆囊炎参与的生物过程及信号通路, 将交集靶点导入DAVID数据库(https://david.ncifcrf.gov/)[12], 进行GO与KEGG富集分析。以P < 0.05作为筛选条件, 获得大柴胡汤成分参与的生物过程及信号通路。
此外计算PPIN中节点的节点度、紧密度、介质性。按照公式(1) 计算, 取综合打分值排名前20%的靶点, 作为关键靶点。
| $ w_{i}=\frac{d_{i}-\bar{d}}{d_{s}}+\frac{b_{i}-\bar{b}}{b_{s}}+\frac{c_{i}-\bar{c}}{c_{s}} $ | (1) |
其中, wi为靶点综合打分值;
成分-靶点-通路-生物过程网络构建及分析 综合拓扑分析、GO和KEGG通路富集分析的结果, 将成分、靶点、通路、生物过程相对应, 导入Cytoscape 3.8.1软件, 构建大柴胡汤治疗胆囊炎的“成分-靶点-通路-生物过程”网络。
结果 1 大柴胡汤潜在关键药效成分基于TCMSP数据库及文献检索共获得大柴胡汤各中药成分共117个。为使后续大柴胡汤成分指认更具针对性, 将成分进一步筛选。认为大柴胡汤所含成分作用的关键靶点越多, 成分越重要。因此取度值排名靠前的35个成分, 作为大柴胡汤潜在关键药效成分, 如表 2所示。
| Table 2 The latent pharmacodynamic components of Da Chaihu decoction. MOL ID: Molecule identity document |
基于前期获得的潜在关键药效成分, 对大柴胡汤特征图谱进行指认, 以期获得可测的、特有的、稳定的活性成分。
2.1 方法学考察精密度考察结果显示, 各共有峰相对保留时间、相对峰面积RSD值均依次小于0.13%、3.7%, 表明该仪器精密度良好。重复性考察结果显示, 各共有峰相对保留时间、相对峰面积RSD值均依次小于0.16%、4.7%, 表明该方法重复性良好。稳定性考察结果显示, 各共有峰相对保留时间、相对峰面积RSD值均依次小于0.17%、3.6%, 表明该样品稳定性良好。
2.2 特征图谱的建立及分析共标定19个共有峰, 按照保留时间依次编号为1~19。通过比较单饮片煎液、缺阴性煎液, 将共有峰进行归属。峰2、峰3、峰4、峰5、峰8、峰9、峰10 (柚皮苷)、峰11 (橙皮苷)、峰12 (新橙皮苷) 属于炒枳实; 峰6 (芍药内酯苷)、峰7 (芍药苷) 属于白芍; 峰13 (黄芩苷)、峰14、峰15 (汉黄芩苷)、峰16属于黄芩; 峰17 (柴胡皂苷b2)、峰18 (柴胡皂苷b1)属于北柴胡; 峰19属于大黄。峰1 (没食子酸) 存在于白芍及大黄中, 属于两药共有峰。大柴胡汤全方、单味药及各指标性成分对比色谱图见图 2。15批大柴胡汤的图谱相似度均大于0.93, 说明大柴胡汤的化学成分基本稳定, 不同批次间的差异较小, 生成的对照图谱具有代表性。

|
Figure 2 Comparative chromatograms of Da Chaihu decoction, single-flavor drugs and index components. A: Mixed standard solution; B: Da Chaihu decoction; C: Rhei Radix et Rhizome; D: Scutellariae Radix; E: Bupleuri Radix; F: Zingiberis Rhizome Racens; G: Pinelliae Rhizome Praeparatum Cumzingibere et Alumine; H: Jujubae Fructus; I: Paeoniae Radix Alba; J: Aurantii Fructus Immaturus. 1: Gallic acid; 6: Albiflorin; 7: Paeoniflorin; 10: Naringin; 11: Hesperidin; 12: Neohesperidin; 13: Baicalin; 15: Wogonoside; 17: Saikosaponin b2; 18: Saikosaponin b1 |
依据质量标志物“五原则”的可测性、特有性、溯源性, 分析大柴胡汤特征图谱。对特征峰进行归属, 发现没食子酸存在于白芍、大黄中, 并不具有特征性, 不将其纳入标准。芍药内酯苷、芍药苷来源于白芍; 柚皮苷、橙皮苷、新橙皮苷源于炒枳实; 黄芩苷、汉黄芩苷源于黄芩; 柴胡皂苷b2、柴胡皂苷b1源于北柴胡。可见其成分在单饮片及全方煎液中均可被检测到, 体现了质量的传递与溯源。基于此, 将以上成分暂定为大柴胡汤潜在质量标志物。
3 网络药理学分析将成分与疾病进行整体关联, 可进一步明确大柴胡汤潜在质量标志物的有效性。基于此, 研究对大柴胡汤进行网络药理学研究。
3.1 大柴胡汤成分-胆囊炎网络构建及分析基于OMIM、MalaCards、GeneCards数据库, 去重后共获得705个疾病靶点。基于反向找靶得到大柴胡汤潜在质量标志物靶点412个。后得到大柴胡汤成分与疾病的交集靶点共66个。将交集靶点输入STRING数据库, 利用Cytoscape 3.8.1将其可视化, 部分结果如图 3所示。
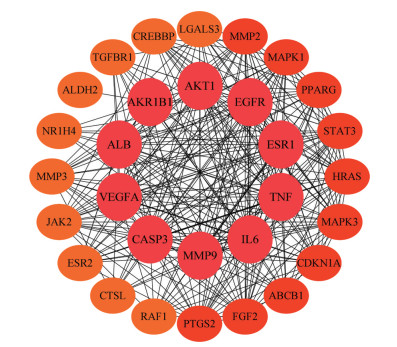
|
Figure 3 Protein-protein interaction network (PPIN) of intersection among Da Chaihu decoction components and cholecystitis targets. AKT1: RAC-alpha serine/threonine-protein kinase; AKR1B1: Aldo-keto reductase family 1 member B1; ALB: Afamin; VEGFA: Vascular endothelial growth factor A; CASP3: Caspase-3; MMP9: Matrix metalloproteinase-9; IL6: Interleukin-6 receptor subunit alpha; TNF: Tumor necrosis factor; ESR1: Estrogen receptor; EGFR: Epidermal growth factor receptor; LGALS3: Galectin-3; CREBBP: CREB-binding protein; TGFBR1: TGF-beta receptor type-1; ALDH2: Aldehyde dehydrogenase, mitochondrial; NR1H4: Bile acid receptor; MMP3: Stromelysin-1; JAK2: Janus kinase 2; ESR2: Estrogen receptor beta; CTSL: Procathepsin L; RAF1: RAF proto-oncogene serine/threonine-protein kinase; PTGS2: Prostaglandin G/H synthase 2; FGF2: Fibroblast growth factor 2; ABCB1: ATP-dependent translocase ABCB1; CDKN1A: Cyclin-dependent kinase inhibitor 1; MAPK3: Mitogen-activated protein kinase 3; HRAS: GTPase HRas; STAT3: Signal transducer and activator of transcription 3; PPARG: Peroxisome proliferator-activated receptor gamma; MAPK1: Mitogen-activated protein kinase 1; MMP2: 72 kDa type Ⅳ collagenase |
经拓扑分析共获得13个关键靶点, 包括丝氨酸/苏氨酸蛋白激酶1 (RAC-alpha serine/threonine-protein kinase, AKT1)、白介素6 (interleukin-6, IL6)、肿瘤坏死因子(tumor necrosis factor, TNF)、表皮生长因子受体(epidermal growth factor receptor, EGFR)、雌激素受体1 (liver carboxylesterase 1, ESR1)、肉瘤病毒癌基因(GTPase HRas, HRAS)、丝裂原活化蛋白激酶3 (mitogen-acti-vated protein kinase 3, MAPK3) 等, 以上可能为大柴胡汤治疗胆囊炎的关键靶标。经GO富集分析, 生物学过程、细胞组分以及分子功能各富集得到253、29、58条目。研究显示潜在质量标志物参与的生物学过程为丝裂原活化蛋白激酶的调控、一氧化氮生物合成过程、蛋白激酶B调控、胆汁酸和胆盐转运、胆汁酸代谢等过程; 细胞组分主要参与细胞外间隙、膜筏等定位; 分子功能主要涉及RNA聚合酶的转录、类固醇结合、一氧化氮合酶调节等。KEGG共富集得到93条通路, 部分结果如图 4, 主要参与缺氧诱导因子信号通路(HIF-1 signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)、叉头框转录因子信号通路(FoxO signaling pathway)、丝裂原活化蛋白激酶信号通路(MAPK signaling pathway)、磷脂酰肌醇3-激酶-蛋白激酶B通路(PI3K-Akt signaling pathway)、RAS相关蛋白信号通路(Rap1 signaling pathway)、胰岛素抵抗(insulin resistance pathway)、胆汁分泌(bile secretion) 等信号通路。
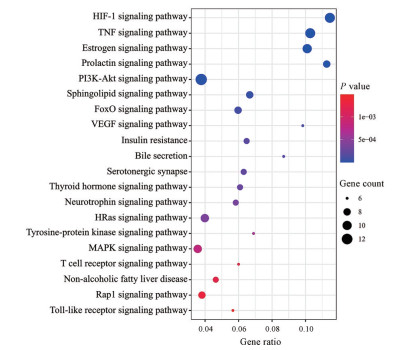
|
Figure 4 Enrichment analysis of KEGG signaling pathway. HIF-1: Hypoxia inducible factor-1; PI3K: Phosphatidylinositide 3-kinases; FoxO: Forkhead box O |
为进一步明确成分的有效性, 研究将成分、关键靶点、生物过程、信号通路进行联合分析, 如图 5。
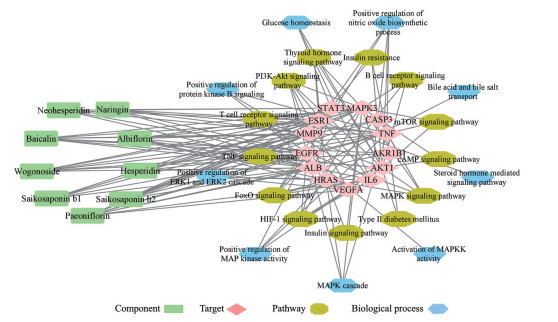
|
Figure 5 Components-key targets-signaling pathways-biological processes diagram. cAMP: Cyclic adenosine monophosphate; mTOR: Mammalian target of rapamycin; ERK1: Extracellular regulated protein kinases 1 |
炎症伴随胆囊炎的始终, 炎症因子会使胆囊部位产生水肿、坏死、疼痛等病理过程, 因此阻断炎症介质显得尤为重要。MAPK通路参与细胞增殖、凋亡、炎症反应等过程; Rap1通路可对细胞的迁移、分化进行调控。受病理刺激后, MAPK活化启动炎症介质的产生, 调控IL-1β、IL-6、IL-8等炎症因子的表达, MAPK通路又可激活TNF信号通路, 从而参与全身炎症反应。而Rap1为MAPK上游信号通路[13], 可参与巨噬细胞免疫应答过程, 显著减轻多种病因引起的炎症反应。本研究结果表明潜在质量标志物可能通过作用于IL6、TNF、ESR1、EGFR、MAPK3等靶点, 调节MAPK、TNF、Rap1等信号通路, 参与一氧化氮生物合成、MAPK级联等生物过程, 缓解炎症反应, 从而达到治疗胆囊炎的目的。
胆囊炎的重要诱因为高脂饮食, 其常伴随着多种代谢性疾病的发生。因此调节代谢紊乱, 可一定程度上控制胆囊炎的发生发展。FoxO信号通路参与转录、代谢、免疫等过程; PI3K-AKT通路调控细胞的生长、增殖; HIF-1信号通路参与血管生成、糖降解, 从而适应低氧环境。FoxO为胰岛素的上游通路, 其连接PI3K-AKT通路, 共同影响血糖的吸收与代谢, 并调节胰岛素的敏感性水平。而HIF-1又可激活PI3K-AKT信号通路, 共同调控糖类和脂质代谢。且相关研究报道, 其HIF-1α在胆囊癌患者中有较高表达[14]。胰岛素抵抗是代谢综合征类疾病的主要发病机制, 表现为机体维持正常血糖水平下降。当机体发生胰岛素抵抗时, 肝脏合成胆固醇增加, 促使结石形成, 胆道淤积, 引起胆道系统炎症反应。胆汁分泌可帮助脂类吸收, 调节糖脂代谢, 促进胆汁外排, 发挥利胆作用[15]。研究结果显示潜在质量标志物可能作用于AKT1、HRAS等靶点, 调节PI3K-AKT、胰岛素抵抗、胆汁分泌等信号通路, 参与胆汁酸和胆盐转运、胆汁酸代谢、血糖稳态等生物过程, 调节代谢, 进而治疗胆囊炎。
讨论本研究基于质量标志物“五原则”, 结合特征图谱与网络药理学, 共得到9个成分作为大柴胡汤的质量标志物。其建立的特征图谱准确度高、稳定性好, 可用于大柴胡汤的质量控制, 同时证明潜在质量标志物的可测性、特有性及传递性。然而虚拟筛选虽使特征图谱的指认更具针对性, 但质量标志物的整体性及有效性有待进一步验证。因此本研究引入网络药理学技术, 进一步证明质量标志物可表征大柴胡汤的整体功效。
胆囊炎发病机制为炎症反应、代谢紊乱、胆汁滞留、细菌感染等。大柴胡汤是治疗胆囊炎的经典名方, 临床常用药效可归结为抗炎[16, 17]、降脂[18, 19]、降糖[20]。君药柴胡中皂苷类成分柴胡皂苷b2、柴胡皂苷b1[21, 22], 臣药黄芩、枳实中黄酮类成分黄芩苷[23, 24]、汉黄芩苷[25]、柚皮苷[26, 27]、橙皮苷[28, 29]、新橙皮苷[30], 佐药白芍中萜类成分芍药苷[31, 32]、芍药内酯苷[33]均与大柴胡汤药效密切相关。经网络药理学分析, 潜在质量标志物可通过作用IL6、TNF、ATK1等靶点, 发挥抗炎、调节代谢等作用, 从而达到治疗胆囊炎目的。文献报道, IL6为促炎细胞因子, 其生成的炎症介质被释放到细胞外可引起炎症反应; TNF为肿瘤坏死因子, 其可刺激内皮细胞, 导致炎症及内源性发热。已有研究表明柴胡皂苷b2[21]、橙皮苷[28]、芍药苷[31, 32]、芍药内酯苷[33]均可作用于IL6、TNF靶点, 参与炎症相关疾病的治疗。ATK1为蛋白激酶, 可调节代谢过程, 参与胰岛素诱导的葡萄糖转运蛋白易位至细胞表面来调节葡萄糖摄取[34]。Yuan等[35]与Wu等[36]研究发现芍药苷、橙皮苷可调控ATK1的表达, 从而可改善代谢。结果表明大柴胡汤可通过多成分协同作用治疗胆囊炎, 体现了中药对疾病多成分、多靶点、多途径的调控理念, 可初步证明大柴胡汤质量标志物的有效性及配伍合理性。但为增强大柴胡汤质量标志物的准确性及可信度, 后期还可通过体外实验进一步验证。
本研究未对姜半夏、生姜、大枣进行峰的指认, 主要因为HPLC检测存在局限性, 对某些成分无响应或响应值低, 如大枣中的多糖, 在紫外条件下无吸收。其次, 一些特殊成分, 如生姜中挥发性成分, 长时间煎煮使其消失。半夏主要成分为核苷类成分, 其受热不稳定, 易分解, 有文献对包含半夏的方剂进行研究, 但均未对半夏进行指认。同时考虑到半夏、生姜、大枣为佐使药, 对于整方的贡献并不突出, 加之其相关成分报道较少, 因此质量标志物并未将大柴胡汤的八味中药全部涵盖。后期可对大柴胡汤的浸膏得率及pH值进行考察, 进一步提高大柴胡汤质量控制的全面性。
作者贡献: 吕恬仪负责实验研究及文章撰写; 刘亚楠参与部分实验研究; 任越参与文章思路的确定和论文的修改; 徐裕彬、张媛、魏胜利、张燕玲指导文章写作并审校全文。
利益冲突: 本研究内容无任何利益冲突。
| [1] |
Song XX, Huang JF, Tian M, et al. Pharmacological effect and clinical application of Da Chaihu decoction[J]. Acta Chin Med Pharmacol (中医药学报), 2019, 47: 112-116. |
| [2] |
Sun KB, Zhang XY, Zhang JX, et al. Effect of chemical components in Da Chaihu decoction on animal model of pancreatitis: a Bayesian network meta analysis[J]. J Tianjin Univ Tradit Chin Med (天津中医药大学学报), 2021, 40: 342-349. |
| [3] |
Liu XQ. Studies on HPLC fingerprints of Da Chaihu decoction and Guifu Dihuang Prescription (大柴胡汤和桂附地黄方的化学成分指纹图谱研究)[D]. Beijing: Academy of Military Medical Sciences, 2014.
|
| [4] |
Huo MQ, Peng S, Ren Y, et al. Discovery and application of traditional Chinese medicine efficacy markers based on systematic traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 3245-3250. |
| [5] |
Ru J, Li P, Wang J, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6: 13. DOI:10.1186/1758-2946-6-13 |
| [6] |
Gao FF, Pei YL, Ren Y, et al. Possible mechanisms by which Polygonati Rhizoma opposes atherosclerosis based on network pharmacology and molecular docking analyses[J]. Acta Pharm Sin (药学学报), 2020, 55: 2642-2650. |
| [7] |
Gong BJ, Ren Y, Ma J, et al. Study on mechanism of Tibetan medicine Zuomua decoction in treatment of hypertension based on network pharmacology and molecular docking technology[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 5383-5392. |
| [8] |
Amberger JS, Bocchini CA, Schiettecatte F, et al. OMIM. org: Online Mendelian Inheritance in Man (OMIM®), an online catalog of human genes and genetic disorders[J]. Nucleic Acids Res, 2015, 43: D789-D798. DOI:10.1093/nar/gku1205 |
| [9] |
Rappaport N, Twik M, Plaschkes I, et al. MalaCards: an amalgamated human disease compendium with diverse clinical and genetic annotation and structured search[J]. Nucleic Acids Res, 2017, 45: D877-D887. DOI:10.1093/nar/gkw1012 |
| [10] |
Stelzer G, Rosen N, Plaschkes I, et al. The GeneCards suite: from gene data mining to disease genome sequence analyses[J]. Curr Protoc Bioinformatics, 2016, 54: 1-30. |
| [11] |
Szklarczyk D, Gable AL, Lyon D, et al. STRING v11: protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Res, 2019, 47: D607-D613. DOI:10.1093/nar/gky1131 |
| [12] |
Dennis G, Sherman BT, Hosack DA, et al. DAVID: database for annotation, visualization, and integrated discovery[J]. Genome Biol, 2003, 4: P3. DOI:10.1186/gb-2003-4-5-p3 |
| [13] |
Shah S, Brock EJ, Ji K, et al. Ras and Rap1: a tale of two GTPases[J]. Semin Cancer Biol, 2019, 54: 29-39. DOI:10.1016/j.semcancer.2018.03.005 |
| [14] |
Wu TJ, Xu B, Zhao GH, et al. IL-37 suppresses migration and invasion of gallbladder cancer cells through inhibition of HIF-1α induced epithelial-mesenchymal transition[J]. Eur Rev Med Pharmacol Sci, 2018, 22: 8179-8185. |
| [15] |
Li Y, Gao XX, Qin XM. Advances in research of traditional Chinese medicine for promoting bile secretion and excretion[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 81-90. |
| [16] |
Zheng YH, Chen JF, She L, et al. Clinical effects of modified Da Chaihu decoction on acute cholecystitis[J]. J Emerg Tradit Chin Med (中国中医急症), 2018, 27: 462-464. |
| [17] |
Tan C, Wenrong AN, Liu J, et al. Influence of ChaiHu and DaHuang in different proportions on anti-inflammatory and analgesic effects of Da Chaihu decoction[J]. West J Tradit Chin Med (西部中医药), 2016, 29: 8-10. |
| [18] |
Cui H, Li Y, Wang Y, et al. Da Chaihu decoction ameliorates high fat diet-induced nonalcoholic fatty liver disease through remodeling the gut microbiota and modulating the serum metabolism[J]. Front Pharmacol, 2020, 11: 584090. DOI:10.3389/fphar.2020.584090 |
| [19] |
Chen J. Clinical observation on treating 45 cases of hyperlipemia with the Da Chaihu decoction[J]. Clin J Chin Med (中医临床研究), 2019, 11: 65-67. |
| [20] |
Zhang XH. Clinical observation on treatment of type 2 diabetes with Da Chaihu decoction[J]. Yunnan J Tradit Chin Med Mater Med (云南中医中药杂志), 2018, 39: 44-45. |
| [21] |
Shin JS, Im HT, Lee KT. Saikosaponin b2 suppresses inflammatory responses through IKK/IκBα/NF-κB signaling inactivation in LPS-induced RAW 264.7 macrophages[J]. Inflammation, 2019, 42: 342-353. DOI:10.1007/s10753-018-0898-0 |
| [22] |
Luo J, Wang J, Yang J, et al. Saikosaponin B1 and saikosaponin D inhibit tumor growth in medulloblastoma allograft mice via inhibiting the Hedgehog signaling pathway[J]. J Nat Med, 2022. DOI:10.1007/s11418-022-01603-8 |
| [23] |
Chen G, Chen X, Niu C, et al. Baicalin alleviates hyperglycemia-induced endothelial impairment 1 via Nrf2[J]. J Endocrinol, 2018, 240: 81-98. |
| [24] |
Wang X, Xie L, Long J, et al. Therapeutic effect of baicalin on inflammatory bowel disease: a review[J]. J Ethnopharmacol, 2022, 283: 114749. DOI:10.1016/j.jep.2021.114749 |
| [25] |
Zhu ZW, Jiang Q, Luo Y, et al. Synergistic effect of baicalin and wogonoside on NF-κB signaling pathway based on medium-efficiency equation[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2020, 26: 84-91. |
| [26] |
Ge SN. Naringin Protects Against Perfluorooctane Sulfonate-Induced Liver Injury Mice (柚皮苷保护PFOS诱导的小鼠肝损伤的研究)[D]. Nanchang: Nanchang University, 2019.
|
| [27] |
Kong F, Ding Z, Zhang K, et al. Optimization of extraction flavonoids from exocarpium citri grandis and evaluation its hypoglycemic and hypolipidemic activities[J]. J Ethnopharmacol, 2020, 262: 113178. DOI:10.1016/j.jep.2020.113178 |
| [28] |
Zhao J, Tian S, Lu D, et al. Systems pharmacological study illustrates the immune regulation, anti-infection, anti-inflammation, and multi-organ protection mechanism of Qing-Fei-Pai-Du decoction in the treatment of COVID-19[J]. Phytomedicine, 2021, 85: 153315. DOI:10.1016/j.phymed.2020.153315 |
| [29] |
Pla-Pagà L, Valls RM, Pedret A, et al. Effect of the consumption of hesperidin in orange juice on the transcriptomic profile of subjects with elevated blood pressure and stage 1 hypertension: a randomized controlled trial (CITRUS study)[J]. Clin Nutr, 2021, 40: 5812-5822. DOI:10.1016/j.clnu.2021.10.009 |
| [30] |
Wang XH, Dai C, Wang J, et al. Therapeutic effect of neohesperidin on TNF-α-stimulated human rheumatoid arthritis fibroblast-like synoviocytes[J]. Chin J Nat Med, 2021, 19: 741-749. |
| [31] |
Mao X, Chen WJ, Li YF, et al. An exploration into the therapeutic effects and molecular mechanisms of paeoniflorin in the treatment of adjuvant-induced arthritis rats by a network pharmacology-based research strategy[J]. Acta Pharm Sin (药学学报), 2019, 54: 2000-2010. |
| [32] |
Lai X, Wei J, Ding X. Paeoniflorin antagonizes TNF-α-induced L929 fibroblastoma cells apoptosis by inhibiting NF-κBp65 activation[J]. Dose Response, 2018, 6: 1559325818774977. |
| [33] |
Cai Z, Liu J, Bian H, et al. Albiflorin alleviates ovalbumin (OVA)-induced pulmonary inflammation in asthmatic mice[J]. Am J Transl Res, 2019, 11: 7300-7309. |
| [34] |
Peng Z, Aggarwal R, Zeng N, et al. AKT1 regulates endoplasmic reticulum stress and mediates the adaptive response of pancreatic β cells[J]. Mol Cell Biol, 2020, 40: e00031-20. DOI:10.1128/MCB.00031-20 |
| [35] |
Yuan N, Gong L, Tang K, et al. An integrated pharmacology-based analysis for antidepressant mechanism of Chinese herbal formula Xiao-Yao-San[J]. Front Pharmacol, 2020, 11: 284. DOI:10.3389/fphar.2020.00284 |
| [36] |
Wu J, Ye X, Yang S, et al. Systems pharmacology study of the anti-liver injury mechanism of citri reticulatae pericarpium[J]. Front Pharmacol, 2021, 12: 618846. DOI:10.3389/fphar.2021.618846 |
 2022, Vol. 57
2022, Vol. 57


