2. 西北农林科技大学化学与药学院, 陕西 咸阳 712100
2. College of Chemistry & Pharmacy, Northwest A&F University, Xianyang 712100, China
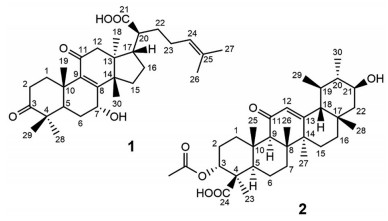
乳香是橄榄科(Burseraceae) 植物卡氏乳香树(Boswellia carterii Birdw.) 和齿叶乳香树(Boswellia serrate.) 的皮部渗出的胶状树脂, 主产于索马里、埃塞俄比亚等地。乳香为传统中药, 临床上常用于治疗风湿和类风湿性关节炎[1, 2]。乳香的化学成分主要是萜类, 包括五环三萜、四环三萜、二萜和单萜类化合物[3, 4]。此外, 还含有挥发油、有机酸和多糖类化合物[5, 6]。其中, 3-乙酰基-11-羰基-β-乳香酸(AKBA) 是乳香中五环三萜类的代表性化合物, 为目前许多学者的研究热点[[7, 8]。本实验借助硅胶柱色谱、制备薄层色谱和高效液相色谱, 对乳香中的化学成分进行分离和结构鉴定, 得到2个化合物(图 1), 分别是: 7α-羟基-3, 11-二羰基-甘遂-8, 24-二烯-21-酸(1) 和21β-羟基-3-乙酰基-11-羰基-β-乳香酸(2), 其中化合物1是新化合物, 化合物2为首次采用ECD计算确定其绝对构型的已知化合物。
|
Figure 1 Structures of compounds 1-2 |
化合物1, 白色无定形粉末。根据其HR-ESI-MS m/z: 519.289 1 [M+Cl]- (C30H44O5Cl计算值为519.279 9), 确定其分子式是C30H44O5。红外图谱3 200~2 500 cm-1的振动吸收峰表明有羧基, 3 427、1 700和1 657 cm-1振动吸收表明有羟基、羰基和双键的存在。1H NMR谱中7组甲基质子信号(表 1) 分别是: δH 1.00 (3H, s, CH3-18)、1.12 (3H, s, CH3-19)、1.68 (3H, s, CH3-26)、1.60 (3H, s, CH3-27)、1.13 (3H, s, CH3-28)、1.06 (3H, s, CH3-29) 和1.07 (3H, s, CH3-30), 1个双键烯质子信号δH 5.11 (1H, t, J = 7.2 Hz, H-24) 和1个连氧的次甲基质子信号δH 4.30 (1H, brs, H-7), 在化学位移δH 1.2~2.7之间是多个重叠的亚甲基和次甲基质子信号。13C NMR图谱中有30个碳信号, 结合DEPT和HSQC图谱, 其含有7个甲基、8个亚甲基、5个次甲基、7个季碳和3个羰基碳(δC 180.1、δC 202.6和δC 211.0), 故推断其为甘遂烷型四环三萜类化合物。
| Table 1 1H NMR (400 MHz in CD3OD) and 13C NMR (100 MHz in CD3OD) spectroscopic data of compound 1 |
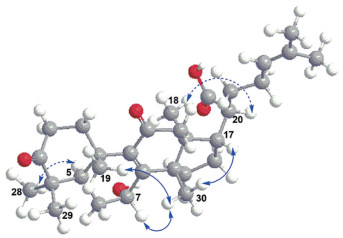
在HMBC谱中(图 2), δH 1.12 (3H, s, CH3-19) 与C-1、C-10、C-9 (δC 140.2) 和C-5相关; δH 1.07 (3H, s, CH3-30) 与C-8 (δC 160.9)、C-13、C-14和C-15相关; 且H-12与C-11 (δC 202.6) 相关; 由此确定C-8、C-9和C-11为α, β不饱和酮片段。在1H-1H COSY图谱上, H-5与H-6相关, H-6与δH 4.30 (H-7) 相关, 故推测OH连在C-7位置上。NOESY图谱中(图 3) CH3-18与H-20相关, H-5与CH3-28相关; H-2a与CH3-19、CH3-29相关, CH3-19与CH3-30相关, CH3-30与H-12a和H-17相关, 且H-7与CH3-30存在相关信号, 表明7-OH为α构型, 故确定其相对结构为7α-羟基-3, 11-二羰基-甘遂-8, 24-二烯-21-酸。此外, 该化合物的CD谱上, 在250 nm和289 nm显示正Cotton效应(图 4), 而且其实验ECD曲线和计算ECD曲线相吻合, 进一步确定其绝对构型为(5R, 7R, 10S, 13S, 14S, 17S, 20S)-7α-羟基-3, 11-二羰基-甘遂-8, 24-二烯-21-酸。

|
Figure 2 The key HMBC correlations of compound 1 |
|
Figure 3 The key NOESY correlations of compound 1 |

|
Figure 4 Experimental and calculated ECD spectra for compound 1 |
化合物2, 白色针状结晶(甲醇), 熔点164~166 ℃, [α]

|
Figure 5 Experimental and calculated ECD spectra for compound 2 |
旋转蒸发仪(日本EYELAN-1000); RY-1G型显微熔点测定仪(天津天光光学仪器有限公司); MCP 200型旋光测定仪(奥地利Anton Paar); Nicolet iN10型显微红外光谱仪(德国Thermo Fisher公司); LTQ-Orbitrap XL型质谱仪(德国Thermo Fisher公司); Bruker Avance AVIII-400核磁共振仪(德国Bruker公司); Agilent 1200型高效液相色谱仪(美国Agilent公司)。柱色谱硅胶(100~200目和200~300目) 和薄层色谱硅胶GF254 (青岛海洋化工厂); 柱色谱所用石油醚(PE)、乙酸乙酯(EtOAc) 和二氯甲烷(CH2Cl2) 等均为分析纯, 购于天津市富宇精细化工有限公司; HPLC中使用的乙腈(CH3CN) 均为色谱级别, 纯净水由杭州娃哈哈公司生产。
乳香于2019年3月购自购于安徽亳州药材市场, 经山东大学温学森教授鉴定为橄榄科植物卡氏乳香树(Boswellia carterii Birdw.) 的皮部渗出的胶状树脂, 保存在山东大学药学院天然药物化学研究所, 样品编号为2019003。
1 提取分离乳香4.50 kg, 粉碎后用95%乙醇提取4次, 每次2 h, 合并提取液后, 减压回收溶剂得到浸膏3.21 kg。取1.97 kg浸膏加乙酸乙酯溶解后用1% NaOH溶液萃取并调酸, 最后得到乳香总三萜酸类浸膏660.45 g。取浸膏50.00 g, 用200~300目硅胶柱色谱进行分离, 以石油醚-乙酸乙酯(100∶0, 99∶1, 98∶2, 97∶3, 96∶4, 95∶5, 90∶10, 80∶20和50∶50) 为洗脱剂进行分离, 得到25个组分Fr.1~Fr.25。Fr.22采用硅胶柱色谱, 以PE-EtOAc和CH2Cl2-CH3OH梯度洗脱后, 又分成15个亚组分Fr.22-1~Fr.22-15。Fr.22-9经过两次HPLC纯化(流动相依次为90% CH3CN和60% CH3CN, 检测波长247 nm; 流速1.5 mL·min-1; 保留时间分别为15 min和38 min) 得到化合物1 (2.48 mg)。Fr.22-10同样经过两次HPLC纯化(流动相依次为90% CH3CN和60% CH3CN, 检测波长247 nm; 流速1.5 mL·min-1; 保留时间分别为14 min和34 min) 得到化合物2 (2.84 mg)。
2 结构鉴定化合物1 白色无定形粉末, HR-ESI-MS m/z: 519.289 1 [M+Cl]- (C30H44O5Cl计算值为519.279 9), 483.311 4 [M-H]- (C30H43O5计算值为483.311 0); [α]
化合物2 白色粉末; HR-ESI-MS m/z: 527.337 7 [M-H]- (C32H47O6计算值为527.337 2); 熔点164~166 ℃; [α]
作者贡献: 冯亚美主要负责乳香化学成分的提取分离、化合物的结构鉴定和文章的整理。张强主要负责化合物1和化合物2的ECD图谱计算, 确定其绝对构型。尹立敏协助完成化合物结构鉴定。通讯作者孙隆儒对稿件负总责。
利益冲突: 本文不存在利益冲突。
| [1] |
Banno N, Akihisa T, Yasukawa K, et al. Anti-inflammatory activities of the triterpene acids from the resin of Boswellia carteri[J]. J Ethnopharmacol, 2006, 107: 249-253. DOI:10.1016/j.jep.2006.03.006 |
| [2] |
Shen T, Lou HX. Bioactive constituents of Myrrh and Frankincense, two simultaneously prescribed gum resins in Chinese traditional medicine[J]. Chem Biodivers, 2008, 5: 540-553. DOI:10.1002/cbdv.200890051 |
| [3] |
Verhoff M, Seitz S, Paul M, et al. Tetra- and pentacyclic triterpene acids from the ancient anti-inflammatory remedy Frankincense as inhibitors of microsomal prostaglandin E2 synthase-1[J]. J Nat Prod, 2014, 77: 1445-1451. DOI:10.1021/np500198g |
| [4] |
Sun XW, Geng YL, Wang X, et al. Cembrane-type diterpenoids from the gum resin of Boswellia carterii and their biological activities[J]. RSC Adv, 2020, 10: 746-755. DOI:10.1039/C9RA09776G |
| [5] |
Hosain NA, Ghosh R, Bryant DL, et al. Isolation, structure elucidation, and immunostimulatory activity of polysaccharide fractions from Boswellia carterii frankincense resin[J]. Int J Biol Macromol, 2019, 133: 76-85. DOI:10.1016/j.ijbiomac.2019.04.059 |
| [6] |
Mertens M, Buettner A, Kirchhoff E. The volatile constituents of frankincense-a review[J]. Flav Fragr J, 2010, 24: 279-300. |
| [7] |
Sun Y, Liu D, Xi RG, et al. Microbial transformation of acetyl-11-keto-β-boswellic acid and their inhibitory activity on LPS-induced NO production[J]. Bioorg Med Chem Lett, 2013, 23: 1338-1342. DOI:10.1016/j.bmcl.2012.12.086 |
| [8] |
Lv MH, Zhuang XB, Zhang Q, et al. Acetyl-11-keto-β-boswellic acid enhances the cisplatin sensitivity of non-small cell lung cancer cells through cell cycle arrest, apoptosis induction, and autophagy suppression via p21-dependent signaling pathway[J]. Cell Biol Toxicol, 2021, 37: 209-228. DOI:10.1007/s10565-020-09541-5 |
| [9] |
Yu JQ, Geng YL, Wang DJ, et al. Terpenes from the gum resin of Boswellia carterii and their NO inhibitory activities[J]. Phytochem Lett, 2018, 28: 59-63. DOI:10.1016/j.phytol.2018.09.010 |
| [10] |
Wang C, Dong PP, Zhang LY, et al. Regio- and stereo-selective oxidation of β-boswellic acids transformed by filamentous fungi[J]. RSC Adv, 2015, 5: 12717-12725. DOI:10.1039/C4RA16459H |
 2022, Vol. 57
2022, Vol. 57


